다양한 분말화 담체를 이용한 케토코나졸 함유 자가미세유화약물전달시스템의 제조 및 평가
Preparation and Evaluation of Ketoconazole-loaded Solid-SNEDDS (Self-Nanoemulsifying Drug Delivery System) using Various Solidification Carriers
Article information
Abstract
This study aimed to develop a solid self-nanoemulsifying drug delivery system (solid-SNEDDS) to enhance the formulation of ketoconazole (KTZ), a BCS Class II drug with poor solubility. Ketoconazole, which is insoluble above pH 3, requires solubilization for effective delivery. This SNEDDS comprises oil, surfactant, and co-surfactant, which spontaneously emulsify in the gastrointestinal tract environment to form nanoemulsions with droplet sizes less than 100 nm. The optimal SNE-vehicle composition of oleic acid, TPGS, and PEG 400 at a 10:80:10 weight ratio was determined based on the smallest droplet size achieved. This composition was used to prepare liquid SNEDDS containing ketoconazole. The droplet size and polydispersity index (PDI) of the resulting liquid SNEDDS were analyzed. Subsequently, solid-SNEDDS was fabricated using a spray-drying method with solidifying carriers such as silicon dioxide, crospovidone, and magnesium alumetasilicate. The physicochemical properties of the solid-SNEDDS were characterized by scanning electron microscopy and powder X-ray diffraction, and its solubility, droplet size, and PDI were evaluated. In particular, the solid-SNEDDS containing ketoconazole and crospovidone in a 2:1 weight ratio exhibited significantly enhanced solubility, highlighting its potential for improved medication adherence and dissolution rates.
1. Introduction
케토코나졸은(Ketoconazole, Fig. 1) Azole계 항진균제로 서 진균의 에르고스테롤 생합성을 억제하는 것으로 알려 져 있는 약물이다. 에르고스테롤은 진균 세포막 보전에 필 요한 주요 스테롤이며, 케토코나졸은 에르고스테롤의 전 구체인 스테롤 14α-탈메틸화효소(CYP51)를 표적으로 억 제하여 에르고스테롤의 생합성을 방해하며, 에르고스테롤 이 결핍된 진균은 세포막의 온전함을 유지하지 못하여 사 멸하게 된다[1]. 케토코나졸은 생물약제학적 분류 체계 (Biopharmaceutics Classification System, BCS)에서 Class II로 분류되고 있으며 낮은 용해도 및 높은 투과성을 가지 고 있다. pH 3 이하인 산성 환경에서는 용해도가 우수하 지만, pH 3 이상에서는 용해도가 1 mg/ml 미만으로 급격 히 떨어지며[2], 이러한 특성 때문에 높은 용해도 및 생체 흡수를 위해서는 낮은 pH의 위내 환경(pH < 3)이 필요하 다[2]. 그러나, 공복 위산도 값이 환자마다 다를 수 있고, 위에서 소장(pH 6~7)으로 약물이 이동함에 따라 케토코나 졸의 용해도가 낮아지기 때문에 생체이용률이 감소할 수 있는 단점이 있다.
케토코나졸과 같은 난용성 약물을 가용화 하는 방법으 로는 약물성분에 염을 형성[3], 또는 입자 크기를 축소하 는 등의 물리화학적 특성을 변형하거나 고체분산체를 제 조[4], 사이클로덱스트린 등을 이용하여 복합체화를 제조 하거나[5], 자가 유화 약물전달 시스템(Self-Emulsifying Drug Delivery System, SEDDS)을 이용하는 등 다양한 방 법을 통해 용해도를 높여 흡수율을 개선할 수 있다. 케토 코나졸은 Log P 값이 4.3인 친유성 약물이다. 따라서, 오 일에 잘 용해되는 특성을 가지고 있는 것으로 판단할 수 있다. 다양한 가용화 방법들 중 오일/계면활성제/ 공계면 활성제를 혼합한 SNE-veh icle에 약물을 함유하게 하여 에 멀젼화 하는 SEDDS 기술로 연구를 진행하여 자가 나노 유화 약물전달 시스템(SNEDDS)을 개발하였다[6-8].
본 연구에서는 난용성인 케토코나졸의 용해도 개선을 위해, 케토코나졸 및 올레인산, D-α-Tocopherol polyethylene glycol succinate(TPGS), Polyethylene glycol 400(PEG 400) 을 혼합하여 액상 SNEDDS를 제조하고, 고형화 담체인 콜로이달 실리카, 미분화된 크로스포비돈, 마그네슘 알루 미노메타실리케이트를 액상의 SNEDDS 조성물에 대한 고형화 담체로 첨가한 후, 분무건조기술을 이용하여 고형 SNEDDS를 제조하였다. 제조된 고형 SNEDDS에 대하여 주사 전자 현미경, 분말 X-선 회절을 이용하여 물리화학 적 특성을 확인하였으며, 수용해도 평가를 통해 케토코나 졸 단독 약물과 비교하였다.
다양한 고형화 담체를 첨가하여 분무건조 방법으로 고 형의 SNEDDS를 제조하는 것은 기존의 액상의 케토코나 졸 함유 SEDDS, SMEDDS 또는 SNEDDS에서 한 단계 발전한 것으로, 본 연구에서는 여러가지 고형화 담체 중 액체 케토코나졸 함유 SNEDDS의 고형화를 가능하게 한 세 가지 담체의 특성을 고려하여 선정된 고형화 담체를 추가하여 제조한 고형 SNEDDS의 특성 및 용해도 개선 정도를 비교함으로써 의미가 있는 연구결과를 도출할 수 있었다고 사료된다.
2. Experimental
2.1 시약 및 기기
본 연구에서 사용한 케토코나졸은 Nangjing Baijingyu Pharmaceutical Co.,Ltd.(Nangjing, China)에서 제공받아 사 용하였다. D-α-Tocopherol polyethylene glycol succinate (TPGS)는 보령제약(Seoul, South Korea)에서 공급받았다. 콜로이달 실리카 및 마그네슘 알루미노메타실리케이트는 한미약품(Hwasung, South Korea)에서 제공받았다. 올레인 산은 마성상사(Pyeongtaek, South Korea)에서 구매하였다. Polyethylene glycol 400(PEG 400) 및 미분화 크로스포비 돈은 BASF(Ludwigshafen, Germany)에서 구매하여 사용 하였다. 메탄올, 아세토니트릴 및 트리에틸아민은 대정화 금(Siheung, South Korea)에서 구매하여 사용하였다. 기타 시약 및 용매류는 모두 시판 시약급을 사용하였다.
HPLC 분석 장비는 Agilent 1260 Infinity HPLC system (Agilent Technologies, Santa Clara, CA, USA)를 선택하였 으며, Chemstation software, G1311C 1260 Quat Pump, G1314 1260 VWD 검출기를 사용하였다. HPLC 분석용 컬럼은 VDSpher 100 C18 M-E(VDS optilab, Berlin, Germany), 4.6 mm × 250 mm, 5 μm particle size를 선정하여 사용하였다. 용해도 평가를 위한 진탕 항온수조는 대한랩 테크사의 LSB-045S(South Korea)를 사용하였다. 원심분 리기는 Micro Centrifuge 1730R(Gyrozen, Gimpo, South Korea)을 사용하였다. 고형의 SNEDDS 제조를 위한 분무 건조기는 Yamato사의 Model - ADL311 Spray dryer (Tokyo, Japan)을 사용하였다. 입자크기 및 다분산지수 (PDI) 측정을 위해 Zetasizer Nano ZS analyzer(Malvern Instruments, Malvern, UK)를 사용하였다.
2.2 케토코나졸을 함유한 SNEDDS제조 및 평가
SNEDDS의 제조에 사용할 부형제 선택을 위하여 케토 코나졸 약 10mg를 다양한 오일과 10%(w/v) 계면활성제 용액 1ml가 들어있는 e-tube에 넣은 후 혼합액을 37°C의 진탕 항온수조에서 5일간 보관하며 수시로 vortexer로 섞 어주면서 포화시켰다[8]. 각 e-tube를 원심분리기를 사용 하여 13,500 g에서 10분 동안 원심분리하고 상층액을 0.45 μm 주사용 필터를 통해 여과한 후 얻어진 맑은 용액을 이 동상으로 희석하여, 상기의 HPLC 시스템을 이용하여 분 석하였다. 이동상은 아세토니트릴과 0.15% 트리에틸아민 용액이 45 : 55의 부피비로 혼합된 용액을 인산으로 pH가 3.3이 되도록 조정하여 사용하였다. 유속은 1.0 ml/min, 컬 럼온도는 25°C, 흡수파장은 243 nm, 주입 부피는 20 μl로 실험하였다[9].
용해도 연구결과를 바탕으로 선택된 오일(올레인산), 계 면활성제(TPGS) 및 공계면활성제(PEG 400)를 Pseudoternary phase diagram을 이용하여 가벼운 교반 조건에서 자가 유화 되는 영역을 확인하는 실험을 수행하였다. 비율 별로 혼합된 용액 0.2 ml를 37°C의 정제수 300 ml에 넣고 magnetic bar로 교반 하였다. 분산이 잘 되며 에멀전을 형 성하는 ‘good’ 영역은 회색으로, 분산이 잘 되지 않고 coalescence되거나 오일상의 크림을 형성하는 ‘bad’ 영역 은 흰색으로 구분하여 판단하였다. 모든 실험 은 3회 반복 하여 진행하였다[8]. 액상의 SNEDDS는 올레인산, TPGS 및 PEG 400을 10/80/10의 질량비로 혼합하여 제조한 혼 합물에 케토코나졸 20mg을 용해시켜 최종적으로 1 g이 되도록 하여 제조하였다. 최종 혼합물을 vortexing 하여 투 명한 용액을 얻었고, 자가 유화 및 입자 크기는 상 분리 또는 탁도의 변화를 확인한 후 Zetasizer를 사용하여 입자 크기 및 PDI를 측정하였다.
2.3 케토코나졸을 함유한 고형 SNEDDS제조 및 평가
케토코나졸을 포함한 액상의 SNEDDS 조성물을 에탄올 에 용해시킨 후 고형화 담체로 콜로이달 실리카, 미분화된 크로스포비돈 및 마그네슘 알루미노메타실리케이트를 각 각 Table 2와 같은 조성으로 현탁 시켰다. 제조된 현탁액 을 교반 하면서 분무건조기를 이용하여 분무 건조하여 고 형의 SNEDDS를 제조하였다. 분무건조 조건은 흡입구 온 도 80°C, 배출구 온도 60°C, 분무 공기 압력은 6 kg/cm2 이 되도록 설정하였다.
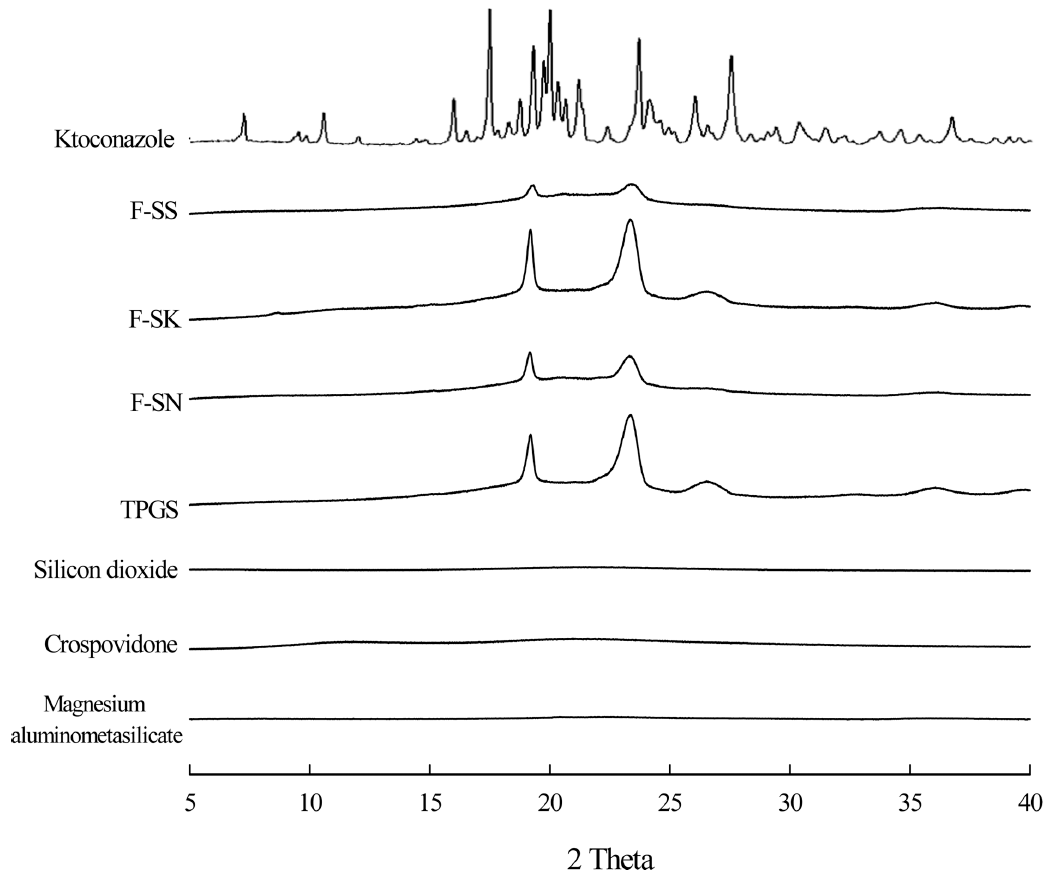
케토코나졸 약물 분말, 콜로이달 실리카(F-SS), 미분화 된 크로스포비돈(F-SK) 및 마그네슘 알루미노메타실리케 이트(F-SN)를 이용하여 제조된 고형의 SNEDDS 조성물 대한 형태 및 표면 특성을 방사형 주사 전자 현미경(FESEM, Tescan-MIRA3; Kohoutovice, Czech)을 이용하여 형 상을 확인하였다. 결정상태는 Rigaku X-Ray Diffractometer( D/MAX-2500 PC, RIgaku Corporation; Tokyo, Japan)을 사용하여 평가하였다. 결정상태 평가를 위한 분 석기기는 miniflex goniometer와 Cu Kα1 단색 방사선 소 스가 장착되어 있었으며, 상온에서 40mA와 40 kv 조건, 5° ≤ 2θ ≤ 40°에서 초당 0.02°의 증가 속도로 측정하였다. 케토코나졸이 함유된 액상 및 고형의 SNEDDS 입자크기 및 다분산지수는 Zetasizer를 사용하여 동적광산란(Dynamic light scattering, DLS)을 이용하여 측정하였다. pH 1.2, pH 4.8, pH 6.8 및 정제수에서의 용해도 평가를 위하여 케 토코나졸이 함유된 고형의 SNEDDS를 케토코나졸로서 10 mg이 되도록 e-tube에 정밀하게 칭량하여 각 시험액을 1 ml씩 넣은 후 혼합액을 37°C의 진탕 항온수조에서 5일 간 보관하며 수시로 vortexer로 섞어주면서 포화시켰다. 각 e-tube를 원심분리기를 사용하여 13,500 g에서 10분 동 안 원심분리하고 상층액을 0.45 μm 주사용 필터를 통해 여과한 후 얻어진 맑은 용액을 이동상으로 희석하여, 상기 의 HPLC 시스템을 이용하여 분석하였다. 이동상은 아세 토니트릴과 0.15% 트리에틸아민용액이 45 : 55의 부피비 로 혼합된 용액을 인산으로 pH가 3.3이 되도록 조정하여 사용하였다. 유속은 1.0 ml/min, 컬럼온도는 25°C, 흡수파 장은 243 nm, 주입 부피는 20 μl로 실험하였다[9].
3. Results and Discussion
3.1 케토코나졸을 함유한 SNEDDS제조 및 평가
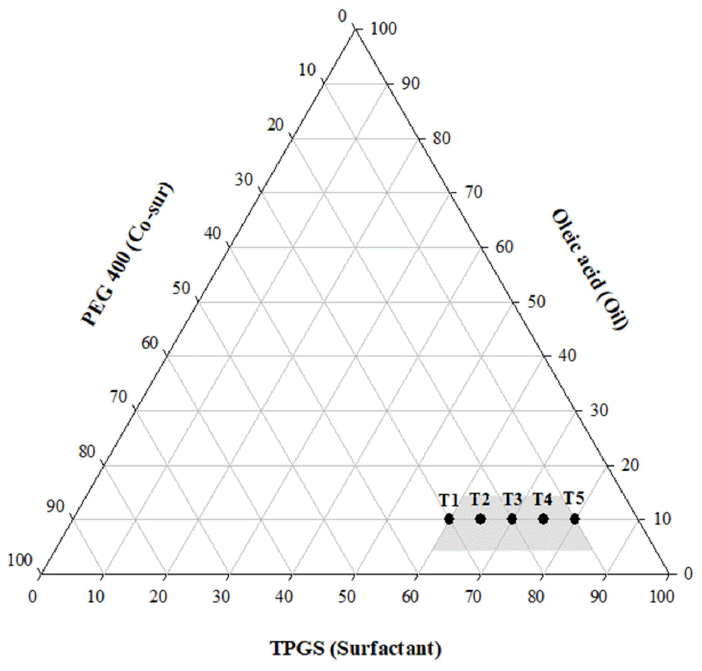
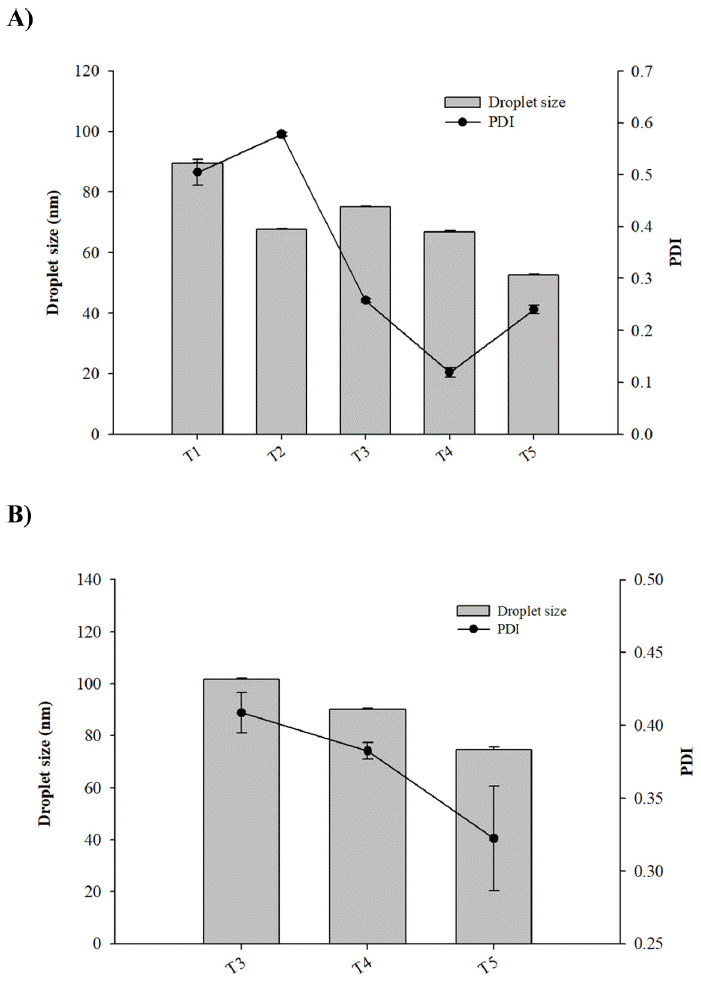
케토코나졸 함유 SNEDDS 개발에 사용할 오일 및 계면 활성제, 공계면활성제를 선정하기 위해 다양한 오일과 계 면활성제에 대해 케토코나졸의 용해도를 평가하였다. 케 토코나졸의 물에 대한 용해도는 7.71 ± 0.29 μg/ml로 매우 낮은 값을 나타내었으며, 총 16종류의 오일 중에서 올레 인산이 케토코나졸의 용해도를 가장 크게(4680.9 ± 139.0 μg/ml) 증가시켰다(Table 1, Fig. 2B). 계면활성제 총 15가 지 중 TPGS(4192.6 ± 77.4 μg/ml)와 PEG 400(3278.1 ± 63.1 μg/ml)의 순으로 용해도가 높은 것으로 나타났다(Table 1, Fig. 2A). 실험 결과에 따라 용해도 증가가 가장 우수한 올 레인산과 TPGS 및 PEG 400을 오일, 계면활성제 및 공계 면활성제로 선택하여 Pseudo-ternary phase diagram을 구 성하여 자가유화조성물을 제조하였다(Fig. 3). TPGS는 지 용성 비타민 E의 수용성 형태로 의약품 제제에서 다양한 용도로 활용되어져 왔으며 친수성-친유성 균형(HLB)값은 약 13.2이다[10]. PEG 400은 HLB값이 TPGS보다 낮으므 로(약 10.2) [11] 이 실험에서 공계면활성제로 선정되었다. 이는 안정적인 나노 에멀젼 형성을 위해선 낮은 HLB값을 가진 계면활성제와 높은 HLB값을 가진 계면활성제를 적 절히 혼합해야 하기 때문이다[12]. 올레인산/TPGS/PEG 400를 이용하여 다양한 비의 조성물을 제조하여 자가 유 화 영역을 식별하고 SNEDDS에 적절한 농도비를 선택한 결과 올레인산/TPGS/PEG 400의 부피비가 10/60/30내지 10/80/10(T1, T2, T3, T4, T5)에서 자가 유화를 통한 미세 에멀젼 형성에 효과적인 것으로 나타났다(Fig. 4A). 분산 된 에멀젼의 액적 크기는 약물의 용해도, 흡수 및 생체이 용률에 밀접한 관련이 있기 때문에 에멀젼 제형에서 중요 한 평가요소로 알려져 있다[13]. Fig. 4A의 결과를 바탕으 로 입자 크기와 다분산 지수가 작은 T3, T4, T5를 선정하 여 케토코나졸 첨가 유무에 따른 추가실험을 진행하였다. 에멀젼의 액적 크기가 가장 작은 T5의 경우 약물을 함유 하지 않는 액상 SNEDDS는 약 52.6 ± 0.2 nm의 액적 크기 와 다분산지수 0.2를 나타내었고, 약물을 함유하는 SNEDDS 는 74.8 ± 0.9 nm 액적 크기와 0.3의 다분산지수를 나타내 며 큰 차이는 보이지 않는 것으로 판단하였으며(Fig. 4B), 최종적으로 고형 SNEDDS를 제조할 SNE-vehicle조성은 미세액적의 크기가 가장 작은 T5(Oil/Sur/Co-sur가 10/80/ 10의 부피 비)으로 선정하였다.
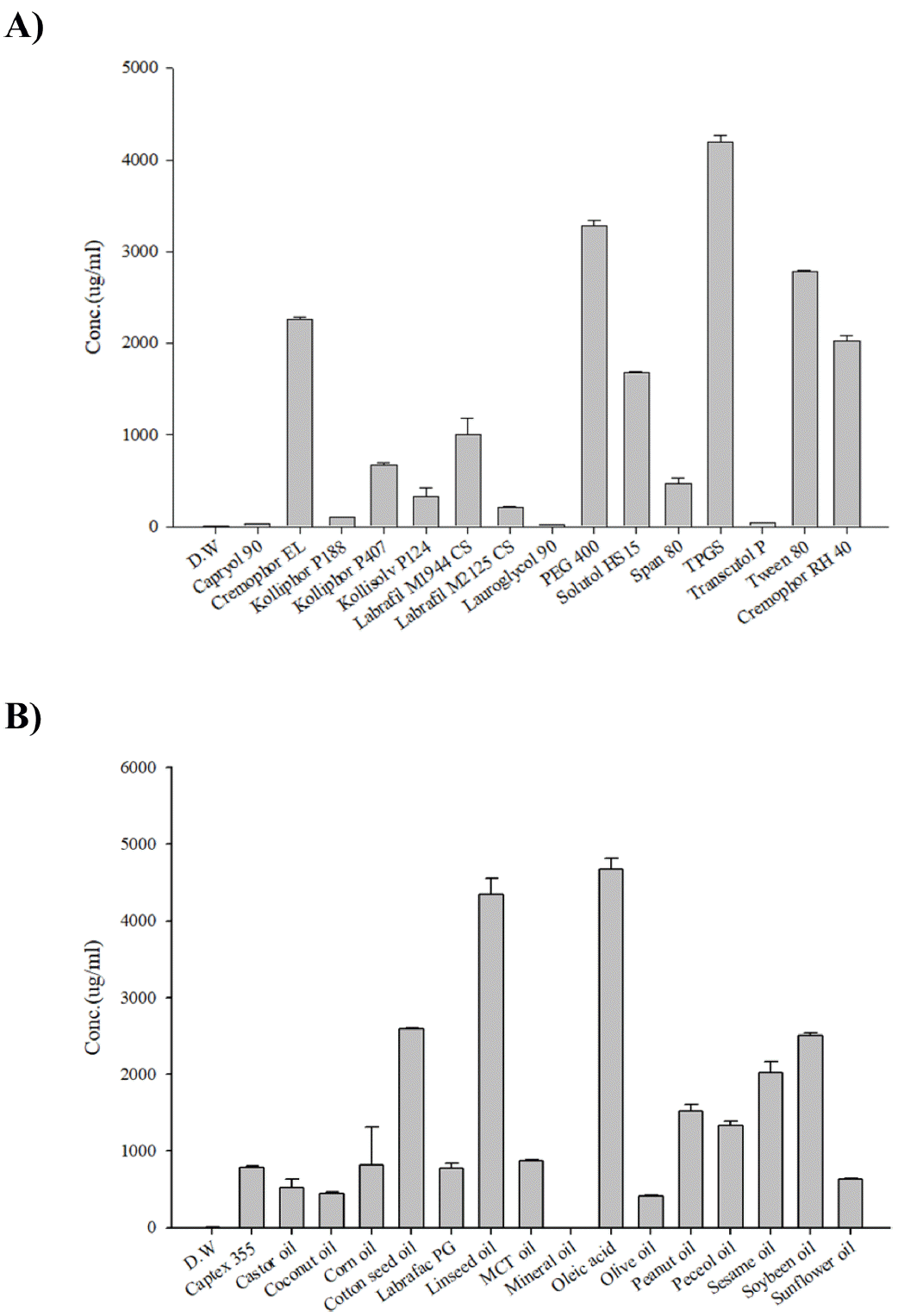
Screening of carrier for enhancing Ketoconazole solubility: (A) surfactant screening; (B) oil screening. Each value represents the mean ± S.D. (n=3)
3.2 케토코나졸 고형 SNEDDS의 제조 및 물리화학적 특성 평가
Table 2의 조성비에 따라 케토코나졸이 함유된 고형 SNEDDS를 제조한 후 고형 SNEDDS에 대한 평가를 진행 하였다. 제조된 모든 고체분산체의 수득율은 70% 이상이 었으며, 조성물 중 약물의 함량은 모두 약 90%를 나타냈 다(Table 2). 분무 건조하여 수득 된 조성물은 흰색에서 미 백색을 띠는 고운 파우더 상태인 것을 확인할 수 있었다 (Fig. 5). F-SS의 경우 케토코나졸이 함유된 액체 SNEDDS 와 콜로이달 실리카가 2 : 1(w/w)로 제조된 고형 SNEDDS 이며, F-SK의 경우 케토코나졸 함유 액체 SNEDDS와 미 분화된 크로스포비돈이 2 : 1(w/w)로 분산하여 제조한 고형 의 SNEDDS이다. F-SN은 케토코나졸 함유 액체 SNEDDS 와 알루미노메타실리케이트를 2 : 1(w/w)로 하여 제조한 고형 SNEDDS이다. 콜로이달 실리카, 미분화 크로스포비 돈 및 마그네슘 알루미노메타실리케이트는 다공성 고체 담체로서 액상의 약물 또는 의약 조성물을 고형화 할 때 자주 사용되는 물질이다[14]. Fig. 6은 주사 전자 현미경을 이용하여 케토코나졸, 고형화 담체 및 분무건조로 제조한 F-SS, F-SK, F-SN의 형태학적 특성과 대략적인 크기를 확 인한 결과이다. 콜로이달 실리카는 콜로이드 실리카 입자 가 구형의 입자군을 형성하고 있은 것으로 확인되었고, 미 분화된 크로스포비돈은 불규칙한 형태로 주름진 모양을 띄고 크기는 대략 10 μm로 확인되었다. 마그네슘 알루미 노메타실리케이트는 가장 원형에 가까운 형태로 보였으며 크기는 대략 100 μm로 가장 큰 입자크기를 보였다. 케토 코나졸 원료의 입자 모양은 다각형의 결정형인 것을 알 수 있었으며, F-SK를 제외한 분무건조 샘플의 입자모양은 주성분(케토코나졸)이 녹아서 담체에 흡착된 상태로 구형 에 가까운 형태를 띠는 것을 확인할 수 있었다. 콜로이달 실리카를 함유한 F-SS의 작은 입자는 5 μm 이하에서 큰 입자는 10 μm 정도로 입자의 크기가 다양했으며, F-SK는 미분화된 크로스포비돈의 형상과 매우 비슷한 울퉁불퉁한 한 무정형으로 보였고 마그네슘 알루미노메타실리케이을 함유한 F-SN은 구형에 가깝고 입자들의 크기가 비슷했으 나 그 크기가 100 μm 정도로 분무건조 결과물들 중 가장 큰 것을 알 수 있었다. 또한 분말 X선 회절 패턴을 이용 하여 확인한 결과(Fig. 7), 케토코나졸의 고유 결정 피크가 분무건조 제조 샘플에는 나타나지 않는 것으로 확인되었 으나 첨가제인 TPGS의 결정 피크가 분무건조 제조 샘플 에서 확인되었다. F-SS, F- SK 및 F-SN를 액상 SNEDDS 의 입자크기 및 다분산지수를 측정하는 방법과 동일하게 케토코나졸로서 20 mg 양이 되도록 칭량하여 300 ml 물에 분산 후 Zetasizer로 측정하였다. Table 2에 제조된 고형의 SNEDDS 조성물을 물에 분산시켰을 때의 Z-평균 직경과 다분산지수를 정리하였다. F-SN의 Z-평균 직경 값이 36.7 ± 0.3 nm로 가장 작았으나 다분산지수가 1.3으로 높 은 값을 보였고 이는 F-SN의 입자 조성이 단분산이 아닌 다분산임을 뜻하며 입자크기가 고르지 않음으로 사료되었 다[15]. F-SS와 F-SK의 Z-평균 직경 값과 다분산지수에 큰 차이는 없음으로 보이나 Table 3의 용해도 시험결과 FSK가 F-SS에 대비하여 우수한 용해성을 보이는 것으로 확인되었다. 이는 F-SK의 표면이 F-SS보다 복잡한 형태를 지닌 것으로 보이므로 비표면적의 크기 차이에 의한 것이 라고 사료되었다. F-SN은 물과 pH 4.0, pH 6.8에서는 용 해도가 원료대비 크게 증가하였지만 다른 두개 분무건조 제조 샘플보다는 용해도가 떨어지며 pH 1.2 용액에서는 오히려 케토코나졸 원료분말보다 용해도가 떨어지는 양상 을 보였다. 이는 F-SN의 입자 크기가 다른 분무건조 분말 보다 매우 크기 때문에 비표면적이 가장 작으므로 용해도 가 떨어지는 것으로 판단하였다. 이와 같은 결과로 확인했 을 때 F-SK조성이 다른 두개의 조성보다 뛰어난 처방으로 사료되었다.
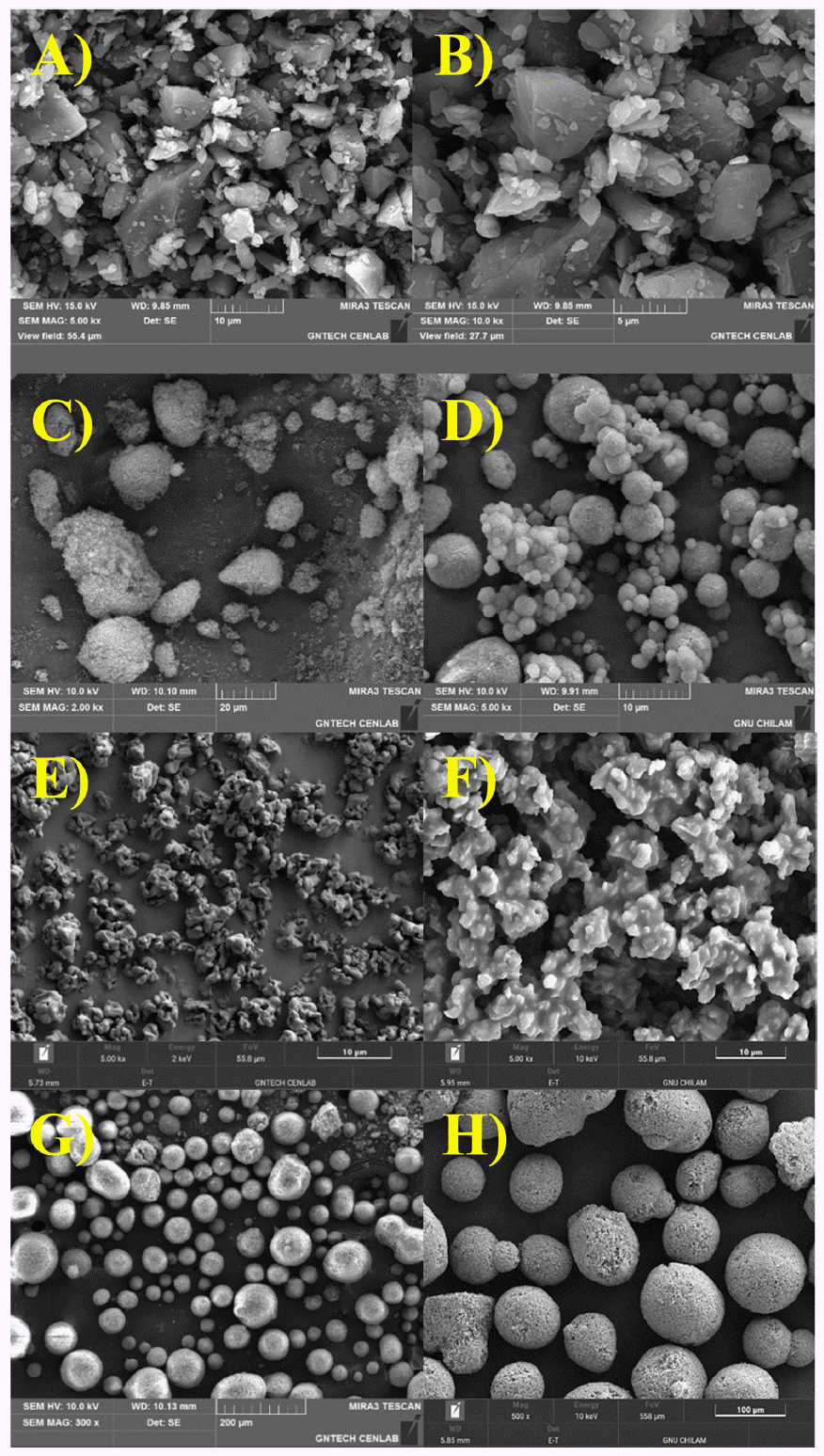
Scanning electron microscope images: (A) ketoconazole (×5,000); (B) ketoconazole (×10,000); (C) silicon dioxide (×2,000); (D) SS (×5,000); (E) crospovidone (×5,000); (F) SK (×5,000); (G) magnesium aluminometasilicate (×3,000); (E) SN (×500).
4. Conclusion
본 연구에서는 난용성 약물인 케토코나졸의 용해도를 개선시키기 위해 오일과 계면활성제에 대한 용해도를 확 인한 후 실험결과에 따라 유상(올레인산), 계면활성제 (TPGS) 및 공계면활성제(PEG 400)를 선정하여 액상 SNEDDS를 제조하였다. 이후 콜로이달 실리카, 미분화된 크로스포비돈 및 마그네슘 알루미노메타실리케이트를 고 형화 담체로 첨가하여 분무건조 기술로 고형의 SNEDDS 를 제조하고 제조된 고형 SNEDDS에 대하여 용해도, 함 량 및 물리화학적 특성을 평가하였다. 제조된 고형의 SNEDDS는 F-SK, F-SS, F-SN 순으로 용해도가 개선됐으며, 케토코나졸의 용해도 개선에 가장 우수한 고형 SNEDDS 처방은 케토코나졸 함유 액체 SNEDDS와 Crospovidone이 2 : 1의 질량비를 가지는 처방으로서 pH 1.2를 제외한 모 든 용액에서 난용성을 보이는 케토코나졸의 용해도를 7000배 이상 개선시켜 우수한 용해도를 보였다. 본 연구 에서 Crospovidone을 이용하여 얻어진 케토코나졸을 함유 한 고형 SNEDDS인 F-SK의 조성물의 경우 난용성인 케 토코나졸의 경구용 고형제제화를 위한 연구에 활용가능성 이 있는 나노 입자 약물전달시스템으로 활용될 수 있음을 기대할 수 있다.
Acknowledgements
이 논문은 정부(과학기술정보통신부)의 재원으로 한국 연구재단의 지원을 받아 수행된 연구임(No. 2021R1F1A 1063123).