NCM(Li[Ni,Co,Mn]O2)계 폐 리튬이차전지로부터 NiSO4의 회수와 이를 이용한 LiNiO2 제조 및 전기화학적 특성
Fabrication of LiNiO2 using NiSO4 Recovered from NCM (Li[Ni,Co,Mn]O2) Secondary Battery Scraps and Its Electrochemical Properties
Article information
Abstract
The electrochemical properties of cells assembled with the LiNiO2 (LNO) recycled from cathode materials of waste lithium secondary batteries (Li[Ni,Co,Mn]O2), were evaluated in this study. The leaching, neutralization and solvent extraction process were applied to produce high-purity NiSO4 solution from waste lithium secondary batteries. High-purity NiO powder was then fabricated by the heat-treatment and mixing of the NiSO4 solution and H2C2O4. Finally, LiNiO2 as a cathode material for lithium ion secondary batteries was synthesized by heat treatment and mixing of the NiO and Li2CO3 powders. We assembled the cells using the LiNiO2 powders and evaluated the electrochemical properties. Subsequently, we evaluated the recycling possibility of the cathode materials for waste lithium secondary battery using the processes applied in this work.
1. 서 론
리튬이온이차전지는 납축전지와 소형전지가 대부분을 차지하고 있지만 최근 에너지저장장치, 전지자동차, 중대 형 시장이 증가하면서 앞으로의 시장 성장을 견인할 것으 로 예상된다[1,2]. 리튬이온이차전지를 구성하는 4대부품 (양극, 음극, 전해질, 분리막)의 하나인 양극을 형성하고 있는 양극활물질의 경우, 전체 리튬이온이차전지 비용의 약 22%를 차지할 정도로 비중이 크며 원료는 희유금속을 포함하고 있다[3]. 그러나 현재 우리나라의 경우에는 대부 분의 금속자원을 수입에 의존하고 있는 대표적인 자원빈 국이기에 세계시장의 흐름 속에서 국내 산업의 생존권 확 보를 위해 안정적인 자원공급체계를 구축할 필요성이 있 다. 이에 폐 전지로부터 희유금속을 회수하는 기술은 자원 고갈 문제를 해결하는 것과 동시에 대부분 수입에 의존하 고 있는 전지의 핵심 소재를 국내에서 안정적으로 공급할 수 있는 점에서 중요성이 높은 분야이다.[4] 이러한 이유 로 지금까지 국내에서도 희유금속을 회수하는 방법에 관 한 많은 연구가 진행되었으나, 현재의 기술수준으로는 상 업적으로 순수한 양극활물질의 재활용은 아직 어려움이 많다[5-10].
리튬이차전지에서 양극활물질은 핵심소재로 금속염의 구성 성분에 따라 LCO(LiCoO2), NCM(Li[Ni,Co,Mn]O2), NCA(Li[Ni,Co,Al]O2), LMO(LiMn2O4) 및 LFP(LiFePO4) 등으로 구분한다. LCO는 에너지용량과 사이클수명특성이 우수하여 상업화 초기부터 광범위하게 사용되어 왔으며 현재도 많이 사용되고 있으나, 2007년부터 원가절감과 안 전성 강화를 위해 고가인 LCO의 코발트(Co)성분 일부를 니켈(Ni), 망간(Mn) 및 알루미늄(Al)으로 대체하는 삼원합 금 물질인 NCM과 NCA로 대체되는 추세이다. LMO와 LFP는 경제성과 안정성이 우수하여 전기차용 리튬전지에 일부 적용 중이나, LMO는 LCO 대비 에너지 용량이 낮고 LFP는 원재료가 가장 저렴하고 안전성이 우수하지만 순 도 및 전기전도도가 낮은 문제점을 가지고 있다. 위에 제 시된 양극활물질에 대해 가격 및 성능 등을 고려하였을 때 앞으로 NCM과 LMO가 양극활물질로 크게 각광받을 것으로 예상되며, 주요 조사 기관에서의 예측도 NCM과 LMO의 수요가 앞으로 연평균 50% 정도의 증가를 예상하 고 있다.[11] 하지만 수요가 증가한다는 것은 그 만큼 버 려지는 전지도 많아 진다는 것을 의미하기 때문에 NCM 및 LMO계 폐 리튬이차전지의 재활용 기술도 매우 중요 해질 것으로 판단된다. 또한 지금까지 폐 리튬이차전지로 부터 양극활물질의 재활용에 있어서는 주로 LiCoO2에 대 해 많은 연구가 있었으나[12-15] LiNiO2에 대해서는 그 연 구결과가 많지 않다.
따라서 본 연구에서는 NCM(Li[Ni,Co,Mn]O2)계 폐 리 튬이차전지로부터 양극활물질을 회수 및 재활용하는 실험 을 실시하였다. 먼저 NCM(Li[Ni,Co,Mn]O2)계 폐 리튬이 차전지의 스크랩으로부터 순도 높은 황산니켈(NiSO4) 용 액을 회수하고, 그 용액을 이용하여 리튬이차전지의 양극 활물질인 LiNiO2(LNO)를 제조하여 그 전기화학적 특성을 평가하였다. 이를 통해 폐 리튬이차전지로부터 양극활물 질의 재활용 가능성을 평가하고자 하였다.
2. 실험방법
2.1. NCM(Li[Ni,Co,Mn]O2)계 폐 리튬이차전지로부터 NiSO4 회수 및 LiNiO2 합성
리튬이온 이차전지용 LiNiO2 양극활물질을 제조하기 위 한 과정은 NCM(Li[Ni,Co,Mn]O2)계 폐 리튬이차전지로부 터 침출법과 추출법을 적용하여 니켈황화물(NiSO4)을 회 수하는 단계와 회수한 니켈황화물을 이용하여 양극활물질 인 LiNiO2를 합성하는 두 단계로 구분할 수 있다.
우선 니켈황화물을 회수하는 공정은 크게 4가지 공정으 로 정리할 수 있다. 첫 번째 공정은 원료를 얻는 단계로써 폐 리튬이차전지의 집전체에서 양극물질을 분리한 다음, 물리적인 방법으로 양극물질을 집전체로부터 탈리시키고, 탈리된 양극물질을 분쇄 및 진동을 통해 분말형태로 얻는 것이다. 두 번째 공정은 침출단계로 황산과 과산화수소를 투입하여 원료분말에 포함되어 있는 양극물질인 금속산화 물을 모두 용해시켜 금속황화물을 만드는 공정이다. 이때 황산농도, 반응시간, 과산화수소(H2O2)의 농도 그리고 황 산과 과산화수소의 투입 시점을 변수로 하여 금속산화물 의 최적 침출조건을 도출하였다. 세 번째 공정은 중화공정 으로써 얻고자 하는 니켈황화물을 제외한 불순물을 제거 하는 과정으로, 침출단계가 끝난 금속황화물에 가성소다 (NaOH)로 pH를 조절하여 금속황화물 중에서 니켈황화물을 제외한 불순물을 침전시켜 제거하는 것이다. 네 번째 공정은 용매추출과정으로 D2EHPA(Di-(2-ethylhexyl)phosphoric acid; C16H35O4P)와 CYTEC사의 CYANEX®272(bis-(2,4,4-trimethylpentyl)phosphinic acid; C16H35O2P) 추출용 용제를 차례로 사용하여 불순물을 침전시켜 제거하는 공정이다. 이 네 번째까지의 공정을 통해 순수한 니켈황화물 용액을 얻게 된다.
다음은 위의 단계로부터 회수한 고순도의 니켈황화물 용액을 양극활물질인 LiNiO2로 제조하는 단계이다. 먼저 회수한 고순도의 니켈황화물 용액을 증류수와 희석하여 6wt.%의 니켈황화물을 만들고, 이 용액을 상온에서 옥살 산(Oxalic acid; H2C2O4)과 1:1.5의 몰비로 혼합하여 교반 하였다. 두 용액의 몰비를 1:1.5로 선택한 이유는 이 비율 에서 1시간 동안 교반하였을 때 가장 많은 침전물을 얻을 수 있었기 때문이다. 교반과정을 통해 생성된 불순물을 걸 러내고 증류수로 세척한 다음, 160°C에서 12시간 동안 건 조한 후 산소 분위기에서 하소(Calcination) 공정을 통해 니켈산화물(NiO) 분말을 제조하였다. 순수한 니켈산화물 을 제조하여야만 고순도의 LiNiO2를 얻을 수 있기 때문에 X-선 회절분석을 통해 순수 니켈산화물의 제조 여부를 확 인하였다. 이렇게 제조된 NiO 분말과 리튬의 원료가 되는 Li2CO3 분말을 혼합한 후, 고온의 산소 분위기에서 열처리 하여 본 연구에서 얻고자 하는 양극활물질인 LiNiO2 분말 을 제조하였다. 순수한 LiNiO2 분말이 제조되었는지를 확 인하기 위해 X-선 회절분석을 하였으며, 최종적으로 상기 에서 합성된 LiNiO2를 양극활물질로 사용하여 셀을 제조 한 다음 전기화학적 특성을 평가하였다.
2.2. 전기화학적 특성평가
제조된 LiNiO2의 전기화학적 특성평가를 위해 전지 (cell)는 Swagelok cell을 이용하였다.
작동전극은 제조된 LiNiO2와 도전재인 Ketjen Black 그 리고 바인더인 PVdF를 질량비 8:1:1로 볼밀링을 이용해 혼합하였고, 이를 10 × 10 mm 크기의 알루미늄 호일에 고 르게 도포하였다. 전해질로는 1:1 체적비를 갖는 Ethylene Carbonate(EC)와 Ethyl Methyl Carbonate(EMC)에 1 mol 의 LiPF6 리튬 염을 용해시켜 사용하였다. 분리막은 Celgard 2400 그리고 음극은 리튬금속을 사용하였다. 전지 조립의 모든 공정은 아르곤 분위기의 글러브 박스 내에서 실시하였으며, Cut-off 전압은 3.0~4.3 V, 그리고 전류밀도 는 0.5와 1의 C-rate로 전기화학적특성을 평가하였다.
3. 결과 및 고찰
3.1. 원료물질 분석
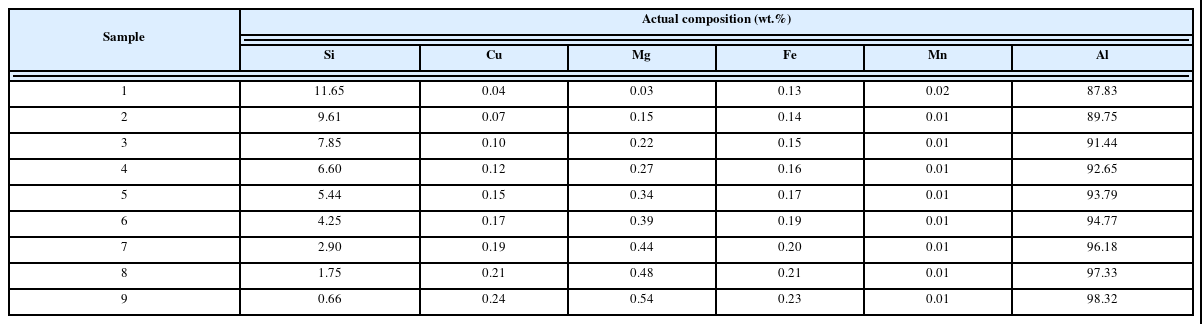
먼저 NCM(Li[Ni,Co,Mn]O2)계 폐 리튬이온이차전지의 양극부분을 분리한 스크랩을 분쇄하여 분말을 채취하였다. 침출시험을 하기 전 NCM(Li[Ni,Co,Mn]O2)계 양극활물질 에 어떤 금속산화물들이 포함되어 있는지 알아보기 위해 ICP(inductively coupled plasma)분석을 실시하였다. ICP분 석을 위한 전처리는 왕수(HNO3:HCl=1:3 vol. ratio)에 분 말을 넣고 100°C에서 2시간 동안 가열하면서 교반하였다. 그 결과를 아래 표 1의 두 번째 열에 ppm단위로 나타내 었으며, 표에서 보는 바와 같이 코발트(42.51%), 니켈 (9.24%), 리튬(6.98%) 그리고 망간(4.42%)이 다량 함유되 어 있었다. 또한, 아래 표 1에 원료물질에 포함되어 있는 금속산화물이 황산과 반응할 때의 화학식(표 1의 1열)과 원료물질 100 g에 포함되어 있는 금속산화물을 침출시키 는데 필요한 황산의 양(표 1의 3열)을 화학반응식으로 계 산한 이론적 값을 나타내었다. 즉, 원료 100 g에 포함되어 있는 모든 금속산화물을 침출시키기 위해 필요한 황산의 총량을 화학반응식으로 계산한 결과 약 147 g이라는 것을 알 수 있었다.
3.2. 침출
침출시험은 황산농도, 침출시간, 과산화수소 농도 그리 고 황산과 환원제의 투입 순서를 변수로 두었다. 이러한 침출시험을 통해 원료물질에 포함되어 있는 니켈산화물 및 금속산화물들을 최대한 빠른 시간에 최대한 많은 량을 침출시킬 수 있는 최적 조건을 찾고자 하였다. 침출시험은 제반변수를 변화시키면서 침출시간에 따른 용액을 채취하 고, 진공 여과하여 여과된 침출액으로부터 니켈의 함량을 분석하는 것으로 실시하였다. 실험 시작을 위한 초기 침출 조건은 앞서 원료물질의 분석을 통해 계산한 황산 147 g, 원료분말 100 g과 물 300 cc를 혼합하였고, 최대 반응속 도를 얻기 위하여 반응온도를 최대한 높이되 물의 끓는 온도(100°C)를 고려하여 95°C로 고정하였다.
먼저 침출시간에 따른 침출율을 알아보기 위해 1, 2, 3, 4 그리고 8시간 동안 초기 침출조건으로 침출을 실시하였 다. 4시간 까지는 침출시간에 따라 침출량이 증가하였으 나 4시간 이후에는 침출량에 큰 변화가 없었다. 4시간과 8시간에서의 니켈의 침출량은 각각 43.2%와 45.4%였다. 따라서 침출시간은 4시간이 적절한 것으로 판단하였다. 다음으로 황산농도에 따른 침출량을 평가하였다. 침출은 초기 침출조건과 침출시간을 4시간으로 하고 황산의 량을 127 g과 167 g으로 침출하여 초기 조건이었던 황산량 147 g을 투입하였을 때의 결과와 비교하였다. 147 g과 167 g 의 황산량으로 침출하였을 때 침출량에는 거의 차이가 없 었고, 127 g을 투입하였을 때 147 g에 비해 약 1%정도 낮 은 침출량을 보였다. 침출 후 침출액의 pH는 매우 낮은 값 을 보였다. 황산을 147 g 투입하였을 때 니켈의 침출량이 43.2%로 낮은 것은 무반응 황산이 pH를 낮게 만들었고, 이러한 이유로 침출의 효율성이 크게 감소하였기 때문이 라 판단된다. 위에서 실험한 침출시간과 황산량에 따른 니 켈 침출량에 대한 자세한 결과는 본 논문에는 나타내지 않았다. 이상의 실험에서 과산화수소(환원제)를 투입하지 않고 황산만으로 침출실험을 실시한 것은 황산만으로 최 대한의 코발트를 침출하고, 침출되지 못한 나머지 니켈에 대해 환원제인 과산화수소의 정확한 투입량을 계산하여 투입함으로써 침출효율을 극대화 하기 위해서이다. 과산 화수소의 투입에 대한 실험은 황산과 과산화수소의 투입 시점을 달리하는 것과 과산화수소의 투입량을 달리하는 두 가지 방법으로 실시하였다. 황산과 과산화수소의 투입 시점에 대한 변수는 황산과 과산화수소를 동시에 투입하 여 8시간 침출한 것과 황산을 먼저 투입하여 4시간 침출 한 후에 과산화수소를 투입하여 4시간 침출한 것 두 가지 방법을 선택하였다. 과산화수소의 투입량에 대한 변수는 미 침출된 니켈과 원료물질에 가장 많이 포함되어 있던 코발트의 미 침출 양만큼 투입하였으며, 그 투입량은 아래 3개의 화학반응식을 바탕으로 계산하여 결정하였다. 투입 되는 과산화수소는 환원제의 역할과 H2SO4의 생성으로 미 침출 원료의 침출률을 증가시키는 역할을 하게 된다. 아래 반응식을 통해 계산한 미 침출된 니켈과 코발트를 침출시킬 수 있는 과산화수소의 량은 58 g이었다. 본 실 험에서는 58 g의 95%, 100% 그리고 110%에 해당하는 55 g, 58 g 그리고 64 g의 과산화수소를 투입하여 침출 정 도를 평가하였다.
H2SO4 + H2O2 → H2SO5 + H2O
H2SO5 + CoO → CoSO4 + H2O + ½O2
H2SO5 + NiO → NiSO4 + H2O + ½O2
본 연구에서는 이상에서 제시된 여러 가지 변수들에 대 해 다양한 실험을 실시하였으며, 그 결과들 중에서 대표적 인 4가지 실험조건과 결과에 대해 표 2에 나타내었다. 표 2에서 1번 조건은 황산 147 g과 과산화수소 55 g을 동시 에 투입하여 8시간 동안 침출한 결과이고, 2번 조건은 황 산 147 g을 먼저 투입하여 4시간 동안 침출한 후 과산화 수소 55 g을 투입하여 4시간 동안 침출한 결과이다(표 2 의 6열에서 혼합시간 “4+4”의 의미는 황산 투입 후 4시간 침출 후 과산화수소를 투입하여 4시간 침출). 3번과 4번의 조건은 다른 모든 실험조건은 2번과 동일하고 단지 과산 화수소의 투입량을 2번 조건보다 많은 100%(58 g)과 110%(64 g)를 투입한 결과이다. 표 2에서 조건 1과 2의 결 과를 비교해 보면, 황산과 과산화수소를 동시에 투입하는 것 보다는 황산을 먼저 투입하여 침출한 후에 과산화수소 를 투입하는 것이 더 많은 침출량을 얻을 수 있다는 것을 알 수 있다. 즉, 황산과 과산화수소의 투입 순서가 침출에 중요한 영향을 미친다는 것을 알 수 있었다. 본 실험을 통 해 도출한 최적의 침출조건은 4번에 해당된다. 즉, 황산과 과산화수소의 투입 시점을 달리하고, 화학반응식으로 계 산한 값보다 과산화수소의 량을 조금 더 투입하였을 때 니켈의 침출량이 99.7%까지 증대됨을 알 수 있었다.
3.3. 중화 공정 및 용매 추출
표 1에서 볼 수 있듯이 본 실험에서 사용한 폐 리튬이 차전지에서는 Co, Li, Ni, Mg, Al, Mn 그리고 Ca 산화물 이 포함되어 있다. 이 산화물들은 침출과정에서 대부분 용 해되어 황화물 형태로 존재할 것이다. 이 용액에서 본 연 구의 목적인 니켈황화물만을 얻기 위해서는 니켈황화물을 제외한 다른 불순물을 제거하여야 한다. 따라서 본 연구에 서는 일반적으로 여러 가지 금속물질이 용해되어 있는 용 액에서 특정 물질만을 얻고자 할 경우 적용하는 중화반응 과 용매추출법을 이용하였다. 중화반응을 위한 염기성 용 매로는 NaOH를 사용하였고, 용매추출을 위한 용매로는 D2EHPA와 CYTEC사의 Cyanex®272를 사용하였다[16]. 이 세가지 용매는 특정 pH에서 원하지 않는 물질들을 침 전시켜 여과함으로써 불순물을 제거하는 역할을 한다 [17,18].
“3.2 침출” 과정이 완료된 금속황화물 용액은 산성이고, 이 용액에 염기성인 NaOH를 첨가하면 용액이 염기성으 로 바뀌면서 pH가 증가하게 된다. NaOH의 첨가로 pH가 증가함에 따라 침출용액에 용해되어 있던 금속황화물들은 금속수산화물이 되는데, 이 금속수산화물들의 용해도는 pH가 증가함에 따라 낮아지게 된다. 그리고 각 금속수산 화물의 용해도는 pH에 따라 차이가 있다. 즉, NaOH의 첨 가로 pH를 조절하여 불순물에 해당하는 금속들의 용해도 를 낮추어 금속수산화물로 침전시켜 제거할 수 있다. Ni 와 Co의 경우에는 대략 pH 5.5에서 침전되기 시작하여 pH 7.5에서 침전이 종료되고, Mg는 대략 pH 7.0에서 침 전되기 시작해서 pH 9.0에서 침전이 종료된다. 그 외 침 출액 내의 나머지 금속들은 pH 5.5이하에서 모두 수산화 물 상태로 침전된다. 따라서 본 연구에서는 NaOH를 첨가 하여 pH를 5.5로 맞추어 Ni, Co, Mg를 제외한 불순물들 을 침전시켜 제거하였다. 다음 불순물을 제거하는 공정은 D2EHPA와 CYTEC사의 Cyanex®272를 사용하여 중화반 응 후 남아 있는 Ni, Co, Mg 황화물 중에서 니켈황화물을 제외한 Co와 Mg 황화물을 제거하는 용매추출공정이다. 용매추출법은 서로 혼합되지 않는 두 액상간의 물질분배 차를 이용하여 용액 중의 물질을 분리하는 방법을 말한다.
즉, 어떤 금속이 포함된 수용액상과 추출용제인 유기상 (organic phase)이 접촉하게 되면 추출용제는 금속이온과 반응하여 유기상에 녹을 수 있는 새로운 형태의 금속을 형성하는 것으로, 수용액상의 금속 원소가 유기상으로 전 이되어 금속을 선택적으로 분리함으로써 정제가 가능하다. 상기 중화반응을 통해 얻은 용액에 D2EHPA를 첨가하면 Mg의 추출은 pH 대략 2.0에서 시작해서 4.0에서 종료되 고, Co의 추출은 대략 pH 3.0에서 시작해서 5.5에서 종료 되며, Ni의 침전은 대략 pH 4.0에서 시작해서 6.0에서 종 료된다. 따라서 본 연구에서는 pH를 4로 맞추어 대부분의 Mg를 추출시키고, Co를 대략 절반 정도를 추출시킨 후 여 과를 통해 제거하고자 하였다. 다음으로 Cyanex®272를 투입하여 상기 과정 후에 남아 있는 Co를 제거하고자 하 였다. D2EHPA처리 후의 용액에는 본 연구에서 얻고자 하 는 Ni와 소량의 Co가 남게 된다. 이 용액에 Cyanex®272 를 투입하면 Co의 추출은 대략 pH 3.2에서 시작해서 5.0 에서 종료되고, Ni의 추출은 pH 5.0에서 시작해서 6.5에서 종료된다. 따라서 pH를 5.2에 맞추어 최종 남아 있을 것 으로 예상되는 Co를 추출시켜 여과를 통해 제거하고자 하 였다. 상기의 중화반응과 용매추출의 실험은 상온에서 45 분 동안 교반하면서 실시하였다.
앞서 침출과정을 끝낸 시편을 중화공정과 용매추출 순 으로 정제 후 ICP로 성분분석 한 결과를 표 3에 나타내 었다. 표에서 보는 바와 같이 소량의 Na외 불순물들이 검 출되지 않은 고순도의 NiSO4 용액이 얻어진 것을 확인할 수 있었다.
3.4. LiNiO2 합성
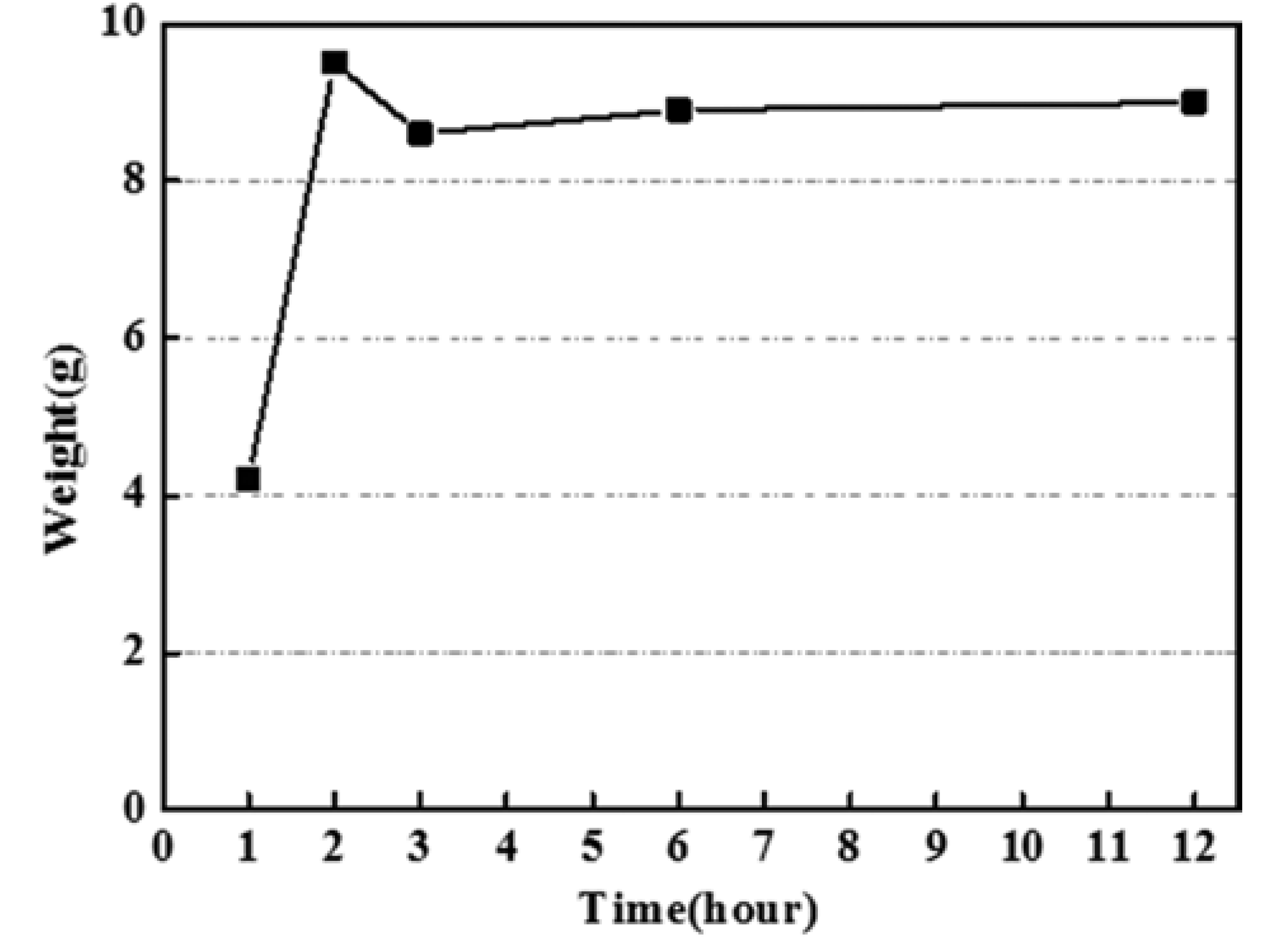
제조된 황산니켈 용액은 먼저 증류수와 희석하여 6 wt.% 황산니켈 용액(NiSO4H2O)으로 농도를 맞추고 실험 을 진행하였다. 먼저, 양극활물질의 니켈 원료인 니켈산화 물(NiO) 분말을 제조하기 위해 폐전지에서 회수한 고순도 의 황산니켈 용액을 옥살산(Oxalic acid; H2C2O4)과 혼합 한 후, 상온에서 일정 시간 동안 교반하고 여과한 다음 건 조하였다. 건조가 완료된 니켈산화물 분말은 혼합과정에 서 옥살산과의 반응으로 탄소와 수소 등의 불순물이 다수 포함되어 있을 수 있기 때문에 순수한 니켈산화물이 아닐 수 있다. 따라서 이러한 불순물을 제거하여 순수한 니켈산 화물을 얻기 위해 하소처리를 하였다. 혼합과정에서 황산 니켈 용액과 옥살산의 혼합비는 몰비 1:1.5이었다. 이 몰 비를 선택한 이유는 두 물질의 화학식을 비교하여 적절한 몰비를 계산하고, 계산된 몰비값을 기준으로 몰비를 변화 시키면서 1시간 동안 교반하여 침전물의 량을 측정한 결 과 1:1.5의 몰비에서 가장 많은 량을 얻을 수 있었기 때문 이었다. 또한, 이 몰비에서 가장 많은 량의 침전물을 얻을 0수 있는 교반시간을 알아보기 위해 교반시간에 따른 침전 물의 량을 측정하였다. 이때 침전물의 무게는 하소처리 (400°C에서 4시간 열처리)가 끝난 후에 측정하였으며, 그 결과를 그림 1에 나타내었다. 그림에서 볼 수 있듯이 2시 간까지는 회수량이 급격히 증가하였으나 2시간 이후에는 큰 변화가 없었으며, 2시간 교반과정 후의 회수량은 9.5 g 이었다(황산니켈용액과 옥살산을 각각 100 g 그리고 6.3 g 혼합하였을 경우).
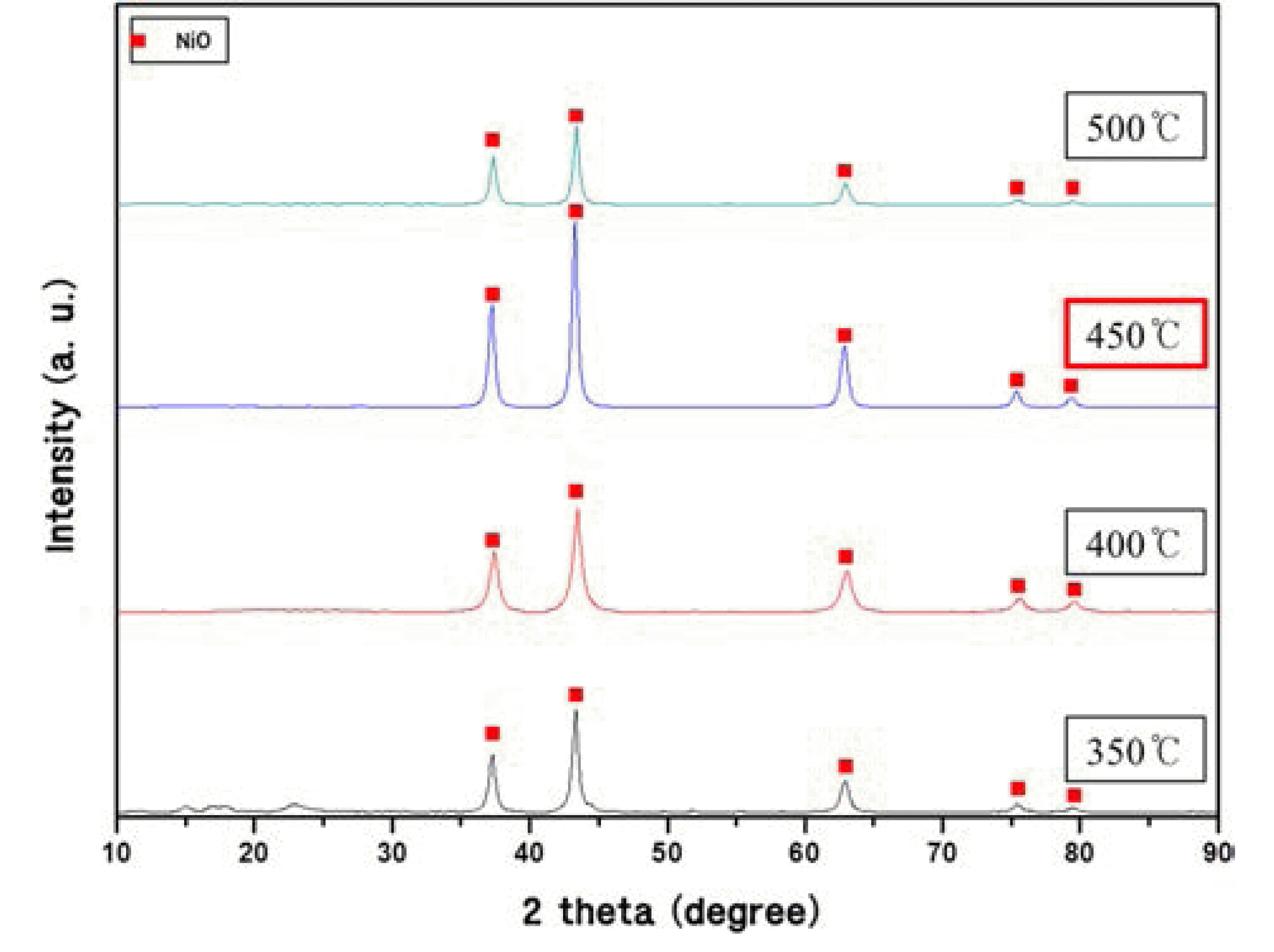
다음은 적절한 하소 온도를 알아보기 위하여 350°C에 서 500°C까지 50°C간격으로 4시간 동안 대기 중에서 열 처리 한 후 XRD 평가를 실시하였으며, 그 결과를 그림 2에 나타내었다. 그림에서 볼 수 있듯이 모든 열처리 온 도에서 전반적으로 불순물이 없는 순수한 니켈산화물 (NiO)이 형성되었다는 것을 알 수 있었다. 다만 350oC에 서 열처리한 경우 2θ = 20° 부근에서 불순물들로 예측되 는 아주 낮은 회절 피크가 관찰되었고, 400°C와 500°C 의 경우는 450°C에 비해 전반적으로 회절 피크의 강도 가 다소 낮게 관찰되었다. 따라서 이 결과에서는 450°C 가 순수한 니켈산화물을 얻는데 적절한 하소 온도라고 판 단하였다.
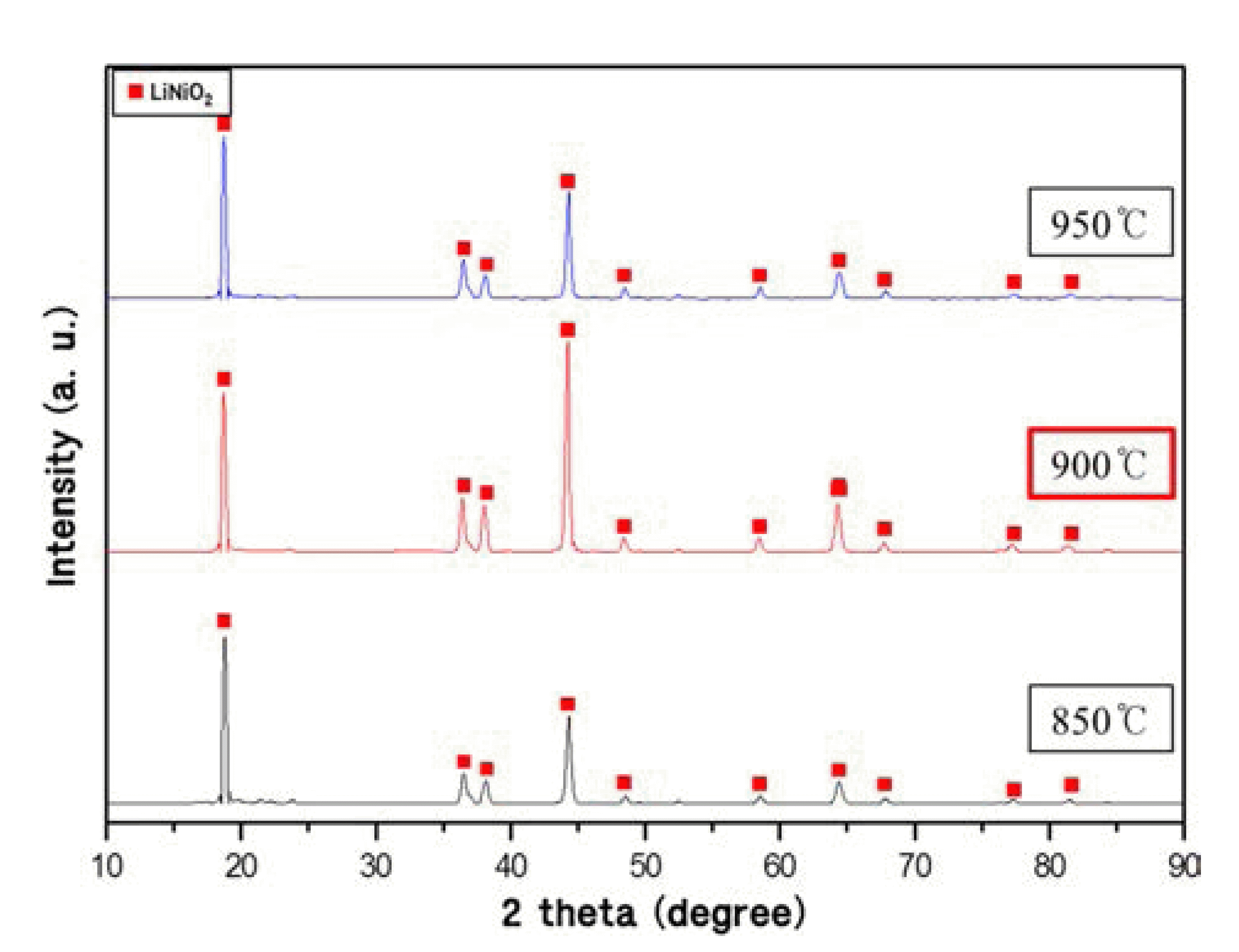
다음으로 상기에서 제조된 순수 니켈산화물(NiO) 분말 과 리튬의 원료가 되는 카보네이트(Li2CO3) 분말을 혼합 하여 산소 분위기에서 열처리하여 LiNiO2 분말을 합성하 였다. 순수한 LiNiO2 분말을 합성하기 위해 니켈산화물과 카보네이트 두 물질의 몰비를 계산하여 리튬과 니켈원자 의 비가 1:1.05되도록 두 물질을 혼합하였으며, 본 연구에 서는 니켈산화물과 카보네이트를 각각 4.2 g과 4.36 g으로 실험을 실시하였다. 또한 순수한 LiNiO2 분말을 합성하기 위한 열처리 온도를 알아보기 위해 세 가지 온도에서 열 처리를 실시하였다. 그림 3은 열처리 온도에서 얻은 분말 의 XRD분석 결과이다. 그림에서 볼 수 있듯이 모든 열처 리 조건에서 순수한 LiNiO2에 해당하는 회절 피크 외에 다른 불순물로 보이는 회절 피크들은 관찰되지 않았기 때 문에 전반적으로 세 열처리 조건에서 순수한 LiNiO2이 합 성되었다고 판단된다. 단, 850°C에서 열처리된 경우 2θ = 22° 근처에서 불순물로 예상되는 아주 낮은 회절 피크들 이 관찰되었고, 950°C의 경우에는 900°C에 비해 그 회절 피크의 강도가 다소 낮게 관찰되었기 때문에 본 연구에서 는 900°C가 순수한 LiNiO2 분말을 합성하는데 적절한 온 도라고 판단하였다. 그림 4는 900°C에서 제조된 LiNiO2 분말의 형상을 FE-SEM으로 관찰한 것이다. 그림에서 볼 수 있듯이 제조된 LiNiO2 분말은 표면이 울퉁불퉁하며 입 자의 크기와 모양이 다양하지만 대체적으로 각진 형상을 하고 있으며 크기는 대략 5~10 μm 정도였다.
3.5. 전기화학적 특성 평가
본 연구를 통해 제조한 LiNiO2 분말을 이용하여 전기화 학적 특성을 평가하였다. 각각 0.5와 1.0 C-rate에서 전기 화학적 특성을 평가한 결과를 그림 5에 나타냈으며, 두 Crate 모두 초기용량은 대략 120 mAh/g이었으며, 사이클이 진행되어도 큰 용량의 감소 없이 일정한 용량을 유지하는 것을 보여주고 있어 매우 안정적인 전기화학적 특성을 나 타낸 다고 할 수 있다. LiNiO2 분말을 이용하여 실험한 기 존의 문헌과[19-21] 비교해 볼 때 본 연구에서 얻은 전기 화학적 특성은 기존 결과의 80~90%에 해당하는 아주 우 수한 결과이다. 본 연구에서는 전기화학적 특성을 향상시 키기 위한 부가적인 처리없이 전극을 구성하여 평가를 한 것이기 때문에 차후 전해질 변화 혹은 전도성물질 첨가 등의 부가적인 처리를 할 경우 더 높은 전기화학적 특성 을 얻을 수 있을 것으로 판단된다.
이상의 결과로부터 본 연구의 목적인 폐 이차전지로부 터 우수한 전기화학적 특성을 갖는 순수한 LiNiO2를 재생 하였다고 판단된다.
4. 결 론
본 연구에서는 NCM(Li[Ni,Co,Mn]O2)계 폐 리튬이차전 지로부터 침출법과 추출법을 이용하여 고순도의 황산니켈 용액을 회수하고 이를 이용하여 LiNiO2 활물질을 제조하 여 전기화학적특성의 평가를 통해 폐 리튬이차전지 양극 활물질의 재활용 가능성을 평가하였다. 폐 리튬이차전지 의 양극활물질로부터 금속산화물을 용해하는 과정에서는 황산과 과산화수소를 사용하였으며, 이 때 중요한 변수는 황산과 과산화수소의 적절한 량뿐만 아니라 두 물질을 투 입하는 순서였으며, 즉 황산을 투입하여 먼저 용해를 한 후 과산화수소를 투입하는 것이 매우 효과적으로 최대한 많은 량의 금속산화물을 용해 시킬 수 있다는 것을 알 수 있었다. 순수한 니켈황화물을 얻기 위한 중화공정과 용매 추출공정에서는 불순물을 침전시켜 제거하기 위해 pH를 얼마나 미세하게 조절하느냐가 매우 중요한 변수였다. 황 산니켈 용액과 옥살산을 이용하여 순수한 NiO를 제조하 는 과정과 NiO와 Li2CO3 분말을 혼합하여 양극활물질인 LiNiO2를 제조하는 과정에서는 열처리 온도가 중요하였고, 각각 450°C와 900°C가 최적의 온도였다. 합성된 LiNiO2의 전기화학적 특성을 분석한 결과, 120 mAh/g의 초기용량 을 보였으며 매우 안정적으로 사이클을 유지되는 것을 확 인할 수 있었다. 이 전기화학적 용량은 기존 문헌 결과의 대략 80~90%에 해당하는 매우 우수한 결과였다. 결론으 로 폐 리튬이차전지로부터 니켈을 회수하여 다시 리튬이 차전지의 양극활물질로 재활용하는 본 연구의 방법은 충 분히 가능성이 있다고 판단된다.
감사의 글
이 논문은 교육부의 재원으로 지원을 받아 수행된 산학 협력 선도대학(LINC) 육성사업과 2012년도 경남과학기술 대학교 기성회 연구비 지원에 의하여 연구되었음에 감사 드립니다.