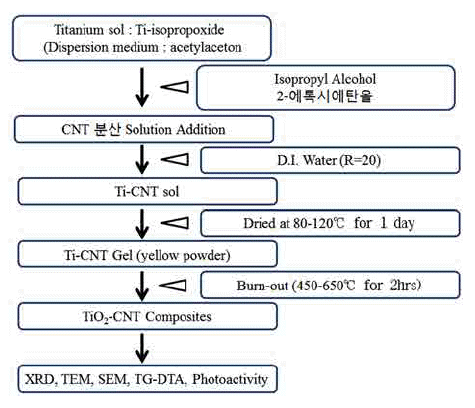
탄소나노튜브(CNT)의 첨가에 따른 TiO2의 광촉매 특성 변화 연구
Evaluation of TiO2 Photocatalytic Activity with Addition of Carbon Nanotube
Article information
Abstract
A TiO2/CNT nanohybrid photocatalyst is synthesized via sol-gel route, with titanium (IV) isopropoxide and multi-walled carbon nanotubes (MWCNTs) as the starting materials. The microstructures and phase constitution of the nanohybrid TiO2/CNT (0.005wt%) samples after calcination at 450°C, 550°C and 650°C in air are compared with those of pure TiO2 using field-emission scanning electron microscopy and X-ray diffraction, respectively. In addition, the photocatalytic activity of the nanohybrid is compared with that of pure TiO2 with regard to the degradation of methyl orange under visible light irradiation. The TiO2/CNT composite exhibits a fast grain growth and phase transformation during calcination. The nanocomposite shows enhanced photocatalytic activity under visible light irradiation in comparison to pure TiO2 owing to not only better adsorption capability of CNT but also effective electron transfer between TiO2 and CNTs. However, the high calcination temperature of 650°C, regardless of addition of CNT, causes a decrease in photocatalytic activity because of grain growth and phase transformation to rutile. These results such as fast phase transformation to rutile and effective electron transfer are related to carbon doping into TiO2.
1. 서 론
광 에너지를 화학적 또는 전기적 에너지로 바꿀 수 있 는 광촉매의 가시광 활성도를 향상시키기 위해 비금속 원 소 및 전위원소 도핑을 통한 밴드-갭 에너지를 낮춤, 전자 받게 또는 홀 받게를 통한 활성 전자와 홀 간 재결합 저 지, 비표면적 향상을 통한 광촉매 효율 개선 등의 연구를 수행하여 왔다[1-4].
탄소나노튜브(Carbon-Nanotube; CNT)는 우수한 열전도 율, 높은 비표면적 및 우수한 기계적, 전기적 특성 등으로 인하여 오랜 동안 나노기술, 전기공학, 광학 및 재료공학 등 다양한 분야에 걸쳐 응용 연구가 진행되었다[5]. 특히 CNT는 비표면적이 커 유해물 흡착에 유리하고 TiO2와의 전자 이동이 가능한 에너지 준위를 갖고 있어 TiO2의 광 촉매 특성 개선에 효과적인 복합 소재로 관심을 받고 있 다[6, 7].
CNT-TiO2 복합 광촉매의 가시광 영역에서의 광촉매 효 율은 TiO2 단일 광촉매의 경우보다 상당히 우수하다고 보 고되고 있는데[8, 9]. 그 원인에 대하여 다음과 같이 보고 되고 있다. 첫째는 가시광에 의해 TiO2에서 여기된 전자가 CNT로 이동함으로써 여기된 전자와 여기된 홀의 재결합 을 저지함으로써 광촉매 효율이 향상된다고 보고한다[10]. 두 번째는 가시광에 의해 CNT에서 전자가 여기된 후 그 전자들과 홀들이 각각 TiO2로 이동하여 재결합이 저지되 어 광촉매 효율이 향상된다고 보고한다[11]. 셋째는 CNT 와 TiO2가 화학적 결합을 하여 C-Ti-O 구조를 가져 밴드 갭 에너지가 작아짐으로 인하여 가시광원에 의해서도 쉽 게 전자와 홀이 형성되기 때문이라고 보고하고 있다[12]. TiO2에 탄소 분말을 첨가할 경우 탄소 분말에 의한 유해 물질 흡착 효과, 광촉매 분말들 간의 응집 방지 효과, 유 해물질과의 유효 반응 면적 향상 등의 개선에 효과적이며 [13, 14], 아나타제 TiO2의 열처리 중 루타일로의 상변화를 저지함으로써 광촉매 효율을 향상시키는 효과가 있다고 보고하고 있다[15].
본 연구에서는 CNT의 첨가가 TiO2의 광촉매 특성에 어 떤 영향을 끼치는지, 졸-겔법을 이용하여 TiO2와 TiO2- CNT 복합체를 합성하여 비교하였다. TiO2-CNT 복합체는 TiO2를 합성하는 공정 중에 초음파 분산된 CNT를 첨가함 으로써 합성하였다. TiO2합성 분말과 CNT가 0.005wt% 혼합된 TiO2-CNT 복합 분말에 대하여, 소결 온도에 따른 미세조직, 가시광원에 대한 메틸오렌지 분해능, 표면 결합 에너지 등을 분석 비교함으로써 CNT의 첨가에 따른 효과 에 대하여 연구하였다.
주사전자현미경(FE-SEM; SU-8010, Hitach), 투과전자현 미경(FE-TEM; EM-2100F, JEOL), 광전자 분광기(Electron Spectroscopy For Chemical Analysis; K-Alpha, Thermo Scientific)를 이용하여 분말의 미세조직 및 표면화학 결합 을 분석하였고, XRD(X-ray diffraction; X’ Pert-Pro MPD/ Phillips)를 통한 상 조성 분석, 가시 광원(400 nm < , 45W) 에 의한 메틸오렌지 분해 정도를 UV-vis 분광기를 이용한 흡광도 측정법으로 평가하였다.
2. 실험방법
그림 1은 TiO2 및 TiO2-CNT 복합 분말을 졸-겔법으로 합 성/열처리/분석하는 공정에 대한 설명도이다. TiO2 합성을 위한 초기 시약으로는 Titanium(IV) -isopropoxide(Samchun Pure Chemical Co., 99.0%)를 1몰, 분산을 위해 Acetylaceton (CAS No. 123-54-6(99%), JUNSEI) 1몰을 넣고 마그네틱 바를 이용하여 2시간 동안 80°C에서 혼합하였다. 붉은색 으로 변한 액을 상온까지 식힌 후, 이소프로필알코올 1몰, 2-에톡시에탄올(CAS No. 110-80-5(98%), JUNSEI) 1몰을 넣은 후 90~100°C에서 8시간 가열 반응시켰다. CNT (MWCNT; Hanwha Chemical Co., CM-95, 95%)를 첨가할 경우, 이소프로필알코올(200 ml)에 CNT를 넣고 초음파 분 산기(Ultrasonix Processor 500 Watts, VC-505, Sonics, USA)를 이용해 1시간 동안 분산한 후 이소프로필알코올 을 첨가할 때 같이 첨가한다. 8시간이 지난 후 다시 상온 으로 식힌 후 이온수를 (R=20) 넣고 90~100°C에서 24시 간 혼합 후 건조를 시켰다. 건조된 분말을 미세하게 분쇄 후 450°C, 550°C, 650°C의 대기 분위기에서 2시간 하소처 리 하여, 각각의 시료에 대하여 미세조직 분석(FE-SEM, FE-TEM), 표면 결합 에너지(XPS), 상분석(XRD)을 비롯 한 가시광원에서의 메틸오렌지 분해능을 통한 광촉매 특 성을 평가하였다.
3. 결과 및 고찰
그림 2는 초음파 분산기를 이용해 CNT를 분산한 것에 대한 결과이다. (a)는 초기 CNT 분말의 거시적 이미지로 서 분말 형태를 보이고 있으나 미시적으로 보면 직경이 10~15 nm, 길이가 2~5 μm인 미세한 탄소나노튜브(CNT) 가 엉켜 있는 것을 볼 수 있다. CNT 분산을 위해 200 ml 의 이소프로필알코올에 0.0053 g의 CNT를 넣고 초음파 분산을 하였다. 분산 시간을 20분(c), 30분(d), 40분(e)으로 연장할수록 CNT의 분산 정도가 높아지는 것을 볼 수 있 으며, 40분(e) 간 분산한 경우에는 CNT가 대부분 분산된 것을 볼 수 있다.
그림 3은 졸-겔법을 통해 합성한 (a)TiO2(pure)와 (b)TiO2+ CNT(0.005wt%)의 이미지이다. (a)TiO2(pure)의 경우 노란색 을 띄고 있으나 CNT를 포함하는 (b)TiO2+CNT(0.005wt%) 는 어두운 회색을 띄고 있다. 이는 첨가된 CNT에 의해 색 이 변한 것으로 보인다. 분말의 미세 조직에 대한 분석 결 과는 그림 6에서 설명 하고 있다.
그림 4는 TiO2(pure)에 대하여 하소처리 온도에 따른 미 세조직을 SEM으로 분석한 결과이다. 합성 후 하소처리 전(a)과 450°C(b)에서 하소 처리한 경우에는 속이 빈 형태 를 보였으나, 550°C(c), 650°C(d)에서 하소 처리한 경우에 는 공동 형태가 깨진 형태를 보였다. 이는 분말 합성 중 잔류한 유기물이 하소처리 중에 분해되면서 동공 형태가 무너졌기 때문이라 판단된다. (a)와 (b)에 대한 미세 조직 은 그림 6과 그림 7에서 보다 자세히 분석하고 있다. 위 미세조직 분석 결과는 그림 9의 광촉매 효율과 연관되어 있는 것을 알 수 있다.

TEM results of the synthesized powders after calcination at 450°C; (a)TiO2(pure), (b)TiO2+CNT(0.005wt%)
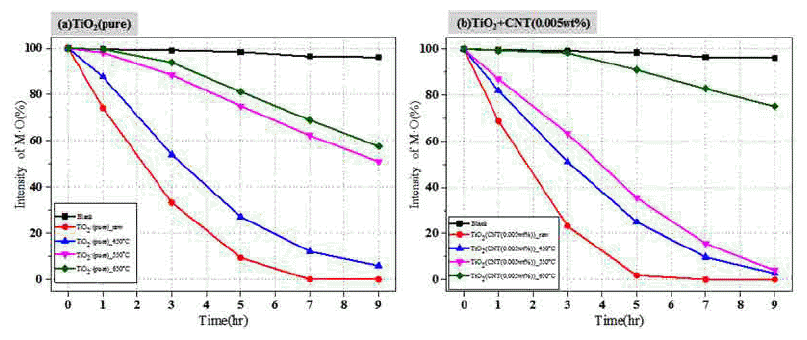
Photocatalytic activity of (a)TiO2(pure) and (b)TiO2+CNT(0.005wt%) depending on the calcination temperature and a period of light irradiation; (a)blank(■), (b)raw(●), (c)450°C(▲), (d)550°C(▼) and (e)650°C(◆).
그림 5는 TiO2+CNT(0.005wt%) 분말의 하소처리 온도 에 따른 미세조직을 분석한 결과이다. (a)는 TiO2와 CNT 의 혼합 분말로서 하소처리 전의 미세조직이다. 배율 상 분말 크기는 알 수 없으나 초미세 분말이 응집된 형태로 보이며, 그림 6(b-3)의 결과에서 보면 결정립 크기가 약 8 nm임을 알 수 있다. 특히 화살표로 표시된 부분은 첨가 된 CNT인데, 표면에 노출된 CNT가 많이 발견되지 않는 이유는 CNT가 TiO2에 둘러 싸여 표면에 노출되지 않았기 때문이다. 450°C(b)의 결정립 크기는 그림 7(b-2)의 결과를 통해 알 수 있듯이 약 20 nm이고, 550°C(c)는 약 80~100 nm, 650°C(d) 하소처리 할 경우에는 약 100~150 nm로 하소처리 온도가 450°C(b), 550°C(c), 650°C(d)로 높아질수록 입성장 한 것을 알 수 있다.
그림 6은 (a)TiO2(pure), (b)TiO2+CNT(0.005wt%) 합성 분말의 하소처리 전 미세조직을 TEM으로 분석한 결과이 다. (a)TiO2(pure)의 경우 미세한 입자들이 응집된 형태로 존재하였다. 이들에 대하여 고배율로 분석하였더니 결정 격자(a-3)를 이루고 있는 것을 확인할 수 있으며, 약 5 nm 정도의 결정립 크기를 보이고 있었다. 한편, (b)TiO2+ CNT(0.005wt%)의 경우도 미세한 입자들이 응집된 형태로 존재하고 있었다. 그러나 부분적으로 CNT가 분산되어 있 는 것을 발견할 수 있었다. CNT가 TiO2 응집체와 연결된 형태로 존재하는 것을 볼 때 CNT의 대부분은 TiO2에 의 해 둘러 싸여 있고, 일부 CNT가 돌출되어 발견된 것으로 판단된다. (b)TiO2+CNT(0.005wt%) 역시 고배율로 분석한 결과 결정 격자(b-3)가 형성되어 있는 것을 확인 할 수 있 으며, 약 8 nm 정도의 결정립 크기를 보이고 있다. 그림 6(b-1)을 보면 CNT가 TiO2 응집체 내부 및 표면에 분포하 고 있음을 확인할 수 있다.
그림 7은 (a)TiO2(pure), (b)TiO2+CNT(0.005wt%) 합성 분말을 450°C에서 2시간 하소처리한 시편의 미세조직을 TEM으로 분석한 결과이다. (a)TiO2(pure)의 경우 결정립 크기가 약 15 nm 정도까지 성장한 것을 알 수 있으며, (b)TiO2+CNT(0.005wt%)의 경우는 약 20 nm정도까지 성 장한 것을 볼 수 있다. CNT가 첨가되지 않은 경우(a)에 비 해 CNT가 첨가된 경우(b) 하소처리에 의한 결정립 성장 이 더 빠르게 진행 된 것을 알 수 있는데, 이는 그림 6에 서의 결정립 크기의 차이에서 보는 바와 같다. 그림 8에서 는 하소처리 온도에 따른 상변화를 나타내고 있는데 하소 처리 온도에서의 결정립 크기 변화와 CNT와 서로 관련이 있음을 알 수 있다.
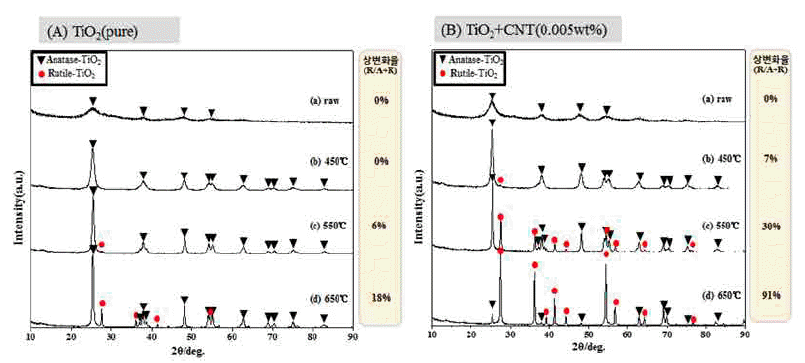
Phase constitution and phase transformation rate of (A) TiO2(pure) and (B)TiO2+CNT(0.005wt%) with change of calcination temperature.
그림 8은 합성 분말 (A)TiO2(pure), (B)TiO2+CNT (0.005wt%)의 하소처리 온도에 따른 상분석 결과 및 상변 화율을 나타낸 결과이다. (A)TiO2(pure)의 경우 하소 처리 전에도 아나타제 상이 존재하는 것을 알 수 있다. Scherrer Equation[16]법에 따른 계산에 의하면 결정립 크기는 매우 작은 것으로 판단되며, 실제 그림 6(a)를 보면 약 5 nm의 결정립 크기를 갖고 있음을 확인 할 수 있다. 450°C에서 하소 처리 시에는 그림 7(a)에서 보는 바와 같이 아나타제 의 상이 존재하는 것을 알 수 있으며, 결정립 크기가 성장 한 것을 알 수 있다. 550°C 하소처리부터는 루타일 상이 발견됨으로써 상변화가 진행되는 온도임을 알 수 있다. 650°C 하소 처리 시에는 약 18%의 루타일 상변화가 진행 된 것을 알 수 있다. 상변화율은 아래와 같은 식에 의해 계산 되었다.
IR : Intensity of Rutile
IA : Intensity of Anatase
한편 CNT(0.005wt%)가 첨가된 (B)TiO2+CNT(0.005wt%) 는 시편 (A)와 약간 다른 결과를 나타내고 있다. 합성 후 열처리 전에는 (A)와 같이 아나타제 상을 보이고 있으나 피크의 강도가 높고, 피크의 중간 높이의 폭이 (A)에 비해 좁은 것으로 보아 (A)에 비해 결정립이 큰 것으로 판단되 며, 그림 6의 결과에서 보듯이 약 8 nm로 비교적 큰 결정립 크기를 보이고 있다. 450°C에서 하소 처리한 (b)의 경우, 시 편(A)의 (b)와는 달리 루타일 상이 발견되었고, 상변화 (6%)가 이미 진행되었음을 알 수 있다. 550°C의 하소 처 리 온도에서는 루타일 상변화율이 30%로 진행되었으며, 이는 시편 A의 650°C 하소 처리 조건(18%)보다도 더 높은 루타일 상변화율을 나타내고 있다. 650°C 하소 처리 온도에 서는 상변화율이 91%로 대부분의 아나타제 상이 루타일 상으로 변화된 것을 볼 수 있다. 일반적으로 비정질의 TiO2는 약 300°C에서 아나타제 상이 되고, 약 800°C 정도 에서 루타일 상으로 상변화 하고[17], 산화물 등 제2상 첨 가 시에는 약 1,050°C[18]에서 상변화가 일어난다고 보고 되고 있다. 이에 비하면 루타일 상변화 온도가 상당히 낮 아진 것을 볼 수 있다. CNT 첨가가 TiO2의 상변화에 끼 치는 영향에 대하여는 아직 증명된 바는 없으나, 탄소가 TiO2에 포함된 경우 아나타제에서 루타일로의 상변화가 빠르게 진행된다고 보고하고 있다[19]. 이는 TiO2에 탄소 또는 카보네이트(C-O, C=O) 형태로 탄소가 도핑 되어 있 다는 것을 간접적으로 보여 주고 있다.
그림 9는 (a)TiO2(pure)와 (b)TiO2+CNT(0.005wt%) 분말 을 합성한 후 하소 처리 온도별로 광원 조사 시간에 따른 메틸오렌지를 분해하는 광촉매 효율을 나타낸 결과이다. 위 결과에서 각각의 표시는 다음과 같다[blank(■), raw(●), 450°C(▲), 550°C(▼) 650°C(◆)]. blank(■)는 광촉매의 효 율이 아닌 광원에 대한 메틸오렌지의 변화를 보기위해 광 촉매의 첨가가 없는 경우의 메틸오렌지 농도 변화이다. 일 반적으로 졸-겔법으로 합성 후 결정화 및 유기물 제거를 위해 하소처리 공정 후 광촉매 효율이 높아지는 것으로 보고되나[20], 본 결과에서는 하소 처리 전에 이미 아나타 제 상이 존재하고, 결정립 크기도 수 nm로 광촉매 반응을 위한 접촉 면적도 넓은 이점이 있다. 특히 잔류하는 유기 물은 유해물질(메틸오렌지)를 흡착하는 흡착제로 작용한 것으로 판단된다. 그래서 광촉매 효율이 우수한 것으로 판 단된다. 소결온도가 450°C, 550°C, 650°C로 높아질수록 광 촉매 효율이 낮아지는 것을 볼 수 있는데, 이는 일반적으 로 하소 처리 온도 상승에 따른 결정립 크기 성장과, 루타 일로의 상변화에 따른 광촉매 효율 감소 및 비표면적 감 소에 원인이 있다[20]. 특히 시편 (b)TiO2+CNT(0.005wt%) 의 경우 650°C에서 하소 처리한 경우의 광촉매 효과가 급 격히 감소하였는데, 이는 그림 8(B)의 XRD 결과에서 보 듯이 루타일 상변화가 91% 진행됨으로써 나타난 결과로 보인다[20].
그림 10은 ●:TiO2(pure), ▲:TiO2+CNT(0.005wt%))의 하소처리 온도[(a)raw, (b)450°C, (c)550°C and (d)650°C]에 따른 메틸오렌지의 농도 변화를 비교한 결과이다. 두 샘플 모두 하소 처리 전의 경우 우수한 광촉매 효율을 나타내 고 있으며, 하소 처리 온도가 높을수록 광촉매 효율이 감 소하는 현상을 나타내고 있다. 샘플 TiO2(pure)와 TiO2+ CNT(0.005wt%))는 하소 처리 전, 450°C에서 하소 처리한 경우 확연한 차이는 없으나 CNT를 포함하고 있는 샘플(▲ :TiO2+CNT(0.005wt%))이 다소 우수한 광촉매 효율을 나 타내고 있다. 550°C 하소처리 조건에서는 두 샘플의 광촉 매 효율 차가 현저히 나타나고 있는데, 이는 하소 처리 온 도가 높아짐으로 인한 결정립 성장과 유기물 등의 제거로 인한 메틸오렌지를 흡착할 수 있는 능력이 낮아졌기 때문으 로 판단된다. 반면 CNT를 포함하고 있는 샘플(▲:TiO2+ CNT(0.005wt%))의 경우는 CNT가 유해물 흡착 능력을 보유 하고 있을 뿐 아니라 여기된 전자가 CNT로 이동함으로써 여기된 전자와 홀의 재결합을 저지 시키는 효과가 있어 CNT를 포함하지 않은 샘플에 비해 더 높은 광촉매 효율 을 나타낸 것으로 판단하다[21, 22].
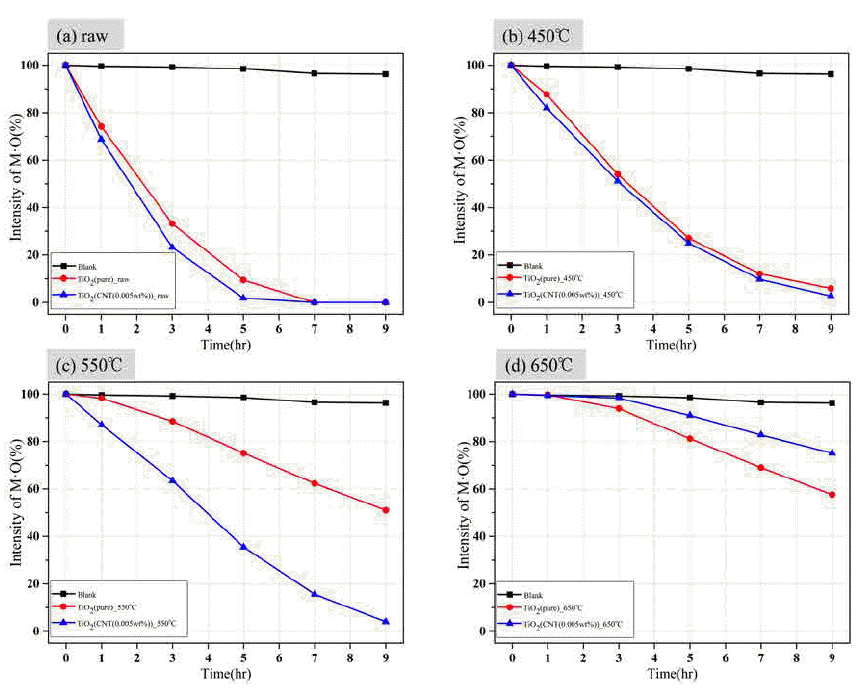
Photocatalytic activity of (a)TiO2(pure)(●) and (b)TiO2+CNT(0.005wt%)(▲) depending on the calcination temperature; (a)raw, (b)450°C, (c)550°C and (d)650°C.
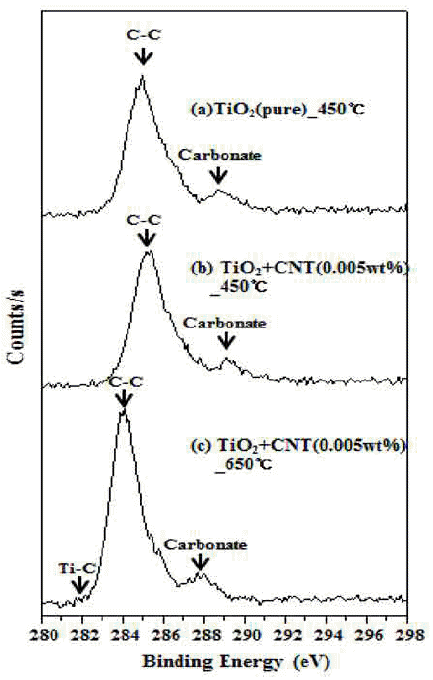
그림 11은 합성 분말의 하소처리 온도에 따른 C1s 결합 에너지를 분석한 결과이다. (a), (b)는 각각 TiO2(pure)와 TiO2+CNT(0.005wt%)를 450°C에서 하소 처리한 시료의 결과이다. 285eV는 C-C 결합 에너지로 TiO2 표면에 임으 로 흡착되어 있는 C와의 결합을 나타내며, 288.6eV는 TiO2 의 Ti 자리에 C이 대신 위치하면서 카보네이트(C-O) 결합 에 대한 결합 에너지 값이다[19]. 한편 (c)TiO2+CNT (0.005wt%)-650°C의 경우는 (a)와 (b)에 비해 결합 에너지 가 좌측으로 이동(감소)하였으나 비슷한 패턴을 보이고 있 다. 284eV는 표면에 흡착된 탄소와의 결합을 나타내고, 288eV는 카보네이트(C-O) 결합에 대한 결합 에너지 값이 다[23]. Ohno et al.[23]의 연구 결과에 따르면 카보네이트 가 도핑된 TiO2의 경우 가시광 광촉매 효율이 개선된다고 보고하고 있다. 때문에 그림 9에서 (a)TiO2(pure)와 (b)TiO2+CNT(0.005wt%)의 하소처리 전과 450°C에서 하 소처리 한 시편의 가시광 광촉매 효율이 우수한 이유로 판단된다. 그러나 그림 11 (c)TiO2+CNT(0.005wt%)-650°C 의 경우 카보네이트(C-O) 결합뿐만 아니라 282eV의 Ti-C 결합도 약간 존재하는 것으로 보인다. 이는 고온의 하소처 리로 인하여 O의 자리에 C가 도핑된 결과로 본다. 그럼에 도 불구하고 그림 9에서는 낮은 광촉매 효율을 보이는데, 이는 루타일 상변화가 과도하게 진행되어 광촉매 효율 향 상에 기여하지 못했기 때문으로 판단된다.
4. 결 론
Titanium(IX) isopropoxide를 이용해 졸-겔법으로 합성한 TiO2 및 TiO2-CNT 광촉매 복합 분말에 대하여 다음과 같 이 요약 한다.
1) 졸-겔법으로 합성한 TiO2와 TiO2+CNT(0.005wt%)는 하소처리 전에도 아나타제 상을 가졌으며, 이의 결정립 크 기는 약 5 nm, 8 nm로 매우 미세하였다. 이는 가시광원에 대한 메틸오렌지 분해능(광촉매 효율)을 나타냈으며, 특히 CNT를 함유하고 있는 경우 더 우수한 광촉매 효율을 나 타냈다.
2) CNT를 포함하는 경우 그렇지 않은 경우와 비교해 더 우수한 광촉매 효율을 나타내는 것은 CNT의 유해물질 흡 착 역할, CNT와 TiO2의 결합에 의한 여기 전자-홀의 효과 적인 분리로 인한 재결합을 저지함으로써 표면 반응할 수 있는 유효 전자와 홀의 숫자를 많게 할 수 있기 때문이다.
3) CNT를 함유한 TiO2의 경우는 그렇지 않은 경우에 비 하여 루타일로의 상변화 속도가 빠르게 진행되는데, 이는 CNT의 탄소가 TiO2에 도핑(함유)되었기 때문이다.
4) TiO2가 CNT와의 표면 화학 결합(Ti-C, C-O)되어 밴 드-갭 에너지가 감소되었다 하더라도, 루타일 TiO2의 상에 서는 여기된 전자와 홀의 재결합이 빨라지기 때문에 광촉 매 효율 감소의 원인이 된다.
감사의 글
본 연구는 인천대학교 자체 연구과제 연구비 지원을 받 아 수행 되었습니다.