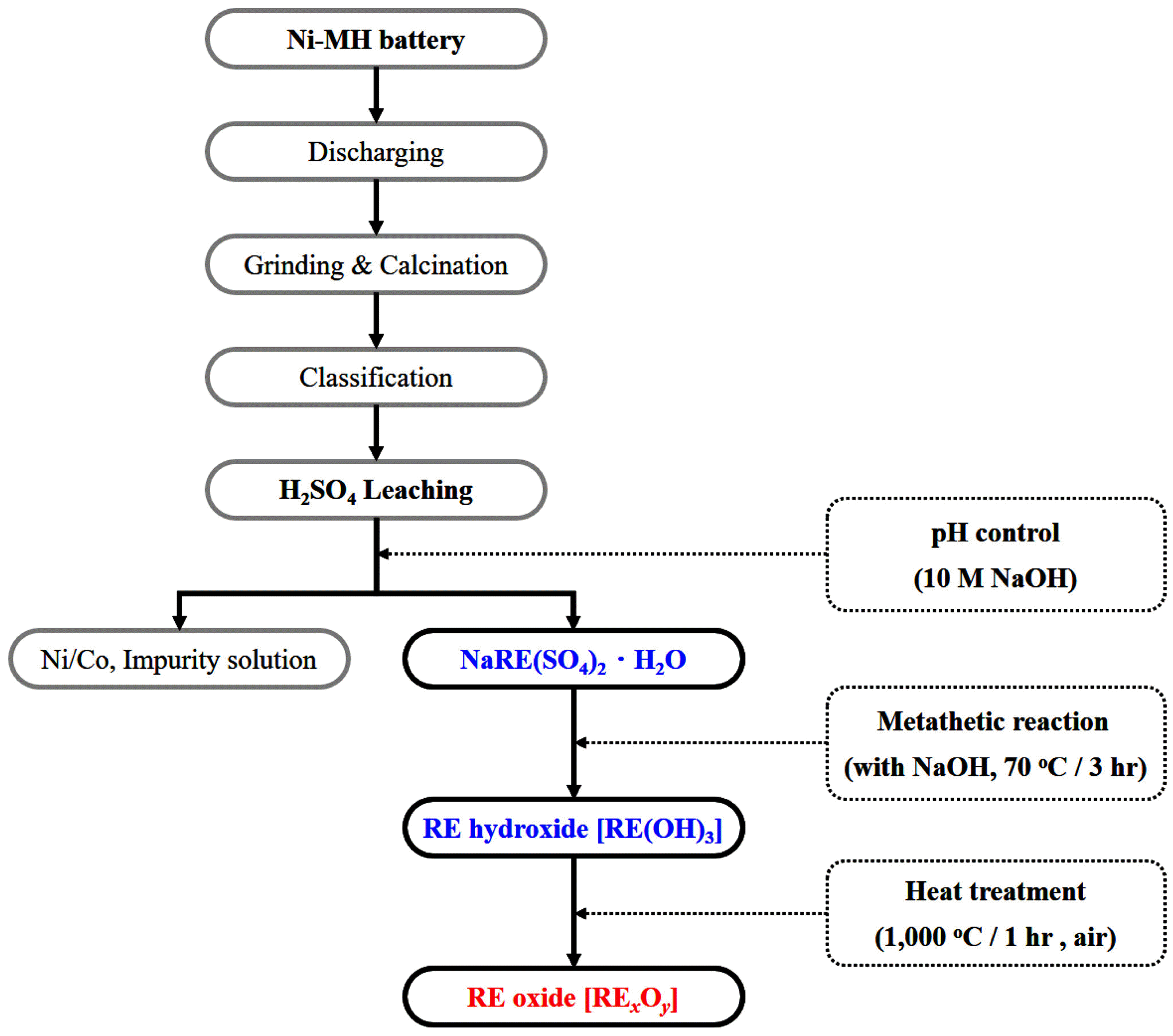
폐니켈수소전지로부터 회수된 희토류 침전물의 희토류 산화물 분말 제조에 대한 연구
A Study on the Preparation of Rare Earth Oxide Powder for Rare Earth Precipitates Recovered from Spent Ni-MH Batteries
Article information
Abstract
We report a method for preparing rare earth oxides (RexOy) from the recycling process for spent Ni-metal hydride (Ni-MH) batteries. This process first involves a leaching of spent Ni-MH powders with sulfuric acid at 90°C, resulting in rare earth precipitates (i.e., NaRE(SO4)2·H2O, RE = La, Ce, Nd), which are converted into rare earth oxides via two different approaches: i) simple heat treatment in air, and ii) metathesis reaction with NaOH at 70°C. Not only the morphological features but also the crystallographic structures of all products are systematically investigated using field-emission scanning electron microscopy (FESEM) and X-ray diffraction (XRD); their thermal behaviors are also analyzed. In particular, XRD results show that some of the rare earth precipitates are converted into oxide form (such as La2O3, Ce2O3, and Nd2O3) with heat treatment at 1200°C; however, secondary peaks are also observed. On the other hand, rare earth oxides, RexOy can be successfully obtained after metathesis of rare earth precipitates, followed by heat treatment at 1000°C in air, along with a change of crystallographic structures, i.e., NaRE(SO4)2·H2O → RE(OH)3 →RexOy.
1 서 론
니켈수소전지(Ni-MH; Nickel-Metal Hydride Battery)는 기존에 사용되고 있는 니켈카드뮴전지보다 에너지 효율이 높고, 음극 활물질로 사용되고 있는 카드뮴의 유해성으로 인하여 대체 가능한 2차전지로서, 리튬이차전지와 더불어 전기자동차(EV; Electric Vehicle) 및 하이브리드 전기자동 차(HEV; Hybrid Electric Vehicle)의 배터리로 사용되고 있 다[1]. 일본의 경우, Sanyo electric을 인수한 Panasonic에서 자동차 탑재용 니켈수소전지를 제조하고 있으며 Honda, Volkswagen 그리고 Ford 등의 하이브리드 자동차에 사용 되고 있다.
최근 들어 이러한 니켈수소전지 탑재 하이브리드 자동 차에서 사용 후 폐기되는 니켈수소전지가 다량 발생함에 따라 폐니켈수소전지에 함유되어 있는 니켈, 코발트 그리 고 희토류 등의 자원 확보를 위한 재활용 연구가 활발하 게 진행되고 있다[2-5].
2017년 V. Innocenzi 등이 보고한 바에 따르면[6], 현재 까지 폐니켈수소전지에 대한 재활용 연구는 주로 황산 및 염산에 의한 침출 효과와 목적 금속(Ni, Co) 회수를 위한 용매추출 공정에 대한 연구가 주로 이루어져 있으며 희토 류를 재활용하기 위해 회수하는 연구에 대해서는 진행되 고 있지 않다. 또한 2002년 L. Pietrelli 등은 폐니켈수소전 지 분말을 2 M 황산 용액에 침출한 후 NaOH로 pH < 1.5 의 조건에서 침전시켜 NaLa(SO4)2·H2O의 결정상으로 희 토류를 회수한 것으로 보고하였으며[7], 2009년 D. A. Bertuol 등도 2 M 황산 용액에 폐니켈수소전지 분말을 침 출한 후 5 M의 NaOH 및 KOH로 pH 1.6의 조건에서 희 토류를 침전시켜 NaRE(SO4)2·H2O 및 Ce(SO4)3 등과 같은 형태의 희토류를 회수하였다고 보고하였다[8].
희토류 원소는 분광학적 및 자기적 등의 특별한 특성으 로 인하여 형광 재료, 레이저 소자, 영구자석, 수소흡장합 금 그리고 연료전지 등에 사용되며, 첨단 제품에 필수적인 소재로서 사용된다. 이러한 희토류 자원은 지역편중성이 강한 원소로서 bastnasite, monazite, 및 xenotime과 같은 광석에 분포되어 있으며, 이로부터 희토류를 분리하는 연 구가 많이 수행되어 왔다[9-11].
그러나 기존 연구들의 경우 폐니켈수소전지의 재활용은 아직까지 니켈과 코발트 회수를 목적으로 하고 있으며, 희 토류를 산업적으로 사용하기 위한 연구는 활발하게 진행 되고 있지 않은 실정이다.
본 저자들은 이전 연구에서 폐니켈수소전지에 함유된 유 가 금속(니켈, 코발트, 희토류)을 국내에서의 산업적 재활용 을 위해 황산 침출하였고, NaOH를 이용한 침전법을 통해 희 토류를 선택적으로 분리한 내용에 대하여 보고하였다[12,13]. 그러나 침전법을 통해 분리된 희토류는 NaRE(SO4)2·H2O(RE: Ce, La, Nd)의 결정상으로 존재하며 이러한 분말은 산업적 으로 사용되지 않기 때문에 희토류가 주로 사용되는 산화물 이나 메탈 형태로의 변형이 필요하다.
따라서 본 연구는 폐니켈수소전지에서 회수한 NaRE (SO4)2·H2O 형태의 희토류 침전물을 산업적으로 취급이 용 이한 희토류 산화물 형태로 변형시키기 위하여 공기 분위기 에서 단순 열처리를 진행하는 방법뿐 아니라 NaOH를 이용 한 metathesis 반응을 통해 희토류 수산화물 형태로 만들고 이후 하소를 통해 희토류 산화물로 변환하고자 하였다.
2 실험 방법
본 연구에서 사용된 시료는 일본에서 발생한 원형 타입 의 폐니켈수소전지(Model: HHR-33AH72W6, Hitachi) 모 듈을 염수를 통해 방전 시킨 후 분쇄기를 통해 분쇄하고 100 mesh급 분급기를 이용하여 전극 분말을 회수하였다. 회수된 분말에는 니켈이 약 46.6%, 코발트가 약 6.9% 그 리고 희토류(La, Ce, Nd 등)이 약 11.0%가 함유되어 있는 것을 이전 연구를 통해 보고하였다[12,13].
회수된 폐니켈수소전지 전극 분말을 1 M 황산에 고액 농도 25 g/L, 침출 온도 90°C, 침출 시간 4 시간의 조건에 서 침출한 후 10 M NaOH를 이용하여 pH 1.6으로 적정한 후 침전된 희토류 침전물을 회수하였다. 이후, 회수된 침 전물은 NaOH를 이용한 metathesis 반응을 통해 희토류 수 산화물로 제조하는 실험을 실시하였으며, 그림 1에 본 연 구에서 수행된 폐니켈수소전지로부터 회수한 희토류 침전 물에서 희토류 산화물 분말을 제조하는 공정에 대한 흐름 도를 나타내었다.
희토류 침전물은 우선 열 중량 분석기(Thermo Gravimetric Analyzer, Rigaku TG 8121)을 통하여 중량 감소 경향을 분석 하였으며, 이를 바탕으로 여러 온도 구간에서 열처리를 진 행하여 희토류 침전물의 결정 상태를 분석하였다. 열처리된 희토류 화합물 분말은 XRD(X-Ray Diffraction spectroscopy, Shimadzu XRD-6100) 및 FESEM(Tecnai G2 F20S-Twin TmP)을 이용하여 결정상 및 형상 분석을 실시하였다. 침출 액 및 희토류 화합물의 농도는 MP-AES(MIcrowave Plasma-AtoMIc EMIssion Spectroscopy, Agilent MP-AES 4200)를 이용하여 분석하였다.
3 실험 결과
본 저자들의 기존 논문[12]에 보고한 바와 같이 희토류 침전물은 폐니켈수소전지 분말을 1 M 황산 용액에 고액 농도 25 g/L, 침출 온도 90°C, 침출 시간 4 시간의 조건에 서 침출하였고, 침출액에 10 M NaOH 용액을 천천히 적 정하여 pH 1.6에서 희토류 침전물을 확보하였으며, 이를 본 실험의 원료로 사용하였다.
희토류 침전물의 조성은 표 1에 나타낸 것과 같이 Na이 33.3%, La 18.3%, Nd 20.6%, Ce 25.6%가 함유되어 있으 며, 그 외 불순물로서 Zn, Fe, Ni, K 등이 약 1.8%가 같이 함유되어 있다.
회수된 희토류 침전물은 흰색 분말 상태로 그 결정상 및 형태를 확인하기 위해 XRD 와 FESEM 분석을 진행하였 으며, 그 결과를 그림 2에 나타내었다. XRD분석 결과, 희 토류 중에서도 함유량이 높은 La, Ce, 그리고 Nd이 함유 된 NaRE(SO4)2·H2O(JCPDS #82-1199, #86-0526, #40- 1481) 결정상으로 분석되었으며, 그 모양은 마이크로 크기 의 각 기둥들이 서로 응집되어 있는 형태로 존재하는 것 을 확인하였다. 그리고 황산 침출 용액에서 NaOH 첨가에 의한 희토류 침전물이 발생하는 반응식은 식 (1)에 나타내 었다.
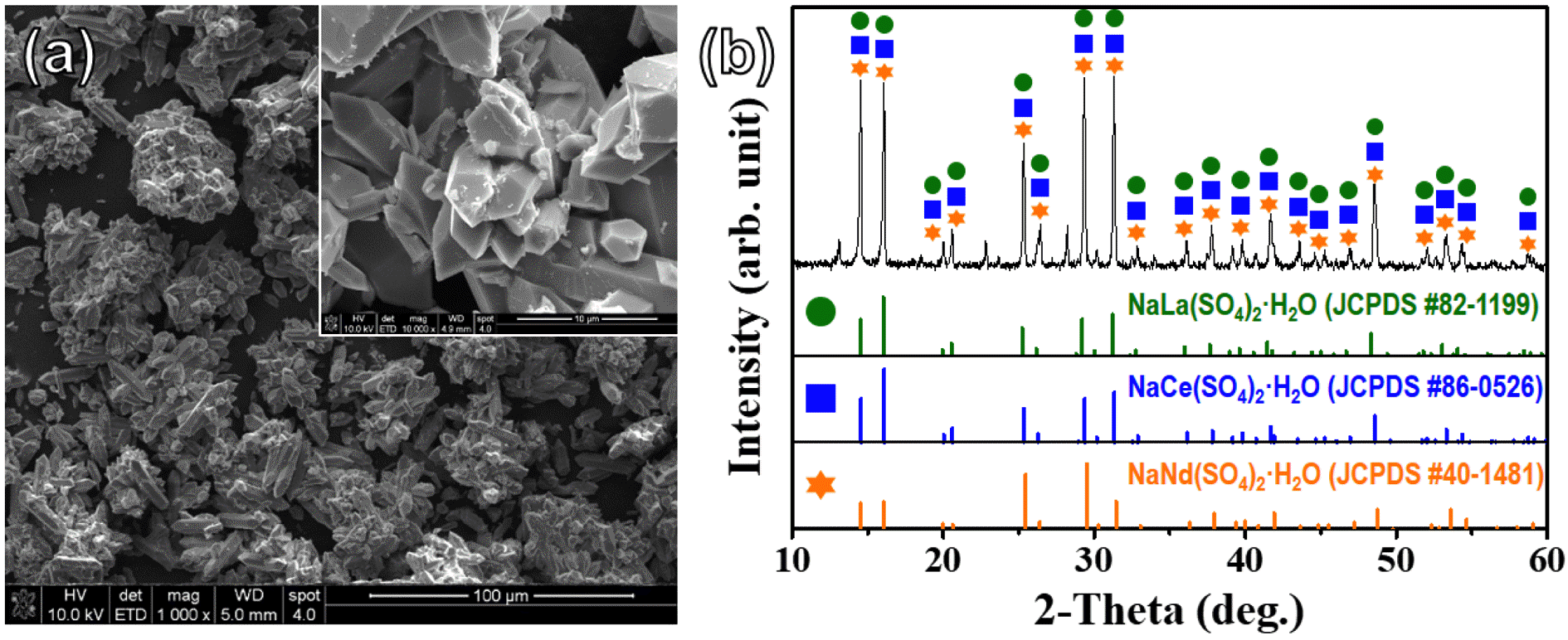
(a) Typical FESEM image and (b) XRD pattern of rare earth precipitates taken after H2SO4 leaching process. The inset of (a) shows a high-magnification observation of rare earth precipitates.
여기서 MI은 +1가 이온인 Na이며 MIII는 희토류인 La, Ce, Nd를 의미한다. 위와 같은 반응에 의하여 확보된 희토 류 침전물을 산업적으로 적용이 유리한 희토류 산화물로 변환 및 불순물 제거를 위해 본 연구에서는 우선적으로 공 기 분위기에서 온도 변화에 따른 열처리를 진행하였다.
먼저 희토류 침전물의 열처리에 따른 결정성 변화와 열 처리 온도를 설정하기 위하여 공기 분위기 하에서 TG 분 석을 실시하였다.
TGA 분석 결과는 그림 3과 같으며 2단계의 걸쳐서 중 량 변화가 이루어지는 것을 확인하였다. 첫 단계는 200~ 300°C에서 진행되며 약 4.4%가 감소하였다. 이론적으로 계산하였을 때 NaRE(SO4)2·H2O의 분자량을 수화물이 제 거된 NaRE(SO4)2 분자량에 나눌 경우 약 4.8%의 중량이 감소하는 것으로 보아 첫 번째 단계에서는 수화물 제거에 따른 중량 감소로 판단된다. 두 번째 단계는 700~1200°C 구간에서 초기 중량 대비 약 25.9%가 감소되고 있는 것을 확인하였으며, 이는 희토류 침전물의 일부 산화물화 및 희 토류와 결합하고 있던 Na 및 S가 휘발 되면서 감소되는 것으로 판단된다.
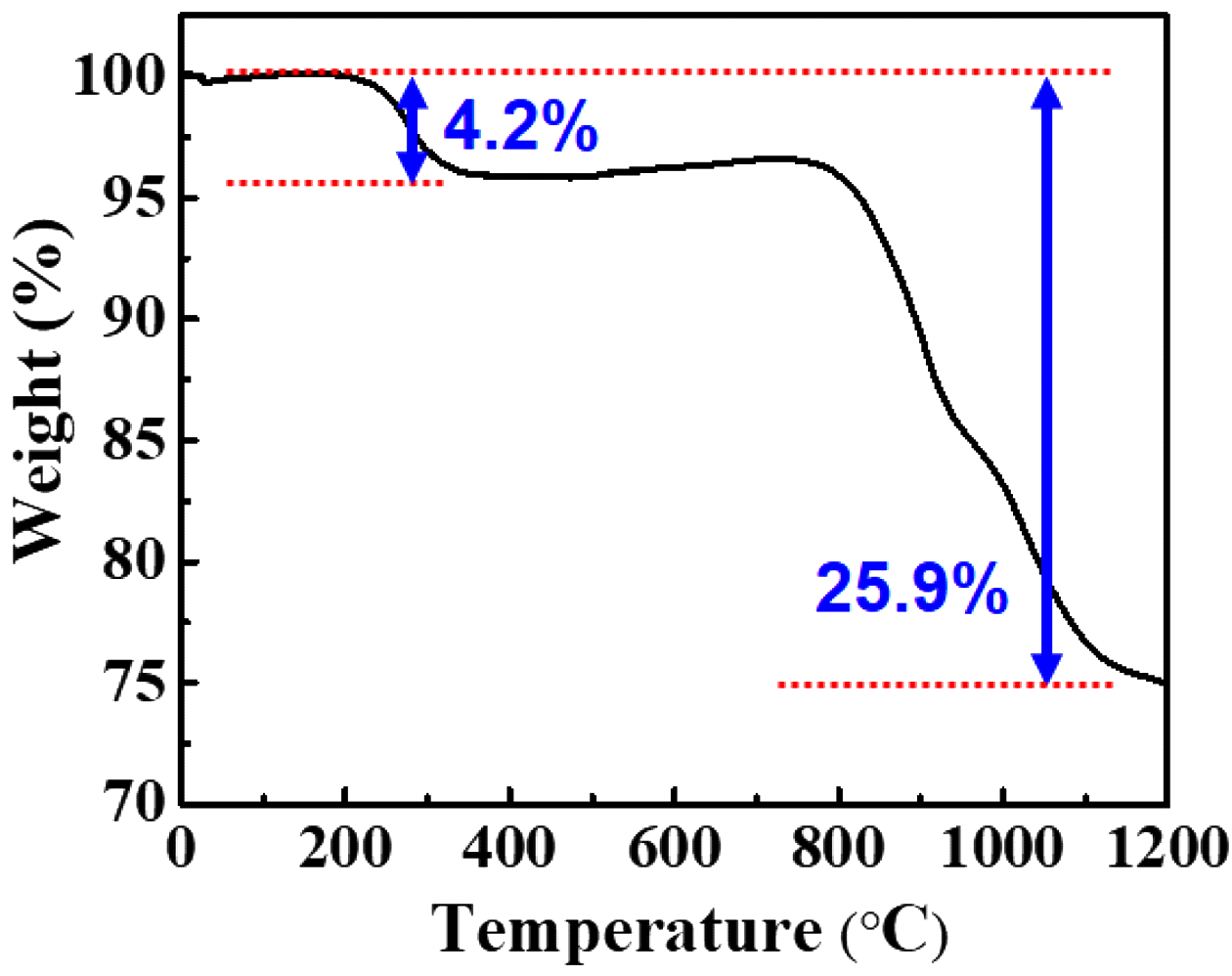
Thermal behavior of rare earth precipitates (NaRE (SO4)2·H2O, RE = La, Ce, Nd) in air (Heating rate: 10°C/MIn).
TG 분석 결과를 바탕으로 열처리에 따른 희토류 침전물 의 결정상을 확인하기 위하여 600°C, 1000°C, 1200°C의 온도에서 각각 1 시간 동안 열처리 후 XRD 분석을 실시 하였고 그 결과는 그림 4에 나타내었다.
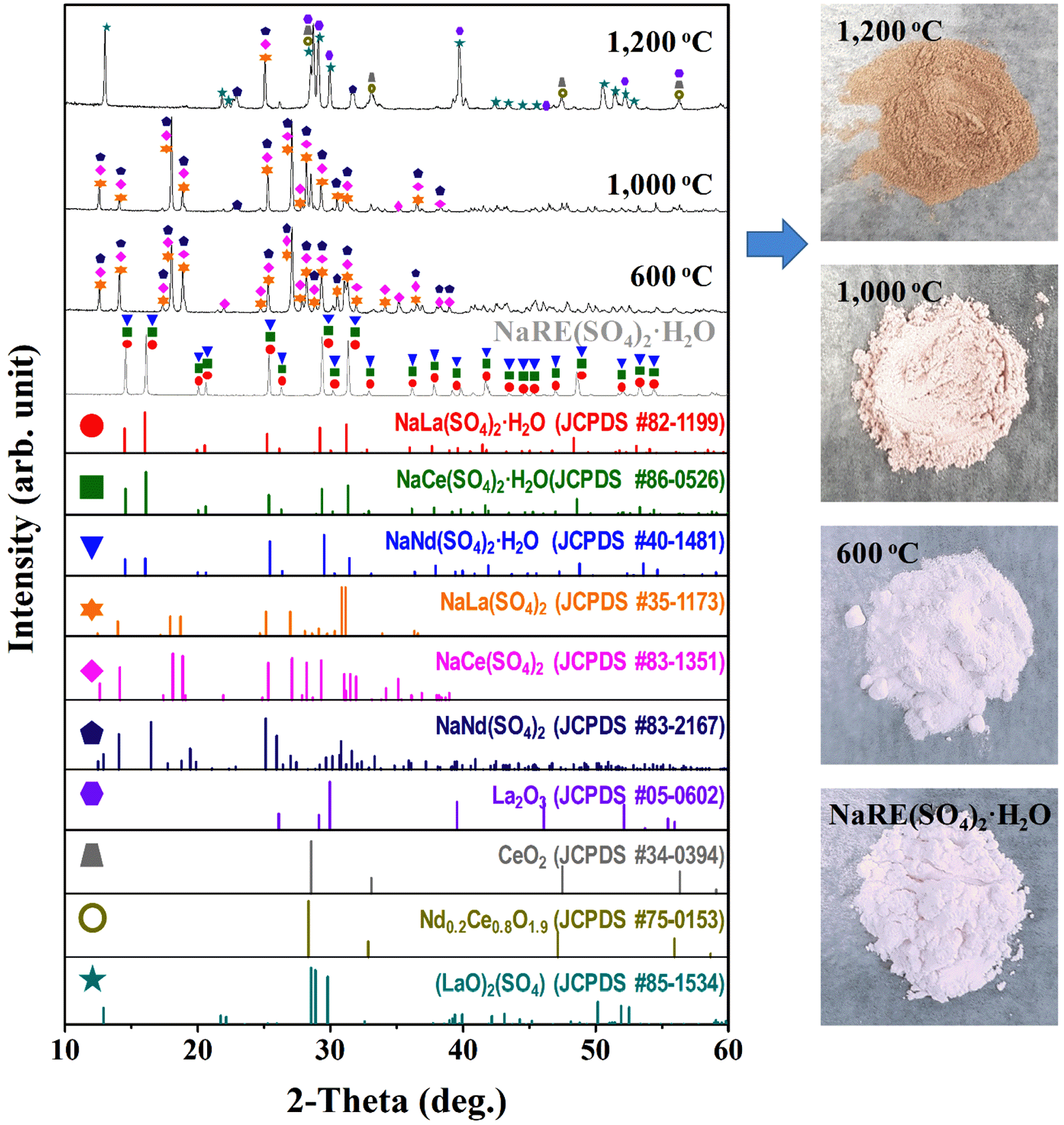
XRD patterns of rare earth precipitates (NaRE(SO)4·H2O) with the various heat treatment conditions (left), and corresponding the digital photographs of powder, respectively (right).
600°C에서 열처리한 분말의 경우 앞선 TGA 결과에서 예상했던 것과 같이 원료에 있던 H2O가 제거되고 La, Ce 그리고 Nd가 함유된 NaRE(SO4)2 (JCPDS #35-1173, #83- 1351, #83-2167) 형태의 분말로 분석되었으며, 분말색은 기존 원료와 같은 백색으로 유지되었다. 1000°C에서는 NaRE(SO4)2 peak가 주로 형성되어 있지만 기존에 없었던 새로운 peak 들이 나타나는 것으로 보아 새로운 결정상이 생성되고 있음을 알 수 있었으며, 1000°C 열처리 후에는 희토류 침전물 분말색이 백색에서 연한 핑크색으로 변환 되어 600°C와는 다른 결정이 생성된 것으로 판단된다. 하 지만 낮은 intensity 및 혼합상으로 인한 정확한 indexing 이 어려워 어떠한 결정상이 생성되었는지에 대한 결과는 확인할 수 없었다. 그러나 1200°C에서는 La2O3(JCPDS #05-0602), CeO2(JCPDS #34-0394), Nd0.2Ce0.8O1.9(JCPDS #75-0153), (LaO)2(SO4) (JCPDS #85-1534)와 같은 희토류 산화물 및 희토류 황산화물 peak가 확인되었으며, NaRE(SO4)2 peak도 미량 잔존하고 있음을 확인하였다. 1200°C 열처리 후 분말색은 갈색으로 변하여 기존 희토류 침전물이 다른 상으로 변환된 것을 간접적으로 알 수 있었 다. 따라서 희토류 침전물을 단순 열처리 공정을 통해 산화 물화 하기 어렵다고 판단되어 NaOH를 이용한 metathesis 반응으로 희토류 수산화물 형태로 변환하고 이후 열처리를 통해 희토류 산화물로 얻고자 하였다(그림 5).

(a) Digital photographs from the rare earth precipitate (NaRE(SO4)2·H2O) to rare earth oxide (RExOy) powders, and (b~d) corresponding FESEM images, respectively.
Metathesis 반응에 의한 희토류 수산화물 반응식은 식 (2)와 같이 나타낼 수 있으며, 이는 1992년 Gupta와 krishnamurthy 가 monazite 희토류 광석에서 희토류를 회수하기 위하여 NaOH를 이용한 공정을 제안하였다[14]. 2010년 Abreu와 Morais 등은 monazite 광석을 황산 침출 한 후 침출액으로부 터 NaRE (SO4)2·H2O 분말을 회수하였고 2M NaOH 용액과 70°C에서 1 시간 동안 반응시켜 희토류 수산화물을 얻었다고 발표하였으나 자세한 결과에 대해서는 보고되지 않았다[15].
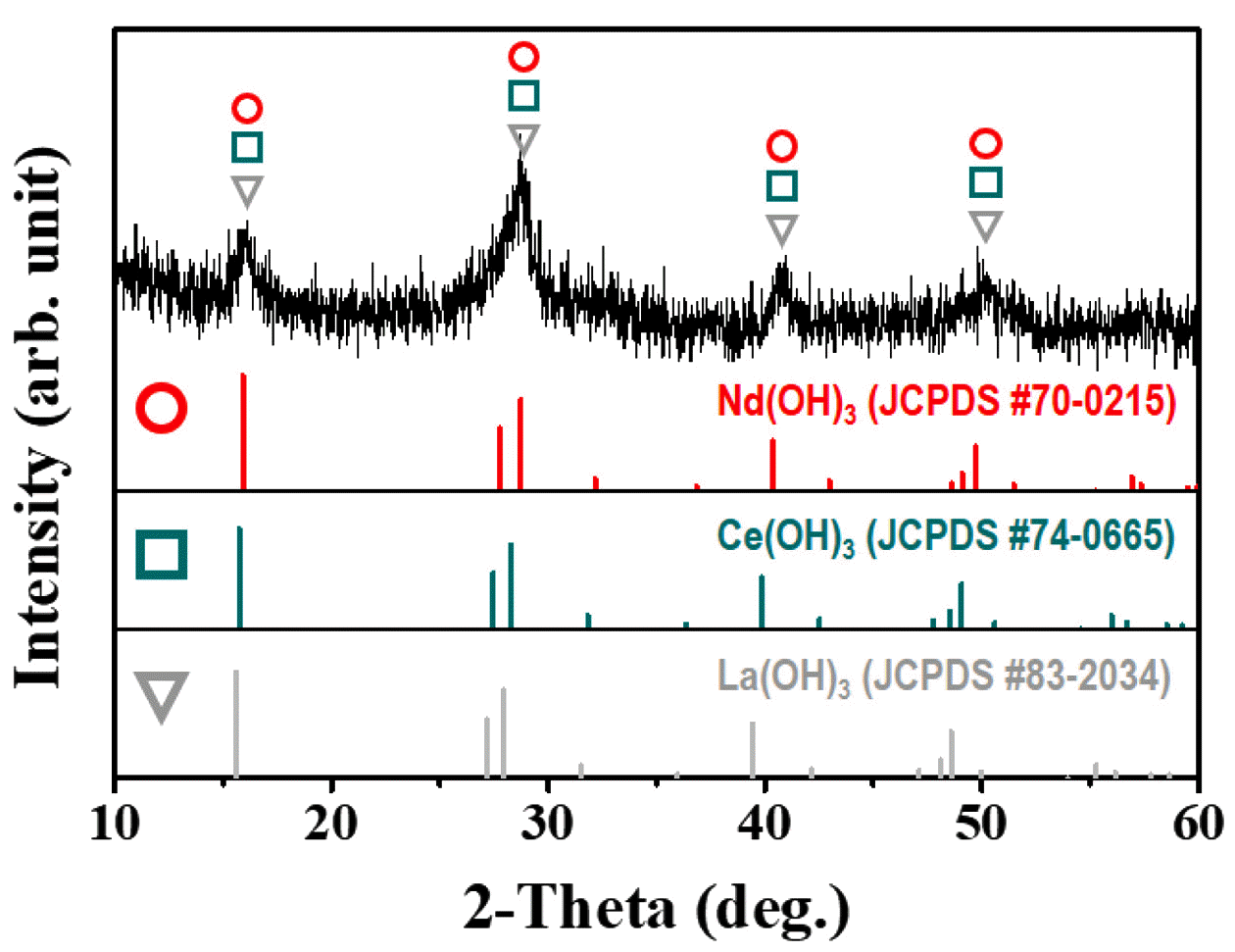
앞선 참고문헌을 바탕으로 희토류 수산화물을 얻기 위 하여 희토류 침전물을 NaOH 수용액에 첨가하였으며 반 응 온도 70°C에서 3 시간 동안 반응시켰다. 반응이 끝난 분말은 metathesis 반응에 따라 생성되는 Na2SO4 제거를 위하여 수세를 3번 진행하고 12 시간 건조하여 희토류 수 산화물을 회수하였다. 회수된 분말은 황색의 분말이었으 며, 그 결정상을 확인하기 위하여 XRD 분석을 실시하였 고 그림 6에 결과를 나타내었다.
XRD 분석 결과 NaRE(SO4)2·H2O 분말이 희토류 수산화 물인 RE(OH)3 형태로(JCPDS #70-0215, #74-0665, #83- 2034)로 변환되었음을 확인할 수 있었다. FESEM을 이용 하여 분말 형태를 살펴본 결과(그림 5) 희토류 수산화물의 분말 형태는 희토류 침전물인 NaRE(SO4)2·H2O 분말에 비 해 다소 불규칙적이지만 기존의 각기둥 모양을 유지하고 있음을 알 수 있었다.
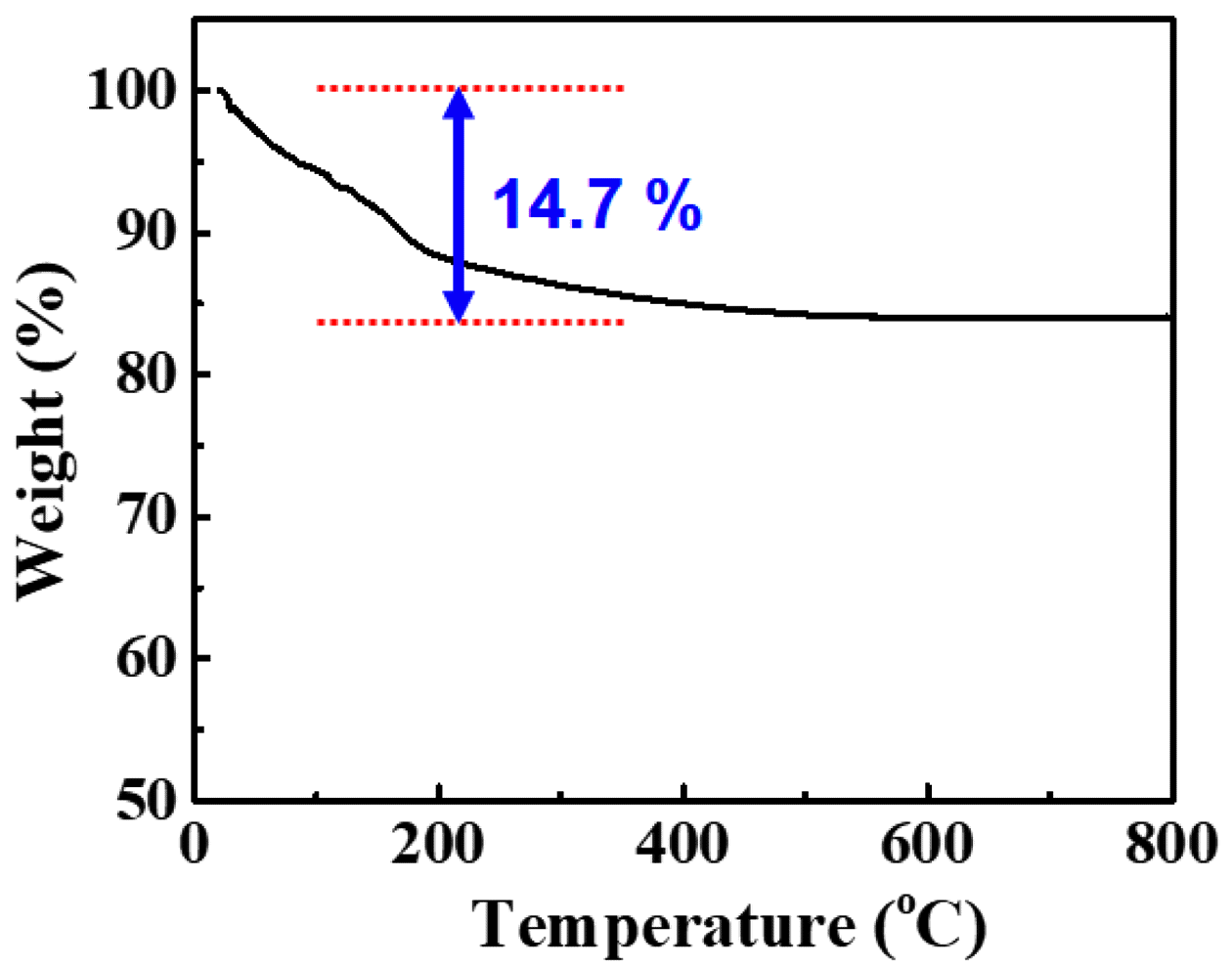
희토류 수산화물의 온도에 대한 중량 변화 및 산화물로 변환하기 위한 열처리 온도를 설정하기 위하여 TG 분석 을 실시하였으며 그 결과를 그림 7에 나타내었다.
TG 분석 결과 1단계의 중량 변화가 나타났으며 약 500°C 에서 약 14.7%가 감소하였다. 이는 희토류 수산화물에서 열 처리에 의해 희토류 산화물로 변함에 따른 이론적인 중량 변화량 약 14.1%와 유사한 것으로 보아 수산화물에서 산화 물 형태로 변환되는 것에 따른 중량 감소분으로 판단된다.
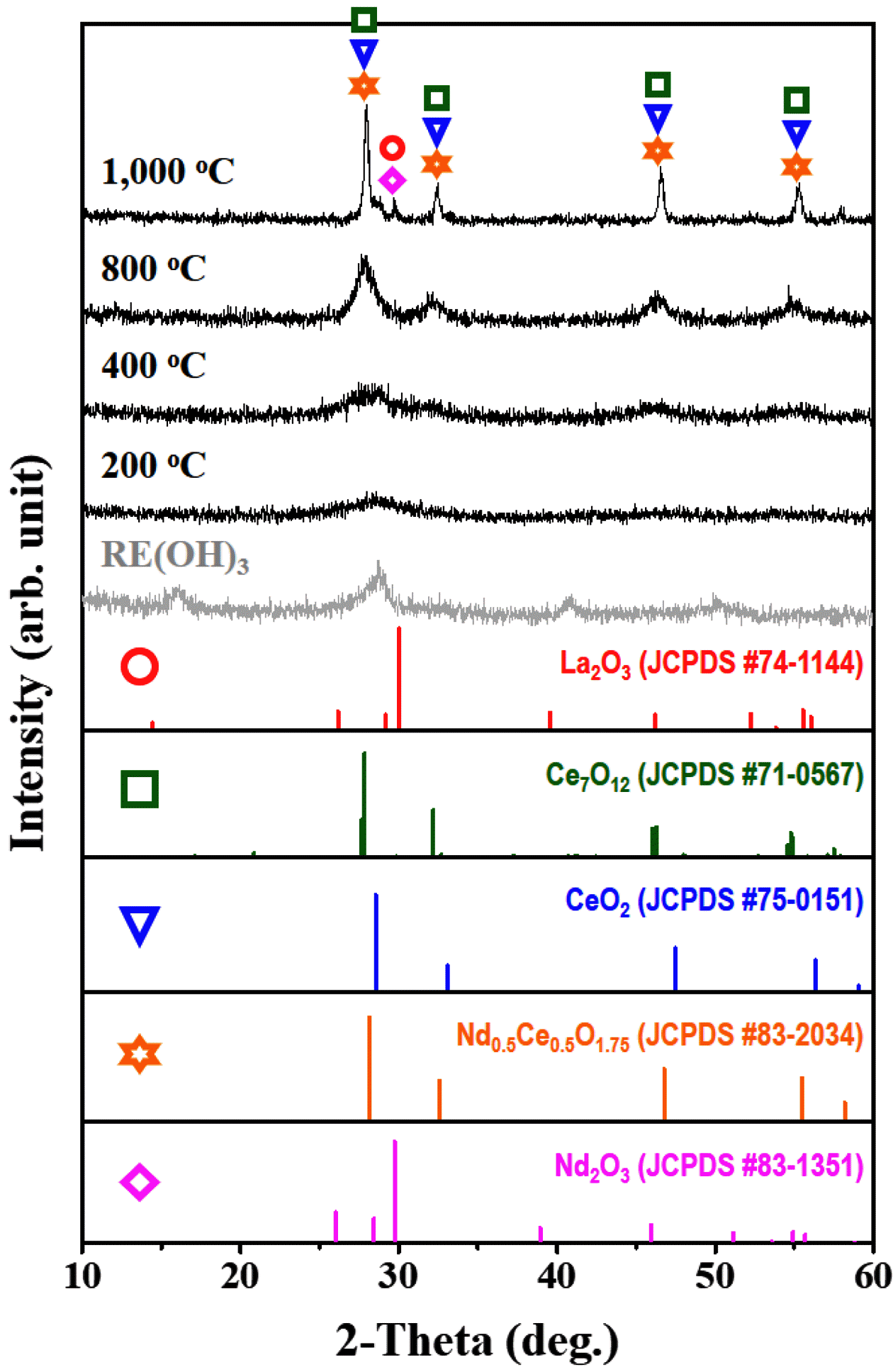
그림 7의 TGA 결과를 바탕으로 온도 변화에 따른 희토 류 수산화물의 결정성 변화를 확인하기 위하여 200°C, 400°C, 800°C, 1000°C에서 각각 1 시간씩 열처리를 진행 하였고 그 결과를 그림 8에 나타내었다.
200°C, 400°C 및 800°C에서는 XRD peak가 Nd, Ce 그 리고 La를 함유한 희토류 수산화물에서 Ce 산화물 결정의 peak가 나타나기 시작하였으며, 1000 °C에서는 La2O3 (JCPDS #74-1144), Ce7O12 (JCPDS #71-0567), CeO2 (JCPDS #75-0151), Nd0.5Ce0.5O1.75 (JCPDS #83-2034), Nd2O3 (JCPDS #83-1351)와 같은 희토류 산화물이 생성되 었음을 확인하였다. 2015년 J. G. Kang 등이 보고한 바에 따르면[16], La(OH)3분말을 900°C 이상에서 열처리를 통 해서 La2O3을 얻었다고 발표하였으며 본 연구 결과에서도 La(OH)3 분말을 1000°C에서 열처리하였을 때 La2O3의 결 정상이 나타나는 것을 확인하였다.
희토류 수산화물을 열처리하여 회수한 희토류 산화물 분 말은 그림 5에 나타낸 것과 같이 진한 갈색을 띠고 있었으 며, 그 형태는 앞선 NaRE(SO4)2·H2O 및 RE(OH)3와 유사한 각기둥 형태를 유지하고 있음을 확인하였다. 그러나 각 희 토류 산화물이 본 결과와 같이 각기둥 형태를 유지하는지 에 대해서는 추가적인 연구가 필요하다고 판단된다.
4 결 론
본 연구에서는 폐니켈수소전지 분말을 황산 침출 및 알 칼리 반응을 통하여 회수한 희토류 침전물인 NaRE(SO4)2· H2O 분말을 산업적으로 활용할 수 있도록 고온 열처리와 NaOH를 이용한 metathesis 반응을 통하여 희토류 산화물 을 얻는 연구를 진행하였다.
NaRE(SO4)2·H2O 분말을 열처리할 경우 300~700°C 구 간에서 수화물 제거가 가능하며 1200°C에서는 희토류 산 화물 및 희토류 황산화물이 생성되는 것을 확인하였다. 그 러나 XRD 분석 결과 희토류 산화물 외에도 NaRE(SO4)2 peak들이 잔존하고 있어 단순 열처리를 통한 희토류 산화 물 변환은 다소 어려운 것으로 판단된다.
NaRE(SO4)2·H2O 분말을 희토류 산화물로 변환하기 위 해 NaOH를 이용한 metathesis 반응을 진행할 경우 희토류 수산화물이 생성되었으며, Nd(OH)3 (JCPDS #70-0215), Ce(OH)3 (JCPDS #74-0665), La(OH)3 (JCPDS #83-2034) 인 것으로 확인되었다.
희토류 수산화물을 다시 800°C 이상에서 열처리할 경우 희토류 산화물로 변환이 가능하였으며, La2O3 (JCPDS #74-1144), Ce7O12 (JCPDS #71-0567), CeO2 (JCPDS #75- 0151), Nd0.5Ce0.5O1.75 (JCPDS #83-2034), Nd2O3 (JCPDS #83-1351)과 같은 희토류 산화물이 생성되었음을 확인하 였다.
최종적으로 NaRE(SO4)2·H2O 분말을 NaOH와의 metathesis 반응을 이용한 산화물화가 가능하였으며, 추후 희토류 산화 물을 이용한 산업적 활용 및 희토류 고순도화를 위한 원소별 분리 연구가 가능할 것으로 사료된다.
감사의 글
본 연구는 한국에너지기술평가원의 에너지기술개발사 업(과제번호: 20152510101820)에 의해 수행되었습니다.