볼 밀링한 CuO-Co3O4 혼합분말의 수소환원 거동과 미세조직 특성
Hydrogen Reduction Behavior and Microstructure Characteristics of Ball-milled CuO-Co3O4 Powder Mixtures
Article information
Abstract
The hydrogen reduction behavior of the CuO-Co3O4 powder mixture for the synthesis of the homogeneous Cu-15at%Co composite powder has been investigated. The composite powder is prepared by ball milling the oxide powders, followed by a hydrogen reduction process. The reduction behavior of the ball-milled powder mixture is analyzed by X-ray diffraction (XRD) and temperature-programmed reduction at different heating rates in an Ar-10%H2 atmosphere. The scanning electron microscopy and XRD results reveal that the hydrogen-reduced powder mixture is composed of fine agglomerates of nanosized Cu and Co particles. The hydrogen reduction kinetics is studied by determining the degree of peak shift as a function of the heating rate. The activation energies for the reduction of the oxide powders estimated from the slopes of the Kissinger plots are 58.1 kJ/mol and 65.8 kJ/mol, depending on the reduction reaction: CuO to Cu and Co3O4 to Co, respectively. The measured temperature and activation energy for the reduction of Co3O4 are explained on the basis of the effect of pre-reduced Cu particles.
1. 서 론
Cu-Co 계는 비자성의 Cu 기지상 내에 자성을 가지는 Co 입자의 석출을 통한 입도 및 분산도 제어로 매우 낮은 보자력 값을 나타내는 초상자성 재료로 응용되고 있다[1, 2]. 또한 CuxCo3-xO4 등은 물의 전기분해를 이용한 고순도 수소생산 공정에서 기존의 고가 촉매제를 대체할 수 있는 anode 촉매물질로 주목받고 있다[3, 4]. 그러나 Cu-Co 계 는 약 420°C 이하의 저온영역에서 혼합 엔탈피가 양(+)의 값을 가지기 때문에 상호 고용도가 없어 FCC구조 Cu와 HCP구조 Co의 혼합상으로 존재한다[5]. 따라서 기계적 합 금화 공정이나[6] 급속 응고법[7] 등을 이용하여 준안정상 의 과포화 고용체를 형성시킨 후 열처리를 통하여 Co입자 를 석출하여 Cu-Co 복합재료로 제조하는 공정이 적용되 고 있다. 그러나 기존 공정은 분말합성 중의 불순물 혼입 이나 입자 조대화 등의 문제가 있어 다양한 공업적 응용 에는 제약이 있다.
복합분말 제조의 다른 방법으로는 산화물 혼합분말을 고에너지 볼 밀링하고 수소분위기에서 환원하는 공정으로 W-Cu 및 Mo-Cu 계에서 보고된 바와 같이 분말크기의 미 세화와 함께 성분 분말들의 균일한 혼합이 가능하다는 점 에서 많은 관심의 대상이 되고 있다[8, 9]. 따라서 Cu-Co 계도 산화물 혼합분말의 수소환원 공정을 이용하여 미세 한 입도와 균일한 혼합상을 가지는 복합분말로의 합성이 가능할 것으로 판단되나, 제조한 분말의 정밀한 미세조직 특성 제어를 위해서는 금속산화물 분말의 수소환원 거동 에 대한 정량적인 해석이 요구된다.
본 연구에서는 금속산화물인 CuO와 Co3O4 분말을 원료 로 하여 볼 밀링과 수소환원 공정으로 균일한 Cu-Co 복합 분말을 제조하고자 하였다. 또한 CuO-Co3O4 혼합분말의 수소환원 거동을 해석하고 환원조건에 따른 미세조직 특 성을 분석하여 Cu-Co 복합분말 제조를 위한 최적의 공정 조건을 제시하고자 하였다.
2. 실험방법
본 연구에서는 순도 99.9%, 입자크기 1 μm의 CuO (Kojundo Chemical Lab., Co.)와 순도 99.7%, 입자크기 2~6 μm의 Co3O4(Alfa Aesar Co.) 분말을 원료로 사용하였 다. 그림 1은 원료분말의 미세조직 사진으로 CuO 분말은 약 100 nm 크기의 입자들로 이루어져 있으며 Co3O4는 미 세한 입자들이 구형의 커다란 응집체를 형성하고 있음을 나타낸다. 최종조성이 Cu-15 at% Co가 되도록 산화물 원 료분말을 계산하여 혼합한 후, 직경 5 mm의 ZrO2 볼과 함 께 에탄올 용액 내에서 24시간 동안 밀링하였다. 볼과 분 말의 무게비는 15:1로 하였으며 밀링한 분말의 건조 후, 응집체를 제거하기 위해 직경 10 mm의 ZrO2 볼과 함께 10시간 동안 건식 밀링하였다.
볼 밀링한 산화물 분말의 환원거동을 해석하기 위해 시 편을 가열하는 장치와 배출되는 가스의 열전도도를 측정 하는 TCD(thermal conductivity detector)로 구성된 TPR (temperature programmed reduction) 분석을 실시하였다[10]. 분말 약 30 mg을 quartz 관에 넣고 전처리를 통해 불순물 및 수분을 제거한 후 TPR 장비에서 Ar-10% H2 혼합가스 를 0.05 l/min의 유속으로 흘려주며 2~20°C/min의 승온속 도로 600°C까지 가열하여 TCD 값의 변화를 측정하였다. 원료 및 환원분말의 상 변화와 미세조직 특성은 XRD(D/ Max-IIIC, Rigaku Denki Co.)와 SEM-EDX(JSM-6700F, JEOL Co.)을 이용하여 분석하였으며, 볼 밀링한 분말의 입도분포는 레이저 입도분석기(LPA, Beckman Counter Co., Model: Ls I3 320)를 이용하여 측정하였다.
3. 실험결과 및 고찰
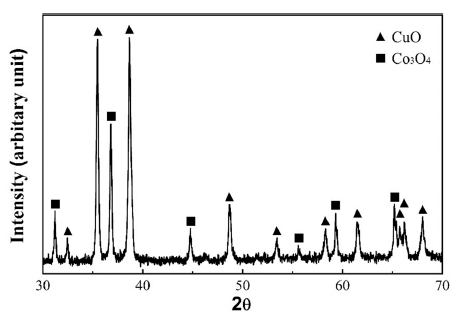
습식으로 24시간 동안 볼 밀링한 원료분말을 건조한 후 다시 10시간 동안 건식 밀링한 CuO-Co3O4 혼합분말의 미 세조직과 입도 분석 결과를 그림 2(a)와 (b)에 각각 나타 내었다. 그림 1의 원료분말과 비교할 때 볼 밀링한 혼합분 말에서는 Co3O4의 응집체 크기가 상대적으로 감소하였으 며 미세한 CuO 분말들이 균일하게 분포함을 알 수 있다. 또한 혼합분말의 평균 입자크기도 3.9 μm로 감소하여, 볼 밀링 공정으로 입자 미세화와 함께 원료분말들의 균일한 혼합이 가능함을 보여준다. 그림 3은 볼 밀링한 후의 XRD 분석 결과로 혼합분말은 CuO와 Co3O4 상에 해당하 는 피크만 관찰된다.
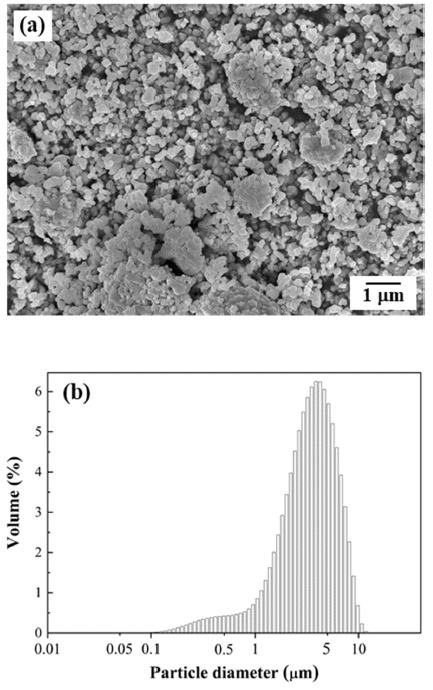
Characteristics of ball-milled CuO-Co3O4 powder mixture; (a) SEM image and (b) particle size distribution.
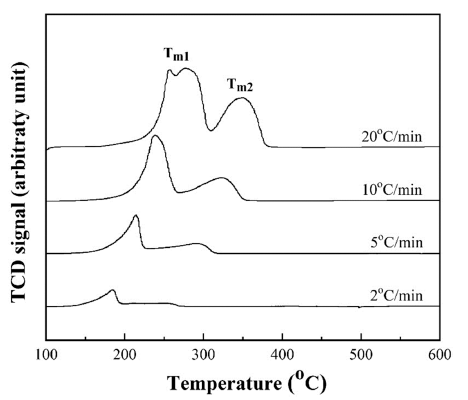
그림 4는 원료분말인 CuO와 Co3O4 및 볼 밀링한 CuOCo3O4 혼합분말의 환원거동을 분석하기 위해 TPR을 이용 하여 Ar-10% H2 혼합가스 분위기에서 승온속도 10°C/min 으로 가열하며 온도에 따른 TCD 값의 변화를 나타낸 것 이다. 순수한 원료분말의 경우 CuO에서는 228°C와 244°C, Co3O4은 362°C와 397°C에서 TCD 피크가 관찰된다. 일반 적으로 순수한 CuO는 실험조건에 따라 200~300°C의 온 도범위에서 Cu2O를 동반하는 단계 환원과정을 거쳐 최종 적으로 금속상의 Cu로 형성된다[11]. Co3O4의 경우는 저 온에서 중간 생성물인 CoO가 우선 형성되고 370°C 이상 의 온도에서는 CoO가 Co로 환원된다[12]. 따라서 그림 4 의 각각의 원료분말에서 나타나는 2개의 피크는 중간 생 성물을 동반하는 환원에 기인한 것으로 설명된다.
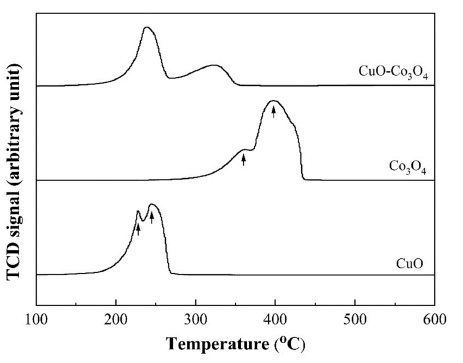
TCD signal curves for the reduction process of CuO, Co3O4 and CuO-Co3O4 powders, obtained at a scanning rate of 10°C/min in Ar-10% H2 atmosphere.
CuO-Co3O4 혼합분말의 경우에는 239°C와 323°C에서 피크가 관찰되며 첫번째 피크는 CuO의 환원과 관련된 것 으로 해석되나 두번째 피크는 순수한 Co3O4의 환원반응 피크보다 낮은 온도에서 관찰된다. 복합분말에서의 환원 온도 변화는 기존의 연구에서도 일부 보고된 바 있으며, Kim 등[13]은 WO3-CuO 복합분말의 환원거동 해석을 통 해 상대적으로 저온부위에서 먼저 환원된 Cu 입자가 고온 에서 환원되는 WO3의 환원반응을 활성화시켜 환원온도를 낮춘다고 설명하였다. 따라서 CuO-Co3O4 혼합분말에서 나타나는 두번째 반응 피크는 Co3O4의 환원에 기인한 것 이며 저온에서 환원된 Cu 입자의 영향에 의해 상대적으로 낮은 환원온도를 나타내는 것으로 해석된다.
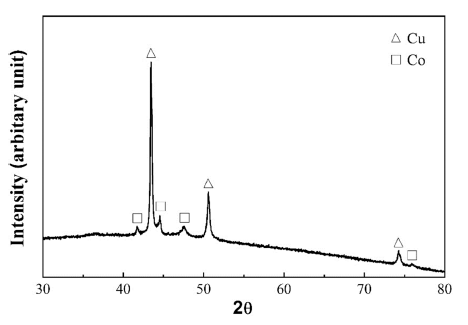
혼합분말의 환원처리에 따른 상 변화를 확인하기 위해 XRD를 이용한 분석을 실시하였다. 그림 5는 500°C에서 2 시간 동안 수소분위기에서 열처리한 시편의 XRD분석 결 과로 환원한 혼합분말에서는 중간 반응상의 형성없이 순 수한 Cu와 Co 상의 피크로만 존재함을 알 수 있다. 이러 한 결과는 Cu-Co 계의 혼합 엔탈피가 양의 값을 가지고 있어 고용체 형성 보다는 Cu와 Co의 혼합 상으로 존재하 기 때문으로 해석된다[5].
그림 6은 TPR을 이용하여 승온속도에 따른 CuO-Co3O4 혼합분말의 환원거동을 분석한결과로 CuO와 Co3O4의 환 원과 관련된 2개의 피크가 관찰된다. 승온속도가 2°C/min 에서 20°C/min으로 증가함에 따라 반응피크의 온도가 고 온으로 이동하며 이는 환원이 열활성화 반응에 지배받기 때문이다. 따라서 승온속도(φ) 증가에 따른 피크온도(Tp) 의 변화는 직접적으로 산화물 분말의 환원에 대한 활성화 에너지(Q)와 관련됨으로 아래의 Kissinger 식을 이용하여 그 값을 계산할 수 있다[14].
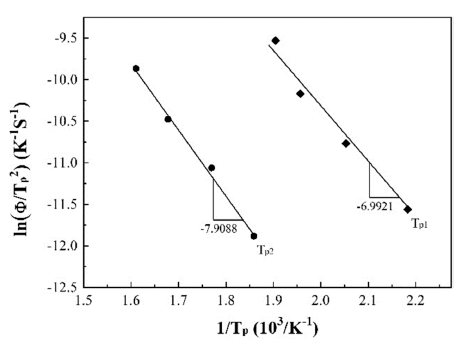
그림 7은 각 승온속도에 따른 2개의 피크온도(Tp1, Tp2) 값으로부터 각각 ln(φ/Tp2)을 계산하여 y축으로 하고 1/Tp 을 x축으로 나타낸 그림이다. 각 직선의 평균 기울기인 7.9088×103과 6.9921×103에 기체상수 값(R)을 곱하면 환 원 반응에 대한 활성화에너지는 58.1 kJ/mol 및 65.8 kJ/ mol로 계산된다.
그림 4의 설명과 같이 CuO의 환원에 관련된 첫번째 피 크온도(Tp1)의 활성화에너지 58.1 kJ/mol은 기존 연구에서 보고된 값인 60.7~114.6 kJ/mol과 비교하여 다소 낮은 값 을 나타내며 이러한 차이는 원료분말 및 환원분위기의 차 이 등에 기인한 것으로 판단된다[11, 15]. 두번째 피크온도 (Tp2)의 변화는 Co3O4에서 Co상으로의 환원과 관련되며 본 연구에서 계산한 활성화에너지는 Lin 등이[12] 보고한 83.0~94.4 kJ/mol와 비교하여 상대적으로 낮은 값이다. 이 는 우선적으로 그림 4의 TPR 곡선에 대한 환원온도에서 설명한 바와 같이 먼저 환원된 Cu입자의 영향 때문으로 해석되어 향후 추가적인 연구가 요구되나, 볼 밀링한 혼합 분말에서 각 산화물의 활성화에너지를 평가하였다는 점에 서 환원거동 해석에 새로운 기초자료로 사용될 수 있는 유익한 결과로 판단한다.
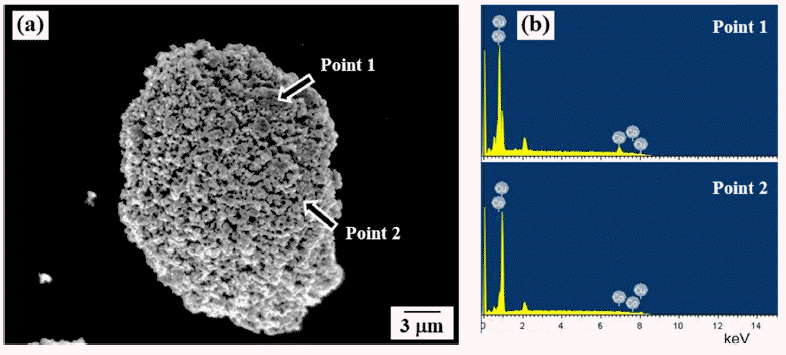
CuO-Co3O4 혼합분말을 500°C에서 2시간 동안 환원한 후 분석한 SEM-EDX 결과를 그림8에 나타내었다. 환원분 말은 전체적으로 미세한 Cu와 Co 입자가 균일하게 분포 된 응집체를 형성하고 있으며, EDX를 이용한 분석결과 위치에 따라 Co의 양이 약 14.8~68.4 at%로 측정되어 고 용체 보다는 복합상의 형태로 존재하는 것으로 판단된다. 그러나 합성된 입자가 나노크기임을 고려할 때 준안정상 의 과포화 고용체가 형성될 수 있으며 이에 대한 후속연 구가 요구된다.
4. 결 론
균일한 Cu-Co 계 복합분말을 제조하고자 볼 밀링한 CuO와 Co3O4 분말을 수소분위기에서 환원하는 공정을 적 용하였으며, 환원거동의 정량적인 해석을 위해 TPR을 이 용한 분석을 실시하였다. Ar-10% H2 혼합가스 분위기에 서의 볼 밀링한 혼합분말에 대한 환원거동 분석 결과 2개 의 반응 피크가 존재함을 확인하였으며, Co3O4의 환원과 관련된 두번째 피크는 저온에서 환원된 Cu 입자의 영향에 의해 상대적으로 낮은 온도에서 관찰됨을 확인하였다. 승 온속도가 증가함에 따라 반응 피크는 고온으로 이동하였 으며 이러한 관계로부터 Kissinger 식을 이용하여 활성화 에너지를 계산하였다. 2개의 반응피크에 대한 활성화 에 너지는 각각 58.1 kJ/mol과 65.8 kJ/mol로 측정되었으며, 기존에 보고된 활성화에너지 값과 비교하여 환원거동을 해석하였다. 500°C에서 2시간 동안 환원한 CuO-Co3O4 혼 합분말은 미세한 Cu와 Co 입자가 균일하게 분포된 혼합 상을 나타내며 응집체 형태로 존재하였다.
감사의 글
이 연구는 서울과학기술대학교 교내연구비의 지원으로 수행되었습니다.