MgB4와 Mg 분말을 원료로 사용하여 고상반응법으로 제조한 MgB2 초전도체의 상생성과 초전도 특성
Superconducting Properties and Phase Formation of MgB2 Superconductors Prepared by the Solid State Reaction Method using MgB4 and Mg Powder
Article information
Abstract
MgB2 bulk superconductors are synthesized by the solid state reaction of (MgB4+xMg) precursors with excessive Mg compositions (x=1.0, 1.4, 2.0 and 2.4). The MgB4 precursors are synthesized using (Mg+B) powders. The secondary phases (MgB4 and MgO) present in the synthesized MgB4 are removed by HNO3 leaching. It is found that the formation reaction of MgB2 is accelerated when Mg excessive compositions are used. The magnetization curves of Mg1+xB2 samples show that the transition from the normal state to the superconducting state of the Mg excessive samples with x=0.5 and x=0.7 are sharper than that of MgB2. The highest Jc-B curve at 5 K and 20 K is achieved for x=0.5. Further addition of Mg decreases the Jc owing to the formation of more pores in the MgB2 matrix and smaller volume fraction of MgB2.
1 서 론
2001년 Nagamatsu와 Akimitsu에 의해 발견된 MgB2 초 전도체는 금속간 화합물계로 초전도임계온도(Tc)가 39 K 으로 매우 높다[1]. 이 재료의 상부임계자장한계(Hc2)는 33 Tesla (T)이며 코팅된 섬유(fiber)의 경우 55 T에 달한다 [2]. 또한 전류 이방성이 크지 않고, 전자가 쌍을 이루는 거리인 결맞음 길이(coherence length)가 길다[3]. 고온초 전도체와는 달리 결정립계가 자속고정점으로 작용하기 때 문에 분말합성법으로 제조가 가능하다[4]. 이러한 이유로 MgB2는 NbTi을 대체할 재료로 주목 받고 있다.
MgB2가 많은 장점을 가지고 있지만, 임계전류밀도(Jc)는 4.2 K, 0 T에서 약 106 A/cm2으로 실용화 수준에 미치지 못한다[5]. 이를 해결하고자 MgB2의 Jc를 향상시키기 위 한 연구가 다양한 방법에 의해 시도되어왔다[6-13]. MgB2 의 Jc를 향상시키기는 대표적인 방법은 재료의 미세조직 을 제어하여 자기 플럭스(magnetic flux)를 고정시키는 자 속고정점(flux pinning site)을 만드는 것이다. 자속고정점 은 열처리조건이나 원료입자의 크기를 조절하여 다수의 결정입계를 형성하거나[6-7] 입자 내에 불순물을 첨가하는 방법으로 만들 수 있다[8-13]. 그 중 탄소나[12] 탄화 화합 물을[13] 첨가할 경우 MgB2의 Jc가 크게 향상되는 것으로 보고되었다.
J c를 향상시키는 다른 방법으로는 MgB2의 소결 밀도를 증가시키는 방법이 있다. 소결밀도가 증가할 경우 전기를 흘릴 수 있는 유효단면적이 증가하고, 이에 의해 통전전류 가 증가한다. 분말합성법으로 제조된 MgB2에는 기공이 다수 포함되는데[14], 이는 주로 원료로 사용한 Mg에 의 해 형성된다. Mg과 B을 원료로 사용하는 in-situ 공정을 예로 들면, Mg이 B보다 용융온도가 매우 낮기 때문에 열 처리시에 Mg이 녹거나 고상확산에 의해 빠른 속도로 이 동하여 본래 성형체보다 부피가 크고 기공률이 높은 조직 을 형성한다[15]. 따라서 Mg의 사용량을 줄이면 그만큼 기공의 수가 감소한다. 이렇게 기공이 적은 조직이 형성되 면 초전도 특성뿐 아니라 선재로 가공할 경우 기계적 특 성도 향상시킬 수 있을 것으로 예상된다. 최근에는 (Mg+B) 대신 Mg 사용량을 줄일 수 있는 (MgB4+Mg) 혼 합 분말을 원료로 사용하여 고상반응법으로 MgB2를 합성 하는 다수의 연구가 진행되었다[16-20].
본 연구에서는 MgB2의 밀도를 높이고 초전도 특성을 향상시키고자 (MgB4+Mg) 전구체를 사용하여 MgB2를 합 성하였다. MgB4 전구체는 (Mg+B)의 고상반응법으로 제 조하였다. 합성한 MgB2초전도체의 상 형성과 관련된 미 세조직, 초전도 전이온도와 임계전류를 조사하였다.
2 실험방법
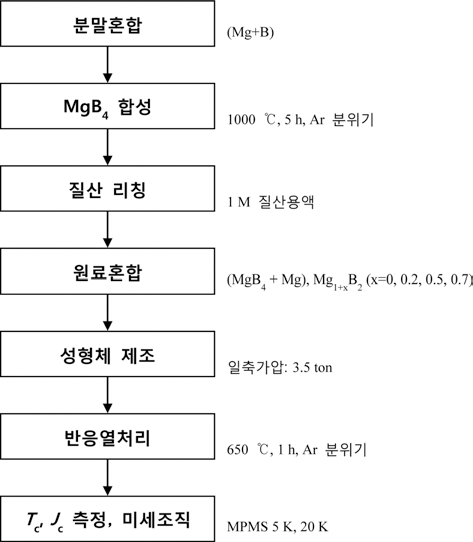
MgB4 및 MgB2 합성 실험은 그림 1의 공정도에 따라 진 행하였다. MgB4의 합성에는 구형 Mg 분말(99%, 4-6 μm, Tangshan, China)과 판형 B 분말(95-97%, ~1 μm, Tangshan, China)을 사용하였다. Mg분말과 B분말을 1:4의 몰 비율로 칭량하여 막자사발에서 핸드믹싱으로 30분 동안 혼합한 다음, 직경 20 mm의 원형 몰드에 2 그램(gr)을 넣고 프레 스를 이용하여 5 톤의 하중으로 일축가압 하여 디스크형 분말성형체를 제조하였다. 분말성형체의 열처리과정 중 산화를 막기 위해 성형체를 티타늄(Ti) 튜브에 봉입하여 관상 열처리로의 중앙에 위치시킨 후 알곤 가스 분위기에 서 1000°C로 5 시간 동안 열처리하였다. 열처리 후 티타 늄 튜브에서 MgB4 성형체를 분리한 후 성형체를 막자사 발에서 분쇄하여 분말로 만들었다. 100% MgB4 전구체 분 말을 얻기 위해 분말 3 그램을 1 M 농도의 100 ml 질산 용액에 넣어 적당시간 유지하여 MgO와 MgB2를 제거한 후(두 물질은 질산에 쉽게 용해됨) 감압여과장치를 이용하 여 MgB4를 걸러내는 리칭(leaching) 과정을 수행하였다. 리칭 후 분말에 잔류하는 질산을 제거하기 위해 MgB4 분 말을 에탄올로 세척하고 다시 감압 여과하는 과정을 두 번 실행하였다. 세척이 끝난 후 진공오븐으로 80°C에서 2 시간 동안 건조하여 유기용매를 제거하였다.
MgB2 초전도체의 합성을 위해 MgB4와 Mg을 막자사발 에서 약 30분간 혼합하였다. 준비된 분말을 지름 10 mm 의 원형 몰드에 0.3 그램 넣어 유압식프레스를 이용하여 3.5 톤의 하중으로 일축 가압하여 성형체를 제조하였다. 열처리 중 Mg의 산화를 최소화하기 위하여 성형체를 티 타늄 튜브에 넣어 봉입하였다. 준비된 팰렛을 관상로 중앙 에 위치시킨 후, 적절한 열처리 온도조건을 찾기 위해 650°C부터 1050°C까지 100°C 간격으로 온도를 달리하여 알곤 가스분위기에서 1 시간 동안 열처리하였다. 또한 열 처리 온도를 다르게 하여 실험한 결과 중 MgB2의 상분율 이 가장 높게 형성된 온도조건으로 MgB4:Mg 혼합비율을 1:1.0, 1:1.4, 1:2.0, 1:2.4의 몰 비로 달리하여 열처리하였다. Mg을 초과로 첨가하는 이유는 반응열처리 중에 Mg의 기 화나 산화로 인한 Mg 부족을 보충하기 위해서이다[16].
열처리 후 팰렛을 티타늄 튜브에서 분리하고 분말형태 로 만들어 X-선 회절법으로 생성된 상을 분석하였다. 시 편에 형성된 기공을 관찰하고자 에폭시(epoxy)로 마운팅 한 시료를 미세연마하고 단면에 대해 주사전자현미경 (Scanning Electron Microscopy, SEM) 검사를 실시하였다. Tc 와 Jc는 비접촉 자기 측정장치인 MPMS(Magnetic Property Measurement System, Quantum Design)로 측정하였다. 각 시편에 대해 온도-자화율 곡선을 측정하여 Tc를 구하였고, 5 K와 20 K의 온도에서 자장을 5.5 T까지 증가시켜 얻은 M-H 곡선을 Bean model[21]을 이용하여 자장에 대한 Jc 값을 계산하였다.
3 결과 및 고찰
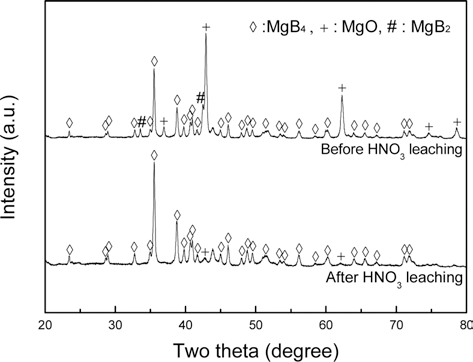
그림 2는 합성된 MgB4 전구체 분말의 질산 리칭 전과 후의 주사전자현미경 사진이다. 그림 2(a)는 질산 리칭 전 의 MgB4 분말로 그 크기가 수십 nm~수 μm인 크기편차 가 크고 형태가 일정하지 않지만, 그림 2(b)와 같이 질산 리칭 후에는 감압여과과정에서 작은 입자들이 질산에 녹 아 분해되고 수 μm의 평균직경을 보이는 불규칙한 형태 의 분말이 남게 된다. 분말의 표면에는 질산 리칭 과정에 서 불순물이 제거될 때 형성된 것으로 추정되는 그물망 형태의 구조가 관찰된다. 분말 시료에 대해 X-선 회절분 석(X-Ray Diffractometer, XRD)을 수행하였으며, 그림 3과 같이 질산 리칭 전 Mg과 B의 반응으로 MgB4가 생성되면 서 MgO와 MgB2도 함께 생성됨을 알 수 있었다. MgB4 상 보다 MgO 상이 더 많이 형성된 이유는 순도가 낮은 B 원료에 불순물로 포함되어있던 B2O3의 산소나 성형체를 만드는 과정에서 분말에 흡착된 산소 등이 융점이 낮고 산화성이 큰 Mg과 고온 열처리 중에 반응하여 형성되었 기 때문으로 추정된다. MgO가 다량 포함된 분말을 원료 로 사용할 경우 합성한 MgB2에도 MgO가 포함되어 초전 도 특성이 저하된다[17]. MgO의 생성을 억제하기 위해 Mg과 B 원료분말을 도가니에 넣고 용접을 통해 밀봉하여 열처리하거나[18] Mg 보다 안정한 원료인 MgB2를 전구 체로 하여 MgB4를 생성하는[19] 방법이 연구된바 있으나 , 전자의 방법은 실험방법이 어렵고 후자의 방법은 얻은 분말의 순도가 좋지 않은 문제가 있다. 따라서 본 연구에 서는 질산 리칭을 통해 불순물을 제거하였다[20]. 그림 3 의 리칭 후 XRD 결과를 보면 소량의 MgO만 관찰되고, MgB2 회절선이 관찰되지 않는다. 질산 리칭에 의해 MgB4 분말은 소실되지 않았는데, 이는 MgB4가 MgB2나 Mg, B 등에 비해 화학적으로 안정하기 때문이다.
그림 4는 MgB4와 Mg을 전구체로 하여 서로 다른 열처 리 온도로 합성한 MgB2의 XRD 결과이다. 950°C와 1050°C의 고온에서 열처리한 경우 MgB2의 합성이 잘 이 루어지지 않아 MgB4와 MgO가 주회절선으로 관찰된다. 이는 850°C 이상의 온도에서 MgB2가 MgB4와 Mg로 분해 되는 반응이 시작되기 때문에 MgB4가 Mg와 합성되는 반 응이 억제되기 때문이다[22]. 650°C에서 850°C까지의 온 도로 열처리한 경우 MgB2가 합성되었으며 열처리 온도에 따른 형성된 상의 차이는 크지 않았다.
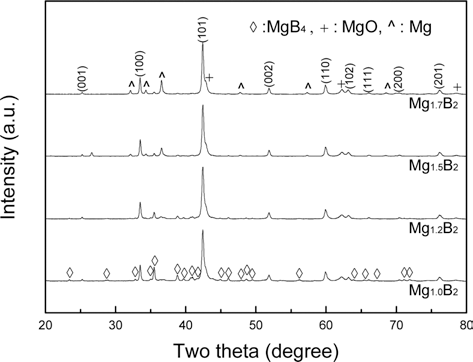
그림 5는 Mg 조성을 달리하여 650°C, 1시간 열처리를 통해 합성한 Mg1+xB2 (x=0, 0.2, 0.5, 0.7)의 XRD 결과이다. 열처리 온도는 공정상의 효율성을 고려하여 MgB2가 합성 되는 온도 중 가장 낮은 온도를 선택하였다. 모든 결과의 주 회절선은 MgB2였고, MgO와 잔류 MgB4 회절선이 관 찰된다. Mg의 조성을 증가시킨 결과 열처리 중 산화에 의 해 손실되는 Mg을 보충해주어 MgB4가 MgB2로 전환되므 로 잔류 MgB4 상이 감소하였다[16]. Mg1.5B2의 결과에서 대부분의 MgB4가 MgB2로 전환되었지만 소량의 MgB4가 잔류하는데, 이는 열처리 시간이 Mg이 확산하여 MgB4와 반응하기에 충분하지 않았기 때문이다.
그림 6은 MgB4와 Mg을 전구체로 사용하여 제조한 (a) Mg1.0B2와 (b) Mg1.7B2의 단면 SEM 미세조직 사진이다. 그림에서 보는 것처럼 두 시편 모두 구형의 기공을 포함 한다. 이 기공들은 원료로 사용된 Mg 분말의 확산에 의해 형성되는 것으로 알려져 있다[15]. Mg이 초과로 첨가된 조성인 Mg1.7B2에서 형성된 기공 수가 Mg1.0B2 조성의 기 공 수에 비해 현저히 높다. MgB4와 반응하는 Mg의 양이 증가하면 식 (1)에서와 같이 기공을 형성하는 Mg의 양이 x만큼 증가하기 때문에 시편에 포함되는 기공의 양도 증 가한다.
(MgB4+Mg)를 전구체로 사용할 때 필요한 Mg의 양은 (Mg+B)를 전구체로 사용할 때 필요한 Mg의 1/2이 된다. 따라서 (MgB4+Mg)를 전구체로 사용하면(Mg+B)를 전구 체로 사용한 때에 비해 기공량이 1/2이 된다.
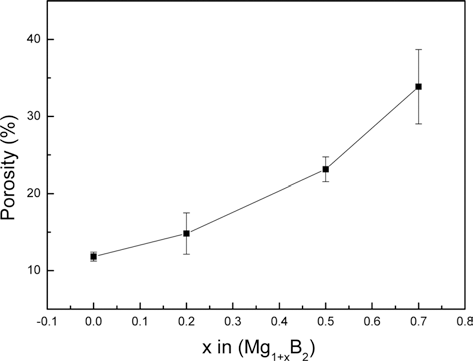
그림 7은(MgB4+Mg)를 전구체로 사용하여 제조한 Mg1+xB2 시편의 초과 Mg량에 따른 시편 단면에 포함된 기공량을 나타낸다. X=0의 경우 기공의 부피분율은 12% 이고 x값이 증가할수록 기공의 양도 증가하여 x=0.5와 x=0.7에서의 기공 부피는 각각 23%와 33% 이다.
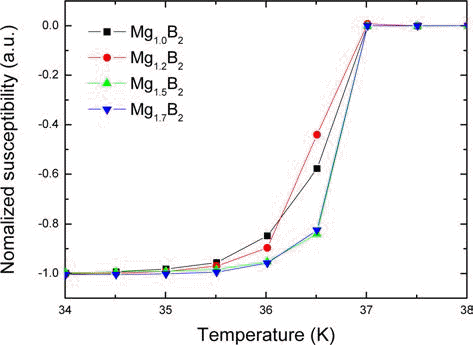
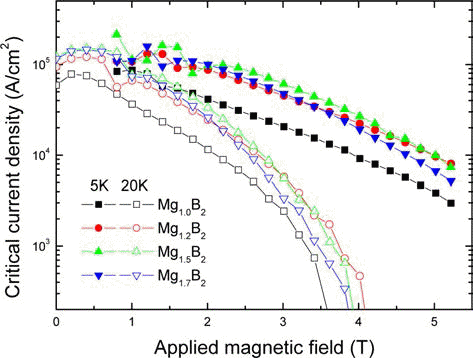
그림 8은 Mg의 조성을 달리하여 (MgB4+Mg) 전구체를 사용하여 제조한 Mg1+xB2의 온도에 대한 자화 특성 곡선 이다. Tc 결과를 보면 Mg의 조성에 따른 Tc, onset 값은 거의 차이 없이 약 37 K로 일정하다. x=0.5와 x=0.7 시편의 천 이가 x=0과 x=0.2 시편보다 가파른데, 이는 Mg의 초과로 인해 생성되는 MgB2의 양이 증가하였기 때문으로 여겨진 다. 그림 9는 Mg1+xB2의 자기장에 대한 임계전류밀도 (Jc- B) 곡선이다. 5 K와 20 K 온도 모두에서 Mg이 초과된 조 성의 Jc가 Mg1.0B2 보다 높다. x=0.5 조성에서 Jc가 가장 높은데, 5 K와 20 K 2 T에서의 Jc가 각각 9.64 × 104 A/ cm2와 3.34 × 104 A/cm2로 동일측정 조건의 x=0의 Jc 값인 4.12 × 104 A/cm2와 1.15 × 104 A/cm2와 비교된다. 기존에 보고된 유사한 조건의 실험 결과에서는, 같은 온도조건으 로 열처리한 경우 Mg의 조성이 증가할수록 Jc가 증가하여 x=0.7 조성에서 가장 높은 특성을 보였다[16]. 반면 본 연 구에서 x=0.2 조성과 x=0.5 조성의 상대적으로 적은 Mg 조성에서 높은 Jc 갚을 보인다. Mg 조성이 높으면 기공의 수가 증가하여 소결 후 밀도가 낮아지게 되므로 낮은 Mg 조성에서 MgB2의 특성이 향상되어야 한다.
4 결 론
(MgB4+Mg)의 전구체를 사용하여 합성한 MgB2초전도 체에 대해 반응열처리시의 생성상, MgB2 초전도체내의 기공분포, 초전도임계온도와 임계전류밀도를 조사하였다. MgB4 전구체는 Mg과 B의 고상반응법으로 합성하였으며, 합성 시 동시에 생성되는 MgO와 MgB2는 질산으로 리칭 하여 제거하였다. MgB4와 Mg의 반응공정을 이해하고 Jc 를 높이고자 Mg의 조성을 변화시킨 결과, Mg1.5B2에서 가 장 높은 Jc를 얻을 수 있었다. 초전도 개시온도는 Mg 조 성에 크게 영향을 받지 않았지만 정상상태에서 초전도 상 태로의 전위는 Mg 초과 조성에서 급격했다. 이는 Mg을 초과로 첨가할 경우 MgB4와 Mg의 반응이 활성화되어 초 전도상인 MgB2의 생성량이 증가하였기 때문으로 여겨진 다. Mg이 과도하게 첨가되면 (Mg1.7B2), MgB2내에 생성되 는 기공이 많아져 Jc가 감소하였다.
Acknowledgements
이 논문은 미래창조과학부의 재원으로 한국연구재단의 지원을 받아 수행되었습니다(NRF-2013M2A8A1035822).