열처리 분위기가 TiH2-MoO3 혼합분말의 미세조직 특성에 미치는 영향
Effect of Heat Treatment Atmosphere on the Microstructure of TiH2-MoO3 Powder Mixtures
Article information
Abstract
An optimum route to synthesize Ti-Mo system powders is investigated by analyzing the effect of the heat treatment atmosphere on the formation of the reaction phase by dehydrogenation and hydrogen reduction of ball-milled TiH2-MoO3 powder mixtures. Homogeneous powder mixtures with refined particles are prepared by ball milling for 24 h. XRD analysis of the heat-treated powder in a hydrogen atmosphere shows TiH2 and MoO3 peaks in the initial powders as well as the peaks corresponding to the reaction phase species, such as TiH0.7, TiO, MoO2, Mo. In contrast, powder mixtures heated in an argon atmosphere are composed of Ti, TiO, Mo and MoO3 phases. The formation of reaction phases dependent on the atmosphere is explained by the partial pressure of H2 and the reaction temperature, based on thermodynamic considerations for the dehydrogenation reaction of TiH2 and the reduction behavior of MoO3.
1. 서 론
Ti 및 Ti 합금은 상대적으로 낮은 밀도와 함께 고강도, 내부식성 및 우수한 생체적합성을 갖고 있기 때문에 구조 용 뿐만 아니라 생체용 재료로도 많은 관심의 대상이 되 고 있다[1-3]. 대표적으로 Ti-6Al-4V 합금은 치과 및 정형 외과 분야의 생체재료로 응용되고 있으나 stress shielding effect에 의한 골 결손 및 생물학적 안정성 등의 문제가 있 어, 낮은 탄성계수 및 비독성을 갖는 Ti-Mo, Ti-W 및 Ti- Nb-Ta-Zr 합금 계를 적용하고자 하는 연구가 진행되고 있 다[4,5]. 그러나 일반적인 주조공정을 적용하여 Ti-Mo 등 의 합금을 제조할 경우에는 Ti과 Mo간의 커다란 밀도 및 융점차이와 함께 산화문제 등으로 균일한 미세조직 제어 에 어려움이 있다[6].
Ti-Mo 계 재료를 제조하는 다른 방법으로는 Ti 및 Mo 원료분말의 성형과 소결을 이용하는 분말야금 공정이 있 으며, 본 연구에서는 TiH2 및 MoO3를 원료분말로 사용하 여 가열 중의 분해반응으로 미세조직 특성이 제어된 Ti- Mo 계 분말의 제조 가능성을 조사하고자 하였다. TiH2 분 말은 고온에서의 탈수소 반응에 의해 Ti와 H2로 분해되어 Ti의 산화를 억제할 수 있으며[7], MoO3 분말은 볼 밀링 및 수소환원 공정을 거쳐 나노크기의 Mo 입자를 제조할 수 있는 장점이 있다[8]. 따라서 미세조직이 제어된 Ti-Mo 계 합금분말의 제조를 위해서는 TiH2 및 MoO3 혼합분말의 열처리 조건에 따른 반응상 형성거동의 해석이 요구된다. 본 연구에서는 열처리 분위기를 수소 및 아르곤으로 선택 하여 혼합분말의 분해반응과 상 형성에 미치는 영향을 해 석하여 Ti-Mo 분말제조를 위한 최적의 조건을 제시하고자 하였다.
2. 실험 방법
본 연구에서는 순도 99%, 입자크기 1~3 μm의 TiH2 (Alfa Aesar, USA)와 순도 99.9%, 입자크기 10 μm의 MoO3 (Kojundo Chemical Lab., Co., Japan)를 원료분말로 사용하 였다. 최종조성이 Ti-10 wt% Mo가 되도록 원료분말을 칭 량한 후 3차원 혼합기를 이용하여 1시간동안 예비 혼합하 였다. 계속해서 수평식 회전형 밀을 이용하여 직경 3 mm 의 ZrO2 볼과 함께 ethanol 용액 내에서 24시간 동안 밀링 하였으며, 볼과 분말의 무게비는 15:1로 하였다.
원료 및 혼합분말의 입도는 레이저입도분석기(LS I3 320, Beckman Counter, USA)를 이용하여 측정하였으며, 열처리에 따른 혼합분말의 반응 거동은 DTA(DTG-60, Shimadzu, Japan)를 이용하여 Ar 분위기에서 10°C/min의 승온속도로 900°C까지 가열하며 분석하였다. 혼합분말의 환원 및 탈수소 반응을 위한 열처리는 600°C에서 1시간 동안 수소 또는 아르곤 분위기에서 실시하였다. 열처리에 따른 혼합분말의 상변화는 XRD(D/Max-IIIC, Rigaku Denki, Co., Japan)를 이용하여 분석하였고 미세조직은 SEM(JSM- 6700F, JEOL Co., Japan)으로 관찰하였다.
3. 실험결과 및 고찰
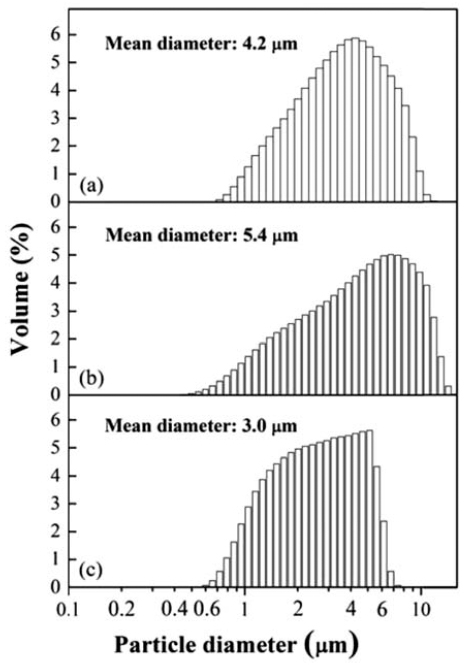
원료분말인 TiH2와 MoO3 및 고순도 ZrO2 볼을 이용하 여 밀링한 혼합분말의 미세조직사진을 그림 1에 나타내었 다. 각진 형태의 TiH2와 판상의 MoO3 분말은 그림 1(c)와 같이 24시간의 볼 밀링을 통하여 전체적으로 판상 형의 분말이 분쇄된 균일한 형태의 혼합분말로 존재함을 알 수 있다. 그림 2는 원료분말과 볼 밀링한 혼합분말의 입도를 분석한 결과로서, TiH2와 MoO3 원료분말의 크기가 각각 4.2 μm와 5.4 μm에서 볼 밀링 후의 혼합분말은 3 μm로 평 균크기가 감소함을 보여준다.
순수한 TiH2 및 TiH2-MoO3 혼합분말의 열분해 거동을 DTA로 분석한 결과를 그림 3에 나타내었다. 순수한 TiH2 의 경우(그림 3(a)), 약 450°C와 600°C에서 발열피크가 관 찰되며 이는 Ti와 H2로의 단계적인 분해에 기인한 것으로 기존에 보고된 연구결과와 잘 일치한다[9,10]. 한편, 그림 3(b)와 같이 혼합분말의 경우에는 발열피크가 나타나는 온 도가 각각 300°C, 600°C 및 655°C로 변화하는데, 이는 우 선적으로 MoO3의 영향으로 해석할 수 있으며, 정확한 반 응거동의 해석을 위해 열처리한 분말에 대한 XRD분석을 실시하였다.
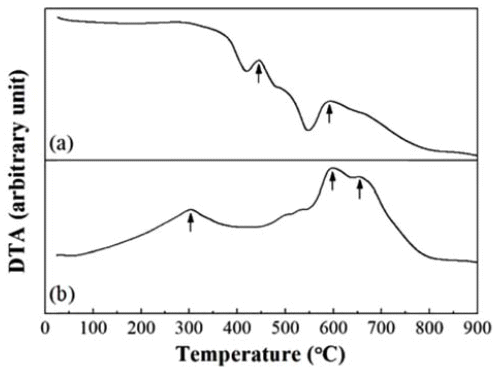
DTA curves for (a) TiH2 and (b) TiH2-MoO3 powders obtained at a scanning rate of 10°C/min in Ar atmosphere.
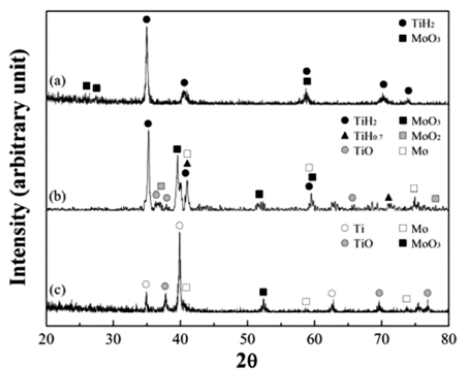
그림 4는 볼 밀링한 혼합분말과 600°C에서 1시간 동안 각각 수소 및 아르곤 분위기에서 열처리한 분말의 XRD 분석결과를 나타낸 것이다. 그림 4(a)와 같이 초기에 TiH2 와 MoO3 상으로만 존재했던 혼합분말은 열처리를 통하여 다양한 상으로 변환된다. 그림 4(b)는 수소분위기에서 열 처리한 경우로, 원료분말인 TiH2와 MoO3 상과 함께 TiH0.7, TiO, MoO2, Mo 등의 반응상이 형성됨을 알 수 있 다. 그러나 혼합분말을 아르곤 분위기에서 열처리한 경우 는(그림 4(c)) 원료분말인 TiH2 상은 존재하지 않고 Ti, TiO, Mo 및 일부 MoO3 상으로 존재함을 알 수 있다. 이 러한 차이를 분석하고자 각각 수소 및 아르곤 분위기에서 열처리한 혼합분말을 SEM으로 분석하여 그림 5(a)와 (b) 에 나타내었으며 열처리 분위기에 따른 분말 형상 등의 뚜렷한 변화는 관찰되지 않았다.
그림 4의 XRD 분석결과와 같이 열처리 분위기에 따라 상이한 반응상이 존재하는 이유는 TiH2의 분해와 MoO3의 환원조건을 열역학적으로 고려하여 해석할 수 있다. 고체 TiH2의 탈수소에 의한 고체 Ti와 기체 H2 형성반응(TiH2(s) →Ti(s)+H2(g))의 자유에너지 변화는 아래와 같이 나타낼 수 있다.
기존에 보고된 TiH2의 탈수소 반응에 대한 열역학 자료 를 고려하면[11,12] 온도와 수소분압에 따른 자유에너지 변화를 계산할 수 있으며 그 결과를 그림 6에 나타내었다.
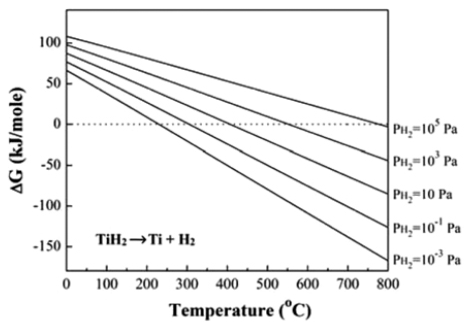
Free energy changes for the dehydrogenation of TiH2 at various temperatures and partial pressure of H2.
그림 6에서 보여주듯이 수소 분압이 10-3 Pa부터 1기압 (약 105 Pa)까지 증가할 때 탈수소 반응이 가능한 온도는 약 225°C에서 876°C로 증가한다. 따라서 본 실험조건인 1 기압의 수소분위기로 600°C에서 열처리할 경우 TiH2의 분 해 반응이 일어날 수 없음을 알 수 있다. 이러한 열역학적 해석을 고려하면, 그림 4(b)의 XRD결과에서 TiH2가 주 피 크로 존재하는 이유를 설명할 수 있다. 한편 기존에 보고 된 바와 같이 TiH2는 일부 분해반응과 MoO3에 의한 산화 반응이 가능하여[13,14], 본 연구의 XRD결과와 같이 TiH1.7 및 TiO 상이 형성된 것으로 해석된다. 한편, 수소분위기에 서 열처리를 하였음에도 혼합분말에서는 일부 Mo과 MoO3 및 MoO2 상의 산화물이 존재한다. 일반적으로 MoO3는 약 520°C 부터 수소환원 반응이 단계적으로 발생하여 최종적 으로 약 700°C에서 반응이 완료되어 Mo로 형성됨을 고려 할 때[8,15], 일부 Mo상 이외에 산화물상의 존재는 낮은 수 소환원 온도에 기인한 것으로 해석할 수 있다.
혼합분말을 아르곤 분위기에서 열처리한 경우는(그림 4(c)), TiH2의 분해반응이 가능하게 되어 최종적으로 순수 한 Ti 및 산화물 상인 TiO로 존재하며, MoO3의 경우에는 탈수소 반응에 의한 H2의 영향으로 일부 MoO3가 환원되 어 Mo로 존재함을 알 수 있다. 따라서 이러한 연구결과는 TiH2와 MoO3의 분해반응을 이용한 Ti와 Mo상 분말합성 에 관한 기초자료로의 중요한 의미를 가지며, 향후 순수한 Ti 및 Mo 상의 형성 및 합금화를 위해서는 상대적으로 고 온에서의 열처리 및 수소 분압 등의 제어를 위한 추가적 인 연구가 요구된다.
4. 결 론
본 연구에서는 TiH2-MoO3 혼합분말의 열처리 분위기에 따른 분해반응 거동을 분석하여 공정조건이 반응상 형성 거동에 미치는 영향을 분석하였다. 원료분말을 혼합하여 24시간 동안 볼 밀링할 경우 미세하게 분쇄된 균일 혼합 분말의 형태로 존재함을 확인하였다. 볼 밀링한 혼합분말 을 수소분위기에서 열처리하여 XRD로 분석한 결과, 원료 분말인 TiH2와 MoO3 상과 함께 TiH0.7, TiO, MoO2, Mo 등의 반응상이 형성됨을 확인하였다. 그러나 아르곤 분위 기에서 열처리한 경우는 원료분말인 TiH2 상은 존재하지 않고 Ti, TiO, Mo 및 일부 MoO3 상으로 존재하였다. 열 처리 분위기에 따른 반응상의 형성은 TiH2의 탈수소 반응에 대한 열역학적 고찰과 MoO3의 수소환원 거동으로부터, 열 처리 분위기 중의 수소 분압 및 환원 온도에 의존하는 것 으로 해석하였다. 이러한 연구결과는 TiH2와 MoO3의 분 해반응을 이용한 Ti와 Mo상 분말합성에 관한 기초자료로 의 중요한 의미를 가지며, 순수한 Ti 및 Mo 상의 형성 및 합금화를 위해서는 상대적으로 고온에서의 열처리 및 수 소 분압의 제어가 필요함을 확인하였다.
감사의 글
이 연구는 서울과학기술대학교 교내연구비의 지원으로 수행되었습니다.