타이타늄 합금 분말의 열적산화를 통한 TiO2 나노와이어의 합성
Synthesis of TiO2 Nanowires by Thermal Oxidation of Titanium Alloy Powder
Article information
Abstract
One-dimensional rutile TiO2 is an important inorganic compound with applicability in sensors, solar cells, and Li-based batteries. However, conventional synthesis methods for TiO2 nanowires are complicated and entail risks of environmental contamination. In this work, we report the growth of TiO2 nanowires on a Ti alloy powder (Ti-6wt%Al-4wt%V, Ti64) using simple thermal oxidation under a limited supply of O2. The optimum condition for TiO2 nanowire synthesis is studied for variables including temperature, time, and pressure. TiO2 nanowires of ~5 μm in length and 100 nm in thickness are richly synthesized under the optimum condition with single-crystalline rutile phases. The formation of TiO2 nanowires is greatly influenced by synthesis temperature and pressure. The synthesized TiO2 nanowires are characterized using field-emission scanning electron microscopy (FE-SEM), X-ray diffraction (XRD), and high-resolution transmission electron microscopy (HR-TEM).
1. 서 론
일차원 나노구조를 가지는 TiO2는 전기적·광학적 특성 과 화학적 안정성이 매우 높을 뿐만 아니라 넓은 비표면 적, 양자구속효과 그리고 무독성이며 살균 특성을 가지기 때문에 여러 응용분야에서 기능소재로의 적용 가능성이 제기되어 왔다[1, 2]. 지금까지 일차원 나노구조를 가지는 TiO2는 양극산화법(anodic oxidation)[3, 4], 졸-겔법(sol-gel) [5], 화학기상증착법(chemical vapor deposition)[6], 수열합성 법(hydrothermal)[7, 8], 전기방사법(electrospinning)[9, 10], 리 소그래피법(lithography)[11] 그리고 열적산화법(thermal oxidation)[12] 등으로 제조 및 연구되어 왔다. 이러한 방법 들로 제조된 TiO2는 비정질(amorphous)이거나 아나타제 (anatase)상 혹은 루타일(rutile)상의 결정구조를 가지는데 열적산화법을 제외한 나머지 방법들로 제조된 TiO2는 주 로 비정질이거나 아나타제상의 결정구조를 가지는 것으로 보고되고 있다.
지금까지는 주로 아나타제상을 갖는 TiO2에 대해서 많 은 합성 및 응용연구가 있었는데 그 이유는 많은 연구결 과에서 루타일상보다는 아나타제상을 갖는 TiO2가 더 많 은 응용 가능성을 보였기 때문이며 일차원 나노구조를 갖 는 루타일상의 TiO2 합성에 대한 연구가 활성화 되지 않 고 특정 연구그룹[12]에 국한된 것도 같은 맥락이라고 볼 수 있다. 하지만 앞에서 제시된 방법들 중에서 열적산화법 을 제외한 아나타제상이 얻어지는 대부분의 방법들은 공 정제어가 어렵거나 복잡하고 환경 오염의 문제점을 가지 고 있으며 특히 생산량을 높이는데 한계가 있다는 큰 단 점을 가지고 있다. 이에 반해 일차원 나노구조를 갖는 루 타일상의 TiO2가 얻어지는 열적산화법은 그 제조 공정이 매우 단순하여 저비용으로 대량생산이 가능하다는 큰 장 점을 가지고 있으며, 또한 나노구조를 갖는 루타일상의 TiO2가 염료감응태양전지[13-15], 화학센서[16], 광촉매 [17, 18] 그리고 리튬이차전지[19, 20] 등의 분야에서 응용 가능성을 보이는 연구결과가 도출되고 있기 때문에 아나 타제상보다는 루타일상의 TiO2가 상용화 측면에서는 가능 성이 더 높다고 할 수 있다. 즉, 일차원 나노구조를 갖는 루타일상의 TiO2에 대해 더 많은 합성 및 응용에 대한 연 구가 필요한 실정이다.
따라서 본 연구에서는 상용화되어 판매되고 있는 Ti64 금속분말과 열적산화(thermal oxidation)처리를 이용하여 결정성이 뛰어난 루타일상의 TiO2 나노와이어를 합성하고 자 하였고, 온도와 시간 그리고 압력을 주요변수로 하여 최적의 합성 조건과 성장 거동을 알아 보고자 하였다.
2. 실험 방법
TiO2 나노와이어의 합성을 위해 500 mesh(25 um 이하) 의 체로 걸러 낸 Ti64 금속분말(Ti-6wt%Al-4wt%V)을 사 용하였다. 본 연구결과에는 나타내지 않았으나 순수 Ti분 말이나 크기가 비교적 큰 분말을 사용했을 경우에는 TiO2 나노와이어의 생성량이 비교적 적었기 때문에 비교적 작 은 크기의 Ti64분말을 사용하였다. 준비된 1 g의 Ti64분말 을 알루미나 용기에 넣은 후 수평식 전기저항 관상로의 중앙에 위치시키고 투입구를 닫아 밀폐시킨 후 아르곤과 산소의 혼합가스 주입과 관상로 내부의 압력조절을 위해 진공펌프 가동을 실시하였다. 본 연구에서 사용한 관상로 는 한쪽은 가스유량제어장치(mass flow control, MFC)가 구성되어 있어 가스의 주입량을 조절할 수 있고 다른 한 쪽은 진공펌프를 포함하여 압력조절 장치로 구성되어 있 어 내부의 압력 조절이 가능하게 구성된 장치이다. 이들 장치를 통해 열적산화반응이 일어나는 동안 관상로 내·외 부를 최대한 차단하고자 하였으며 또한 관상로 내부의 압 력을 조절하여 압력 변화에 따른 나노와이어의 성장 거동 을 관찰하고자 하였다. Ti64분말을 관상로에 장입 후 투입 구를 닫아 밀폐시킨 후 로터리 펌프의 가동과 아르곤 가 스의 주입을 3차례 교대로 실시하여 최대한 산소를 제거 한 후 실험하고자 하는 4가지 압력(760, 750, 500 그리고 250 Torr)으로 제어하였다. 앞에서 언급한 바와 같이 관상 로의 한쪽에서는 가스유량조절장치를 이용하여 20 ppm의 산소(99.99%)가 포함된 아르곤 가스(99.99%)를 500 mL/ min로 주입하고 다른 한쪽에서는 압력조절장치를 이용해 목적으로 하는 압력을 유지하였다. 즉, 최대한 산소의 량 은 동일하게 유지하면서 열적산화반응이 일어나는 반응로 의 압력만 달리하여 TiO2 나노와이어의 성장거동을 관찰 하고자 하였다. 기존 문헌[12]에서 20 ppm 정도의 산소를 주입하였을 경우 나노와이어가 잘 합성된다는 보고가 있 었기 때문에 산소의 함량은 변수로 두지 않고 20 ppm으로 고정하였다. 특정 압력이 유지된 상태에서 관상로의 온도 를 650°C에서 800°C까지 각 50°C 단위로 열처리를 실시 하였고 열적산화처리 시간은 4시간에서 10시간까지 2시간 간격으로 실험을 실시하였으며 관상로의 승온속도는 30°C/min이었다.
Ti64분말 및 합성된 TiO2 나노와이어의 특성은 FE-SEM (Field-emission scanning electron microscopy, Philips XL30S FEG), XRD(X-ray Diffraction, Rigaku Co., MiniFlex) 그리고 HR-TEM(High-Resolution Transmission Electron Microscopy, TECNAI20)을 이용하여 분석하였다.
3. 결과 및 고찰
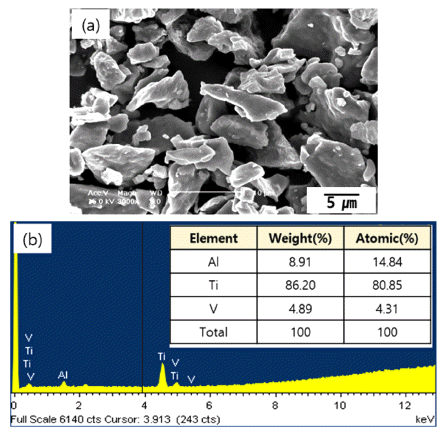
그림 1은 실험에 사용된 500 mesh의 체로 걸러진 Ti64 분말의 형상과 이 분말들의 성분분석결과이다. 그림에서 볼 수 있듯이 Ti64분말은 그 형상이 다소 불규칙한 모양 이었고 대략적인 크기는 약 8~20 um이었다. FE-SEM에 부 착된 성분분석장치로(EDS; Energy Dispersive Spectroscope) 분석한 결과 다른 불순물이 거의 없는 Ti, Al 그리고 V 원 소만 관찰되었고 각 원소의 성분비는 원래 목적으로 했던 것에 비해 Al과 V가 약간 높게 관찰되었으나 본 연구에서 진행하고자 하는 TiO2 나노와이어의 합성에는 크게 지장 이 없을 것으로 판단되었다.
지금까지 열적산화법을 이용한 TiO2 혹은 CuO와 같은 금속 산화물 나노와이어 합성에 있어서 반응가스는 주로 아르곤 가스에 산소를 소량 혼합하여 반응로에 주입하였 고 배출은 자연적으로 반응로 밖으로 흘러나가도록 대부 분 구성하였다. 즉, 대기압 상태에서 합성이 이루어졌고 반응압력에 대한 금속 산화물 나노와이어의 형성에 대해 연구된 적은 없다. 앞서 실험방법에서도 언급한 바와 같이 본 연구에서는 반응로의 한쪽에서는 반응가스를 주입하고 또한 다른 한쪽에서는 실험조건에서 정한 압력을 유지할 수 있도록 펌프와 압력조절장치가 장착되어 있어 반응로 의 압력이 TiO2 나노와이어의 형성에 얼마나 영향을 주는 지 평가할 수 있도록 구성하였다. 또한 이와 같이 외부에 서의 부가적인 물질 유입이 없도록 반응로의 내부와 외부 를 최대한 정확히 구분하여 함으로써 보다 엄격한 실험조 건에서 합성이 이루어지도록 하였다. 그림 2는 대기압 상 태에서 최적의 합성온도를 알아보기 위해 650°C부터 800°C까지 50°C간격으로 산화열처리를 실시한 결과이다. 합성조건은 반응로의 한쪽에서는 20 ppm의 산소(99.99%) 가 포함된 아르곤 가스(99.99%)를 500 mL/min로 주입하 면서 다른 한쪽에서는 압력조절장치를 이용하여 반응로의 내부 압력을 대기압인 760 Torr를 유지하도록 하였고 합성 시간은 4시간이었다. 그림에서 볼 수 있듯이 650°C에서 합성했을 경우에는 소량의 나노와이어만 관찰되었지만 700°C에서는 다량의 나노와이어가 합성되었다. 700°C 이 상의 합성온도에서는 나노와이어가 거의 형성되지 않고 합성온도가 올라 갈수록 면(face)이 잘 발달된 다량의 결 정(crystal) 형상이 주로 관찰되었다. 이러한 결정 형상은 기존 문헌에서도 보고된 바 있다[21]. 결과적으로 최적의 합성 온도는 700°C였고 이때 그 나노와이어의 직경과 길 이는 평균적으로 1 μm와 100 nm로 각각 측정되었다.

FE-SEM images of nanostructures synthesized on Ti64 powder for 4 hours in Ar atmosphere at various synthesis temperatures; (a) 650°C, (b) 700°C, (c) 750°C and (d) 800°C.
그림 2의 결과를 바탕으로 최적의 합성시간을 알아보기 위해 700°C에서 합성시간에 따른 나노와이어의 형성 변화 를 관찰하였다. 합성시간은 4, 6, 8 그리고 10시간으로 하 였으며, 그 결과를 그림 3에 나타내었다. 그림에서 볼 수 있듯이 4시간 합성하였을 경우에는 나노와이어가 많이 형 성되기는 하였지만 T64분말 전체를 뒤덮을 정도로 많이 형성되지는 않았다. 즉 형성된 나노와이어들 사이로 분말 의 표면을 관찰할 수 있을 정도였다. 하지만 그 이상의 시 간으로 합성하였을 경우에는 분말의 표면을 전혀 볼 수 없 을 정도로 다량의 나노와이어가 형성됨을 알 수 있었다. 이 결과로 최적의 합성시간을 선택한다면 8시간과 10시간으 로 합성시간을 길게 했을 경우에는 와이어의 형상이 무너 지고 짧은 로드 형상이 부분적으로 관찰되었기 때문에 6 시간이 가장 바람직한 합성시간이라고 판단하였다. 즉, 그 림에서 볼 수 있듯이 6시간 합성하였을 경우에는 전반적 으로 직경과 길이가 각각 100 nm 그리고 5 μm인 균일한 나노와이어가 다량 합성되었기 때문에 최적의 합성시간으 로 판단하였다.
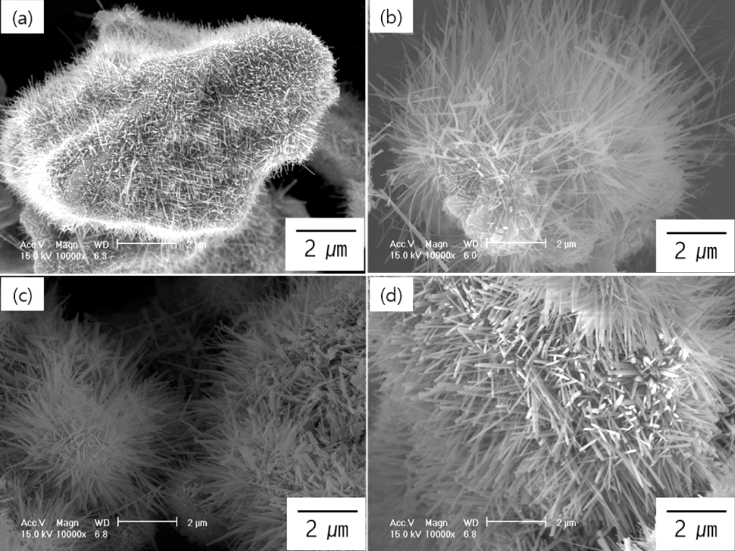
FE-SEM images of nanostructures synthesized on Ti64 powder at 700°C in Ar atmosphere at various synthesis times; (a) 4hrs., (b) 6hrs., (c) 8hrs. and (d) 10hrs.
그림 4와 5는 그림 3에서 보여준 나노와이어가 루타일 상의 TiO2가 맞는지 그리고 얼마나 순수하고 결정성이 우 수한지를 확인하기 위해 XRD와 HR-TEM분석을 실시한 결과이다. 그림 4는 그림 1에서 나타낸 산화열처리 전의 순수 T64금속분말과 그림 3에서 나타낸 나노와이어의 XRD분석 결과이다. 산화열처리를 하지 않은 순수 Ti64분 말의 경우에는 그림 4(a)의 2θ=38° 부근 회절피크에 표시 한 바와 같이 α-Ti(hexagonal closed packed)과 β-Ti(body centered cubic)상만이 존재하였고 다른 회절피크는 관찰 되지 않았다. 4시간 이상의 산화열처리된 모든 시편에서 순수 Ti 회절피크 외에 몇 개의 회절피크가 관찰되었다. XRD 데이터베이스(JCPDS)를 가지고 그 회절피크를 비교 분석한 결과 2θ=27.5°, 36.1°, 41.2° 그리고 54.3o에서 관찰 되는 회절피크는 a=b=4.5933Å 그리고 c=2.9592Å의 격자 상수를 가지는 루타일 TiO2상 (rutile TiO2 phase)의 (110), (101), (111) 그리고 (211) 면에 해당된다는 것을 알 수 있 었다(공간군 P42/mnm, JCPDS file No. 21-1276). 다만 그 림 4(b)는 4시간 동안 합성된 그림 3(a)에 해당하는 XRD 결과인데 루타일상에 해당하는 일부의 회절피크만 관찰되 는데 그 이유는 그림 3(a)에서 볼 수 있듯이 합성된 나노 와이어의 양이 매우 적기 때문인 것으로 판단된다. 그림 4 의 XRD결과에서 산화열처리 후 루타일 TiO2상 외에 다른 회절피크는 관찰되지 않았으며, 이것은 순수한 루타일 TiO2 나노와이어만 합성되었다는 것을 의미한다.
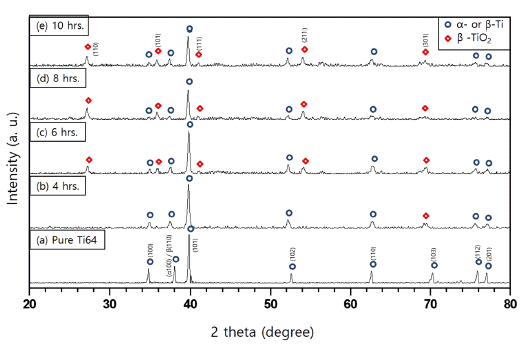
XRD patterns of pure metal Ti64 powder (a) showed in Fig. 1 and nanowires ((b)~(e)) synthesized according to various oxidation times showed in Fig. 3.

(a) and (b) HR-TEM images of an individual TiO2 nanowire. (c) is SADP taken from [100] zone axis. (d), (e) and (f) are high-magnification of three areas marked with 1, 2 and 3 in (a). The images inserted in (d)~(f) show lattice images.
합성된 TiO2 나노와이어의 형상과 구조를 더 자세히 관 찰하기 위하여 TEM분석을 실시하였으며 그 결과를 그림 5에 나타내었다. TEM분석은 최적의 합성조건으로 판단되 는 700°C에서 6시간 합성한(그림 3(b)) 나노와이어를 사용 하였다. 그림 5의 (a)와 (b)는 합성된 TiO2 나노와이어의 저배율과 고배율의 TEM사진이고 (c)는 (b)에 화살표로 표 시된 부분의 제한시야회절도형(selected area diffraction pattern, SADP)이다. 그리고 그림 5의 (d), (e) (f)는 그림 (a)에서 (1), (2), (3)으로 표시된 부분을 각각 고배율로 촬 영한 것이고 각 오른쪽 아래에 삽입된 사진은 더 높은 배 율로 확대한 것으로 TiO2 나노와이어의 결정성 정도와 단 결정 여부를 확인하기 위해 분석한 것이다. 그림 5(c)의 제 한시야회절도형의 분석을 통해 전형적인 정방정(tetragonal) 결정구조를 가지는 루타일상의 TiO2라는 것을 알 수 있었 고 또한 그림 (d)~(e)에 삽입된 사진에서 원자의 배열 즉 격자선(lattice line)의 방향이 모두 잘 일치하는 것으로 판 단할 때 나노와이어가 단결정이라는 것을 알 수 있었다. 본 연구에서는 그림 5에 나타낸 TEM결과 여러 개의 나노 와이어를 관찰하였는데 대부분 결정성이 뛰어난 단결정의 구조를 이루고 있는 것을 확인하였다. 출발물질인 Ti64에 는 Al과 V가 포함되어 있기 때문에 Al 혹은 V 산화물을 형성할 수 있으며, 기존 문헌에서는 간혹 안쪽에 TiO2가 존재하고 바깥쪽에 Al2O3가 존재하는 코어-셀 구조의 나 노와이어가 형성된다는 보고도 있다[12]. 하지만 본 연구 에서 코어-셀 구조의 나노와이어는 관찰되지 않았다. 다만 본 논문에는 나타내지 않았지만 TEM에 부착된 성분분석 장치를 이용하여 합성된 나노와이어의 성분분석 결과 Al 과 V가 관찰되는 것으로 보아 Al과 V가 TiO2 내에 침입 형이나 치환형으로 존재하는 것으로 판단하고 있다.
이상의 결과를 요약해 보면 추가적인 열처리 공정 없이 단순히 산화열처리 하나의 공정만으로 순수하고 결정성이 매우 높은 단결정의 TiO2 나노와이어가 성공적으로 합성 되었다는 것이다. 또한 이 공정은 매우 단순하기 때문에 서론에서 언급한 양극산화법이나 졸-겔법과 같은 공정에 비해 매우 저렴한 가격으로 환경오염 없이 TiO2 나노와이 어의 대량생산이 가능하다는 중요한 의미를 갖는다.
지금까지 가장 잘 알려진 금속을 산화열처리하여 얻어 지는 나노와이어의 성장기구는 산화층 형성에 따른 응력 발생과 산화층과 산화되지 않은 순수 금속 층간의 농도구 배가 그 원인인 것으로 설명되고 있다. Hansen[22], Mema [23] 그리고 Kumar[24] 등은 순수 금속 Cu를 산화열처리 하여 CuO 나노와이어를 합성하였으며, 동시에 나노와이어 성장기구를 “응력유기성장메커니즘(stress induced growth mechanism)”이라고 규정하였으며 많은 증거자료를 제시하 고 있다. Ti금속의 산화열처리에 의한 TiO2 나노와이어의 합성은 Akbar 그룹[12, 25]에서 주로 연구되었는데 그들 또한 TiO2 나노와이어가 CuO 나노와이어의 성장기구와 유사한 메커니즘으로 성장한다고 보고 하고 있다. 즉, 현 재까지는 금속의 산화열처리에 의한 성장기구는 “응력유 기성장메커니즘”으로 받아 들여지고 있다. 본 연구에서는 상기에서 언급한 성장기구가 맞는다는 전제하에 산화열처 리 반응로 내부의 압력을 낮추어 합성을 실시하였는데 그 이유는 반응로 내부의 압력을 낮게 유지하면 나노와이어 형성 물질의 기화압력이 더욱 낮아져서 나노와이어의 합 성이 더욱 활성화될 것으로 판단했기 때문이다. 따라서 가 장 TiO2 나노와이어의 합성이 잘 되었던 700°C에서 압력을 달리하여 산화열처리를 실시하였으며 그 결과를 그림 6에 나타내었다. 압력은 대기압과 유사한 750 Torr와 500 Torr 그 리고 250 Torr에서 실시하였다. 그러나 본 연구에서 기대했 던 것과는 다소 다른 결과가 도출되었는데 그림 6에서 볼 수 있듯이 대기압과 유사한 750 Torr에서 실시한 경우에는 대기압에서 실시한 경우(그림 2(b)와 비교)와 유사하게 합 성되었으나 500 Torr 그리고 250 Torr에서는 거의 합성이 이루어지지 않았다. 즉, 이 결과는 압력이 나노와이어의 합성에 큰 영향을 미치는 변수라는 것을 의미하며, 더 깊 은 연구가 필요하고 현재 진행 중에 있다.
4. 결 론
본 연구에서는 Ti64 금속분말을 사용하고 소량의 산소 를 포함한 아르곤가스 분위기에서 단순한 고온산화열처리 를 통해 TiO2 나노와이어를 다량으로 합성하는데 성공하 였다. 특히 본 연구에서는 산화열처리 과정에서 반응로의 내·외부를 엄격히 제어함으로써 결정성이 매우 뛰어나고 대부분 단결정으로 이루어진 TiO2 나노와이어를 얻을 수 있었다. TiO2 나노와이어의 성장은 합성 온도와 시간 그리 고 압력에 민감하게 거동하였다. 최적의 합성온도와 시간 은 700°C와 6시간이었으며, 이때 TiO2 나노와이어의 길이 와 직경은 대략 5 μm 그리고 100 nm이었다. 특히 반응로 의 압력이 대기압인 경우에는 합성이 잘되었지만 압력이 낮아지면 거의 합성이 되지 않는 특징을 보였다.
감사의 글
이 논문은 2016년도 경남과학기술대학교 대학회계 연구 비 지원에 의하여 연구되었음.