Articles
- Page Path
- HOME > J Korean Powder Metall Inst > Volume 25(1); 2018 > Article
-
ARTICLE
타이타늄 합금 분말의 열적산화를 통한 TiO2 나노와이어의 합성 - 김유영, 조권구a,*
- Synthesis of TiO2 Nanowires by Thermal Oxidation of Titanium Alloy Powder
- Yoo-Young Kim, Kwon-Koo Choa,*
-
Journal of Korean Powder Metallurgy Institute 2018;25(1):48-53.
DOI: https://doi.org/10.4150/KPMI.2018.25.1.48
Published online: January 31, 2018
경남과학기술대학교 기계공학과
경상대학교 나노신소재융합공학과 & 그린에너지 융합연구소
Department of Mechanical Engineering, Gyeongnam National University of Science and Technology, 33, Dongjin-ro, Jinju-si, Gyeongsangnam-do, 660-758, Republic of Korea
a Department of Materials Engineering and Convergence Technology & RIGET, Gyeongsang National University, 501, Jinju-daero, Jinju-si, Gyeongsangnam-do, 660-701, Republic of Korea
- *Corresponding Author: Kwon-Koo Cho, +82-55-772-1668, +82-55-772-1670, kkcho66@gnu.ac.kr
• Received: January 27, 2018 • Revised: February 20, 2018 • Accepted: February 21, 2018
© The Korean Powder Metallurgy Institute. All rights reserved.
- 735 Views
- 2 Download
Abstract
- One-dimensional rutile TiO2 is an important inorganic compound with applicability in sensors, solar cells, and Li-based batteries. However, conventional synthesis methods for TiO2 nanowires are complicated and entail risks of environmental contamination. In this work, we report the growth of TiO2 nanowires on a Ti alloy powder (Ti-6wt%Al-4wt%V, Ti64) using simple thermal oxidation under a limited supply of O2. The optimum condition for TiO2 nanowire synthesis is studied for variables including temperature, time, and pressure. TiO2 nanowires of ~5 μm in length and 100 nm in thickness are richly synthesized under the optimum condition with single-crystalline rutile phases. The formation of TiO2 nanowires is greatly influenced by synthesis temperature and pressure. The synthesized TiO2 nanowires are characterized using field-emission scanning electron microscopy (FE-SEM), X-ray diffraction (XRD), and high-resolution transmission electron microscopy (HR-TEM).
- 일차원 나노구조를 가지는 TiO2는 전기적·광학적 특성 과 화학적 안정성이 매우 높을 뿐만 아니라 넓은 비표면 적, 양자구속효과 그리고 무독성이며 살균 특성을 가지기 때문에 여러 응용분야에서 기능소재로의 적용 가능성이 제기되어 왔다[1, 2]. 지금까지 일차원 나노구조를 가지는 TiO2는 양극산화법(anodic oxidation)[3, 4], 졸-겔법(sol-gel) [5], 화학기상증착법(chemical vapor deposition)[6], 수열합성 법(hydrothermal)[7, 8], 전기방사법(electrospinning)[9, 10], 리 소그래피법(lithography)[11] 그리고 열적산화법(thermal oxidation)[12] 등으로 제조 및 연구되어 왔다. 이러한 방법 들로 제조된 TiO2는 비정질(amorphous)이거나 아나타제 (anatase)상 혹은 루타일(rutile)상의 결정구조를 가지는데 열적산화법을 제외한 나머지 방법들로 제조된 TiO2는 주 로 비정질이거나 아나타제상의 결정구조를 가지는 것으로 보고되고 있다.
- 지금까지는 주로 아나타제상을 갖는 TiO2에 대해서 많 은 합성 및 응용연구가 있었는데 그 이유는 많은 연구결 과에서 루타일상보다는 아나타제상을 갖는 TiO2가 더 많 은 응용 가능성을 보였기 때문이며 일차원 나노구조를 갖 는 루타일상의 TiO2 합성에 대한 연구가 활성화 되지 않 고 특정 연구그룹[12]에 국한된 것도 같은 맥락이라고 볼 수 있다. 하지만 앞에서 제시된 방법들 중에서 열적산화법 을 제외한 아나타제상이 얻어지는 대부분의 방법들은 공 정제어가 어렵거나 복잡하고 환경 오염의 문제점을 가지 고 있으며 특히 생산량을 높이는데 한계가 있다는 큰 단 점을 가지고 있다. 이에 반해 일차원 나노구조를 갖는 루 타일상의 TiO2가 얻어지는 열적산화법은 그 제조 공정이 매우 단순하여 저비용으로 대량생산이 가능하다는 큰 장 점을 가지고 있으며, 또한 나노구조를 갖는 루타일상의 TiO2가 염료감응태양전지[13-15], 화학센서[16], 광촉매 [17, 18] 그리고 리튬이차전지[19, 20] 등의 분야에서 응용 가능성을 보이는 연구결과가 도출되고 있기 때문에 아나 타제상보다는 루타일상의 TiO2가 상용화 측면에서는 가능 성이 더 높다고 할 수 있다. 즉, 일차원 나노구조를 갖는 루타일상의 TiO2에 대해 더 많은 합성 및 응용에 대한 연 구가 필요한 실정이다.
- 따라서 본 연구에서는 상용화되어 판매되고 있는 Ti64 금속분말과 열적산화(thermal oxidation)처리를 이용하여 결정성이 뛰어난 루타일상의 TiO2 나노와이어를 합성하고 자 하였고, 온도와 시간 그리고 압력을 주요변수로 하여 최적의 합성 조건과 성장 거동을 알아 보고자 하였다.
서 론
- TiO2 나노와이어의 합성을 위해 500 mesh(25 um 이하) 의 체로 걸러 낸 Ti64 금속분말(Ti-6wt%Al-4wt%V)을 사 용하였다. 본 연구결과에는 나타내지 않았으나 순수 Ti분 말이나 크기가 비교적 큰 분말을 사용했을 경우에는 TiO2 나노와이어의 생성량이 비교적 적었기 때문에 비교적 작 은 크기의 Ti64분말을 사용하였다. 준비된 1 g의 Ti64분말 을 알루미나 용기에 넣은 후 수평식 전기저항 관상로의 중앙에 위치시키고 투입구를 닫아 밀폐시킨 후 아르곤과 산소의 혼합가스 주입과 관상로 내부의 압력조절을 위해 진공펌프 가동을 실시하였다. 본 연구에서 사용한 관상로 는 한쪽은 가스유량제어장치(mass flow control, MFC)가 구성되어 있어 가스의 주입량을 조절할 수 있고 다른 한 쪽은 진공펌프를 포함하여 압력조절 장치로 구성되어 있 어 내부의 압력 조절이 가능하게 구성된 장치이다. 이들 장치를 통해 열적산화반응이 일어나는 동안 관상로 내·외 부를 최대한 차단하고자 하였으며 또한 관상로 내부의 압 력을 조절하여 압력 변화에 따른 나노와이어의 성장 거동 을 관찰하고자 하였다. Ti64분말을 관상로에 장입 후 투입 구를 닫아 밀폐시킨 후 로터리 펌프의 가동과 아르곤 가 스의 주입을 3차례 교대로 실시하여 최대한 산소를 제거 한 후 실험하고자 하는 4가지 압력(760, 750, 500 그리고 250 Torr)으로 제어하였다. 앞에서 언급한 바와 같이 관상 로의 한쪽에서는 가스유량조절장치를 이용하여 20 ppm의 산소(99.99%)가 포함된 아르곤 가스(99.99%)를 500 mL/ min로 주입하고 다른 한쪽에서는 압력조절장치를 이용해 목적으로 하는 압력을 유지하였다. 즉, 최대한 산소의 량 은 동일하게 유지하면서 열적산화반응이 일어나는 반응로 의 압력만 달리하여 TiO2 나노와이어의 성장거동을 관찰 하고자 하였다. 기존 문헌[12]에서 20 ppm 정도의 산소를 주입하였을 경우 나노와이어가 잘 합성된다는 보고가 있 었기 때문에 산소의 함량은 변수로 두지 않고 20 ppm으로 고정하였다. 특정 압력이 유지된 상태에서 관상로의 온도 를 650°C에서 800°C까지 각 50°C 단위로 열처리를 실시 하였고 열적산화처리 시간은 4시간에서 10시간까지 2시간 간격으로 실험을 실시하였으며 관상로의 승온속도는 30°C/min이었다.
- Ti64분말 및 합성된 TiO2 나노와이어의 특성은 FE-SEM (Field-emission scanning electron microscopy, Philips XL30S FEG), XRD(X-ray Diffraction, Rigaku Co., MiniFlex) 그리고 HR-TEM(High-Resolution Transmission Electron Microscopy, TECNAI20)을 이용하여 분석하였다.
실험 방법
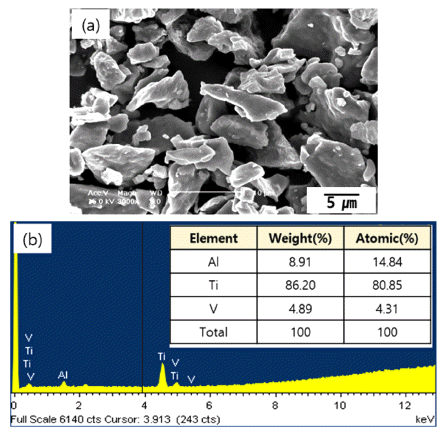
- 그림 1은 실험에 사용된 500 mesh의 체로 걸러진 Ti64 분말의 형상과 이 분말들의 성분분석결과이다. 그림에서 볼 수 있듯이 Ti64분말은 그 형상이 다소 불규칙한 모양 이었고 대략적인 크기는 약 8~20 um이었다. FE-SEM에 부 착된 성분분석장치로(EDS; Energy Dispersive Spectroscope) 분석한 결과 다른 불순물이 거의 없는 Ti, Al 그리고 V 원 소만 관찰되었고 각 원소의 성분비는 원래 목적으로 했던 것에 비해 Al과 V가 약간 높게 관찰되었으나 본 연구에서 진행하고자 하는 TiO2 나노와이어의 합성에는 크게 지장 이 없을 것으로 판단되었다.
- 지금까지 열적산화법을 이용한 TiO2 혹은 CuO와 같은 금속 산화물 나노와이어 합성에 있어서 반응가스는 주로 아르곤 가스에 산소를 소량 혼합하여 반응로에 주입하였 고 배출은 자연적으로 반응로 밖으로 흘러나가도록 대부 분 구성하였다. 즉, 대기압 상태에서 합성이 이루어졌고 반응압력에 대한 금속 산화물 나노와이어의 형성에 대해 연구된 적은 없다. 앞서 실험방법에서도 언급한 바와 같이 본 연구에서는 반응로의 한쪽에서는 반응가스를 주입하고 또한 다른 한쪽에서는 실험조건에서 정한 압력을 유지할 수 있도록 펌프와 압력조절장치가 장착되어 있어 반응로 의 압력이 TiO2 나노와이어의 형성에 얼마나 영향을 주는 지 평가할 수 있도록 구성하였다. 또한 이와 같이 외부에 서의 부가적인 물질 유입이 없도록 반응로의 내부와 외부 를 최대한 정확히 구분하여 함으로써 보다 엄격한 실험조 건에서 합성이 이루어지도록 하였다. 그림 2는 대기압 상 태에서 최적의 합성온도를 알아보기 위해 650°C부터 800°C까지 50°C간격으로 산화열처리를 실시한 결과이다. 합성조건은 반응로의 한쪽에서는 20 ppm의 산소(99.99%) 가 포함된 아르곤 가스(99.99%)를 500 mL/min로 주입하 면서 다른 한쪽에서는 압력조절장치를 이용하여 반응로의 내부 압력을 대기압인 760 Torr를 유지하도록 하였고 합성 시간은 4시간이었다. 그림에서 볼 수 있듯이 650°C에서 합성했을 경우에는 소량의 나노와이어만 관찰되었지만 700°C에서는 다량의 나노와이어가 합성되었다. 700°C 이 상의 합성온도에서는 나노와이어가 거의 형성되지 않고 합성온도가 올라 갈수록 면(face)이 잘 발달된 다량의 결 정(crystal) 형상이 주로 관찰되었다. 이러한 결정 형상은 기존 문헌에서도 보고된 바 있다[21]. 결과적으로 최적의 합성 온도는 700°C였고 이때 그 나노와이어의 직경과 길 이는 평균적으로 1 μm와 100 nm로 각각 측정되었다.
- 그림 2의 결과를 바탕으로 최적의 합성시간을 알아보기 위해 700°C에서 합성시간에 따른 나노와이어의 형성 변화 를 관찰하였다. 합성시간은 4, 6, 8 그리고 10시간으로 하 였으며, 그 결과를 그림 3에 나타내었다. 그림에서 볼 수 있듯이 4시간 합성하였을 경우에는 나노와이어가 많이 형 성되기는 하였지만 T64분말 전체를 뒤덮을 정도로 많이 형성되지는 않았다. 즉 형성된 나노와이어들 사이로 분말 의 표면을 관찰할 수 있을 정도였다. 하지만 그 이상의 시 간으로 합성하였을 경우에는 분말의 표면을 전혀 볼 수 없 을 정도로 다량의 나노와이어가 형성됨을 알 수 있었다. 이 결과로 최적의 합성시간을 선택한다면 8시간과 10시간으 로 합성시간을 길게 했을 경우에는 와이어의 형상이 무너 지고 짧은 로드 형상이 부분적으로 관찰되었기 때문에 6 시간이 가장 바람직한 합성시간이라고 판단하였다. 즉, 그 림에서 볼 수 있듯이 6시간 합성하였을 경우에는 전반적 으로 직경과 길이가 각각 100 nm 그리고 5 μm인 균일한 나노와이어가 다량 합성되었기 때문에 최적의 합성시간으 로 판단하였다.
- 그림 4와 5는 그림 3에서 보여준 나노와이어가 루타일 상의 TiO2가 맞는지 그리고 얼마나 순수하고 결정성이 우 수한지를 확인하기 위해 XRD와 HR-TEM분석을 실시한 결과이다. 그림 4는 그림 1에서 나타낸 산화열처리 전의 순수 T64금속분말과 그림 3에서 나타낸 나노와이어의 XRD분석 결과이다. 산화열처리를 하지 않은 순수 Ti64분 말의 경우에는 그림 4(a)의 2θ=38° 부근 회절피크에 표시 한 바와 같이 α-Ti(hexagonal closed packed)과 β-Ti(body centered cubic)상만이 존재하였고 다른 회절피크는 관찰 되지 않았다. 4시간 이상의 산화열처리된 모든 시편에서 순수 Ti 회절피크 외에 몇 개의 회절피크가 관찰되었다. XRD 데이터베이스(JCPDS)를 가지고 그 회절피크를 비교 분석한 결과 2θ=27.5°, 36.1°, 41.2° 그리고 54.3o에서 관찰 되는 회절피크는 a=b=4.5933Å 그리고 c=2.9592Å의 격자 상수를 가지는 루타일 TiO2상 (rutile TiO2 phase)의 (110), (101), (111) 그리고 (211) 면에 해당된다는 것을 알 수 있 었다(공간군 P42/mnm, JCPDS file No. 21-1276). 다만 그 림 4(b)는 4시간 동안 합성된 그림 3(a)에 해당하는 XRD 결과인데 루타일상에 해당하는 일부의 회절피크만 관찰되 는데 그 이유는 그림 3(a)에서 볼 수 있듯이 합성된 나노 와이어의 양이 매우 적기 때문인 것으로 판단된다. 그림 4 의 XRD결과에서 산화열처리 후 루타일 TiO2상 외에 다른 회절피크는 관찰되지 않았으며, 이것은 순수한 루타일 TiO2 나노와이어만 합성되었다는 것을 의미한다.
- 합성된 TiO2 나노와이어의 형상과 구조를 더 자세히 관 찰하기 위하여 TEM분석을 실시하였으며 그 결과를 그림 5에 나타내었다. TEM분석은 최적의 합성조건으로 판단되 는 700°C에서 6시간 합성한(그림 3(b)) 나노와이어를 사용 하였다. 그림 5의 (a)와 (b)는 합성된 TiO2 나노와이어의 저배율과 고배율의 TEM사진이고 (c)는 (b)에 화살표로 표 시된 부분의 제한시야회절도형(selected area diffraction pattern, SADP)이다. 그리고 그림 5의 (d), (e) (f)는 그림 (a)에서 (1), (2), (3)으로 표시된 부분을 각각 고배율로 촬 영한 것이고 각 오른쪽 아래에 삽입된 사진은 더 높은 배 율로 확대한 것으로 TiO2 나노와이어의 결정성 정도와 단 결정 여부를 확인하기 위해 분석한 것이다. 그림 5(c)의 제 한시야회절도형의 분석을 통해 전형적인 정방정(tetragonal) 결정구조를 가지는 루타일상의 TiO2라는 것을 알 수 있었 고 또한 그림 (d)~(e)에 삽입된 사진에서 원자의 배열 즉 격자선(lattice line)의 방향이 모두 잘 일치하는 것으로 판 단할 때 나노와이어가 단결정이라는 것을 알 수 있었다. 본 연구에서는 그림 5에 나타낸 TEM결과 여러 개의 나노 와이어를 관찰하였는데 대부분 결정성이 뛰어난 단결정의 구조를 이루고 있는 것을 확인하였다. 출발물질인 Ti64에 는 Al과 V가 포함되어 있기 때문에 Al 혹은 V 산화물을 형성할 수 있으며, 기존 문헌에서는 간혹 안쪽에 TiO2가 존재하고 바깥쪽에 Al2O3가 존재하는 코어-셀 구조의 나 노와이어가 형성된다는 보고도 있다[12]. 하지만 본 연구 에서 코어-셀 구조의 나노와이어는 관찰되지 않았다. 다만 본 논문에는 나타내지 않았지만 TEM에 부착된 성분분석 장치를 이용하여 합성된 나노와이어의 성분분석 결과 Al 과 V가 관찰되는 것으로 보아 Al과 V가 TiO2 내에 침입 형이나 치환형으로 존재하는 것으로 판단하고 있다.
- 이상의 결과를 요약해 보면 추가적인 열처리 공정 없이 단순히 산화열처리 하나의 공정만으로 순수하고 결정성이 매우 높은 단결정의 TiO2 나노와이어가 성공적으로 합성 되었다는 것이다. 또한 이 공정은 매우 단순하기 때문에 서론에서 언급한 양극산화법이나 졸-겔법과 같은 공정에 비해 매우 저렴한 가격으로 환경오염 없이 TiO2 나노와이 어의 대량생산이 가능하다는 중요한 의미를 갖는다.
- 지금까지 가장 잘 알려진 금속을 산화열처리하여 얻어 지는 나노와이어의 성장기구는 산화층 형성에 따른 응력 발생과 산화층과 산화되지 않은 순수 금속 층간의 농도구 배가 그 원인인 것으로 설명되고 있다. Hansen[22], Mema [23] 그리고 Kumar[24] 등은 순수 금속 Cu를 산화열처리 하여 CuO 나노와이어를 합성하였으며, 동시에 나노와이어 성장기구를 “응력유기성장메커니즘(stress induced growth mechanism)”이라고 규정하였으며 많은 증거자료를 제시하 고 있다. Ti금속의 산화열처리에 의한 TiO2 나노와이어의 합성은 Akbar 그룹[12, 25]에서 주로 연구되었는데 그들 또한 TiO2 나노와이어가 CuO 나노와이어의 성장기구와 유사한 메커니즘으로 성장한다고 보고 하고 있다. 즉, 현 재까지는 금속의 산화열처리에 의한 성장기구는 “응력유 기성장메커니즘”으로 받아 들여지고 있다. 본 연구에서는 상기에서 언급한 성장기구가 맞는다는 전제하에 산화열처 리 반응로 내부의 압력을 낮추어 합성을 실시하였는데 그 이유는 반응로 내부의 압력을 낮게 유지하면 나노와이어 형성 물질의 기화압력이 더욱 낮아져서 나노와이어의 합 성이 더욱 활성화될 것으로 판단했기 때문이다. 따라서 가 장 TiO2 나노와이어의 합성이 잘 되었던 700°C에서 압력을 달리하여 산화열처리를 실시하였으며 그 결과를 그림 6에 나타내었다. 압력은 대기압과 유사한 750 Torr와 500 Torr 그 리고 250 Torr에서 실시하였다. 그러나 본 연구에서 기대했 던 것과는 다소 다른 결과가 도출되었는데 그림 6에서 볼 수 있듯이 대기압과 유사한 750 Torr에서 실시한 경우에는 대기압에서 실시한 경우(그림 2(b)와 비교)와 유사하게 합 성되었으나 500 Torr 그리고 250 Torr에서는 거의 합성이 이루어지지 않았다. 즉, 이 결과는 압력이 나노와이어의 합성에 큰 영향을 미치는 변수라는 것을 의미하며, 더 깊 은 연구가 필요하고 현재 진행 중에 있다.
결과 및 고찰
Fig. 2

FE-SEM images of nanostructures synthesized on Ti64 powder for 4 hours in Ar atmosphere at various synthesis temperatures; (a) 650°C, (b) 700°C, (c) 750°C and (d) 800°C.

Fig. 3
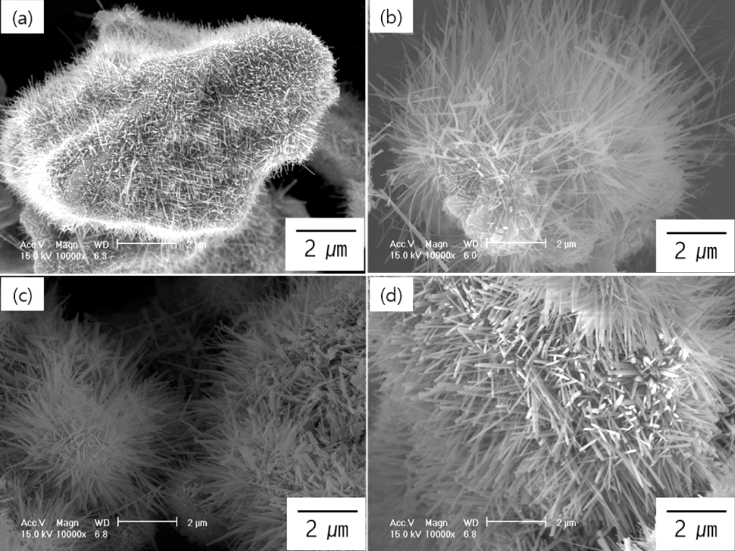
FE-SEM images of nanostructures synthesized on Ti64 powder at 700°C in Ar atmosphere at various synthesis times; (a) 4hrs., (b) 6hrs., (c) 8hrs. and (d) 10hrs.

Fig. 4
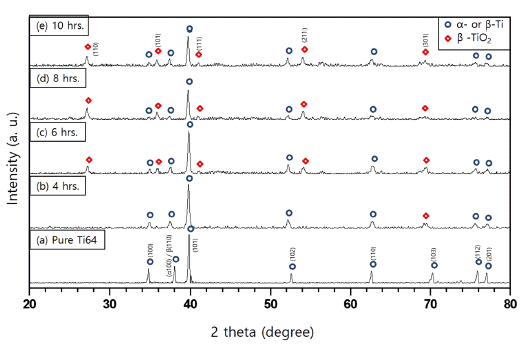
XRD patterns of pure metal Ti64 powder (a) showed in Fig. 1 and nanowires ((b)~(e)) synthesized according to various oxidation times showed in Fig. 3.

Fig. 5

(a) and (b) HR-TEM images of an individual TiO2 nanowire. (c) is SADP taken from [100] zone axis. (d), (e) and (f) are high-magnification of three areas marked with 1, 2 and 3 in (a). The images inserted in (d)~(f) show lattice images.

- 본 연구에서는 Ti64 금속분말을 사용하고 소량의 산소 를 포함한 아르곤가스 분위기에서 단순한 고온산화열처리 를 통해 TiO2 나노와이어를 다량으로 합성하는데 성공하 였다. 특히 본 연구에서는 산화열처리 과정에서 반응로의 내·외부를 엄격히 제어함으로써 결정성이 매우 뛰어나고 대부분 단결정으로 이루어진 TiO2 나노와이어를 얻을 수 있었다. TiO2 나노와이어의 성장은 합성 온도와 시간 그리 고 압력에 민감하게 거동하였다. 최적의 합성온도와 시간 은 700°C와 6시간이었으며, 이때 TiO2 나노와이어의 길이 와 직경은 대략 5 μm 그리고 100 nm이었다. 특히 반응로 의 압력이 대기압인 경우에는 합성이 잘되었지만 압력이 낮아지면 거의 합성이 되지 않는 특징을 보였다.
결 론
-
Acknowledgements
- 이 논문은 2016년도 경남과학기술대학교 대학회계 연구 비 지원에 의하여 연구되었음.
감사의 글
- 1. J.M. Wu, H.C. Shih, W.T. Wu, Y.K. Tseng and I.C. Chen: J. Cryst. Growth., (2005) 281 384.Article
- 2. H.W. Peng and J.B. Li: J. Phys. Chem. C., (2008) 112 20142.
- 3. B.D. Yao, Y.F. Chan, X.Y. Zhang, W.F. Zhang, Z.Y. Yang and N. Wang: Appl. Phys. Lett.., (2003) 82 281.ArticlePDF
- 4. A. Hu, C. Cheng, X. Li, J. Jiang, R. Ding, J. Zhu, F. Wu, J. Liu and X. Huang: Nanoscale Res. Lett.., (2011) 6 2.
- 5. Y. Lei, L.D. Zhang, G.W. Meng, G.H. Li, X.Y. Zhang, C.H. Liang, W. Chen and S.X. Wang: Appl. Phys. Lett.., (2001) 78 1125.ArticlePDF
- 6. S.K. Pradhan, P.J. Peucroft, F. Yang and A. Dozier: J. Cryst. Growth., (2003) 256 83.Article
- 7. P. Hu, G. Du, W. Zhou, J. Cui, J. Lin, H. Liu, D. Liu, J. Wang and S. Chen: Appl. Mater. Interfac.., (2010) 2 3263.Article
- 8. C.S. Rout, G.U. Kulkarni and C.N.R. Rao: J. Phys. D Appl. Phys.., (2007) 40 2777.Article
- 9. W. Biao, Z.Y. Dong, H.L. Ming, C.J. Sheng, G.F. Li, L. Yun and W.L. Jun: Chin. Sci. Bull.., (2010) 55 228.
- 10. O. Landau, A. Rothschild and E. Zussman: Chem. Mater.., (2009) 21 9.Article
- 11. L. Francioso, A.M. Taurino, A. Forleo and P. Siciliano: Sensor Actuat. B-Chem.., (2008) 130 70.Article
- 12. M.M. Arafat, A.S.M.A. Haseeb and S.A. Akbar: Ceram. Int.., (2015) 41 4401.Article
- 13. B. Liu and E.S. Aydil: J. Am. Chem. Soc.., (2009) 131 3985.Article
- 14. H. Wang, Y. Bai, Q. Wu, W. Zhou, H. Zhang, J. Li and L. Guo: Phys. Chem. Chem. Phys.., (2011) 13 7008.Article
- 15. Q. Jiang, X. Sheng, Y. Li, X. Feng and T. Xu: Chem. Commun. (Camb.)., (2014) 50 14720.Article
- 16. Z. Li, H. Zhang, W. Zheng, W. Wang, H. Huang, C. Wang, A.G. MacDiarmid and Y. Wei: J. Am. Chem. Soc.., (2008) 130 5036.Article
- 17. S. Yurdakal, G. Palmisano, V. Loddo, V. Augugliaro and L. Palmisano: J. Am. Chem. Soc.., (2008) 130 1568.Article
- 18. J.M. Wu, H.C. Shih and W.T. Wu: Nanotechnology., (2006) 17 105.Article
- 19. J.S. Chen and X.W. Lou: J. Power Sources., (2010) 195 2905.Article
- 20. Y.Q. Wang, L. Gu, Y.G. Guo, H. Li, X.Q. He, S. Tsukimoto, Y. Ikuhara and L.J. Wan: J. Am. Chem. Soc.., (2012) 134 7874.Article
- 21. H. Lee, S. Dregia, S. Akbar and M. Alhoshan: J. Nanomater.., (2010) 2010 7.
- 22. B.J. Hansen, G. Lu and J. Chen: J. Nanomater.., (2008) 2008 7.
- 23. R. Mema, L. Yuan, Q. Du, Y. Wang and G. Zhou: Chem. Phys. Lett.., (2011) 512 87.Article
- 24. A. Kumar, A.K. Srivastava, P. Tiwari and R.V. Nandedkar: J. Phys. Condens. Matter., (2004) 16 8531.Article
- 25. M.M. Arafat, A.S.M.A. Haseeb, B. Dinan and S.A. Akbar: Ceram. Int.., (2013) 39 6517.Article
Figure & Data
References
Citations
Citations to this article as recorded by 

Synthesis of TiO2 Nanowires by Thermal Oxidation of Titanium Alloy Powder
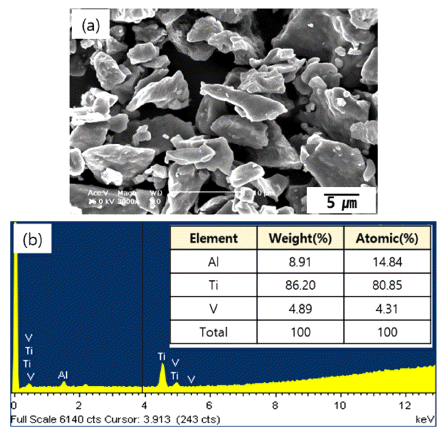





Fig. 1
FE-SEM image (a) and EDS result (b) of Ti64 powder.
Fig. 2
FE-SEM images of nanostructures synthesized on Ti64 powder for 4 hours in Ar atmosphere at various synthesis temperatures; (a) 650°C, (b) 700°C, (c) 750°C and (d) 800°C.
Fig. 3
FE-SEM images of nanostructures synthesized on Ti64 powder at 700°C in Ar atmosphere at various synthesis times; (a) 4hrs., (b) 6hrs., (c) 8hrs. and (d) 10hrs.
Fig. 4
XRD patterns of pure metal Ti64 powder (a) showed in Fig. 1 and nanowires ((b)~(e)) synthesized according to various oxidation times showed in Fig. 3.
Fig. 5
(a) and (b) HR-TEM images of an individual TiO2 nanowire. (c) is SADP taken from [100] zone axis. (d), (e) and (f) are high-magnification of three areas marked with 1, 2 and 3 in (a). The images inserted in (d)~(f) show lattice images.
Fig. 6
FE-SEM images of nanostructures synthesized on Ti64 powder for 4 hours at 700°C in Ar atmosphere at various pressures of thermal oxidation chamber; (a) 750 Torr, (b) 500 Torr and (c) 250 Torr.
Fig. 1
Fig. 2
Fig. 3
Fig. 4
Fig. 5
Fig. 6
Synthesis of TiO2 Nanowires by Thermal Oxidation of Titanium Alloy Powder
TOP
 KPMI
KPMI


 Cite this Article
Cite this Article






