Articles
- Page Path
- HOME > J Korean Powder Metall Inst > Volume 28(2); 2021 > Article
-
Article
초음파 분무 열분해와 화학적 변환 공정을 이용한 (GaN)1-x(ZnO)x 나노입자의 합성과 광학적 성질 - 김정현a, 류철희a, 지명준a, 최요민b, 이영인a,*
- Synthesis and Optical Property of (GaN)1-x(ZnO)x Nanoparticles Using an Ultrasonic Spray Pyrolysis Process and Subsequent Chemical Transformation
- Jeong Hyun Kima, Cheol-Hui Ryua, Myungjun Jia, Yomin Choib, Young-In Leea,*
-
Journal of Korean Powder Metallurgy Institute 2021;28(2):143-149.
DOI: https://doi.org/10.4150/KPMI.2021.28.2.143
Published online: March 31, 2021
a 서울과학기술대학교 신소재공학과
b 한국산업기술시험원 시스템에너지본부 재료기술센터
a Department of Materials Science and Engineering, Seoul National University of Science and Technology, 01811 Seoul, Republic of Korea
b Material Technology Center, System & Energy Division, Korea Testing Laboratory, Ansan 15588, Republic of Korea
- *Corresponding Author: Young-In Lee, TEL: +82-2-970-6646, FAX: +82-2-973-6657, E-mail: youngin@seoultech.ac.kr
- - 김정현·류철희·지명준: 학생, 최요민: 주임연구원, 이영인: 교수
• Received: April 18, 2021 • Accepted: April 22, 2021
© The Korean Powder Metallurgy Institute. All rights reserved.
- 790 Views
- 2 Download
Abstract
- In this study, (GaN)1-x(ZnO)x solid solution nanoparticles with a high zinc content are prepared by ultrasonic spray pyrolysis and subsequent nitridation. The structure and morphology of the samples are investigated by X-ray diffraction (XRD), field-emission scanning electron microscopy, and energy-dispersive X-ray spectroscopy. The characterization results show a phase transition from the Zn and Ga-based oxides (ZnO or ZnGa2O4) to a (GaN)1-x (ZnO)x solid solution under an NH3 atmosphere. The effect of the precursor solution concentration and nitridation temperature on the final products are systematically investigated to obtain (GaN)1-x(ZnO)x nanoparticles with a high Zn concentration. It is confirmed that the powder synthesized from the solution in which the ratio of Zn and Ga was set to 0.8:0.2, as the initial precursor composition was composed of about 0.8-mole fraction of Zn, similar to the initially set one, through nitriding treatment at 700°C. Besides, the synthesized nanoparticles exhibited the typical XRD pattern of (GaN)1-x(ZnO)x, and a strong absorption of visible light with a bandgap energy of approximately 2.78 eV, confirming their potential use as a hydrogen production photocatalyst.
- 반도체 고용체(semiconductor solid solution)는 밴드갭과 발광 파장을 넓은 범위에서 효율적으로 조절할 수 있다는 장점으로 인해 발광 다이오드, 레이저, 광 검출기 및 광촉 매로 활용이 기대되는 소재이다[1, 2]. GaP-ZnS로 대표되 는 4원계 반도체 고용체는 2원계(SiGe)와 3원계(InGaN) 고용체와 비교하여 양이온과 음이온이 동시에 치환되어 고용체를 형성하기 때문에 더욱 넓은 범위에서 광학 및 전기적 특성의 제어가 가능하다[3-6].
- 4원계 반도체 고용체 중 GaN과 ZnO의 전율 고용으로 구현되는 (GaN)1-x(ZnO)x는 2005년 Domen 교수 연구팀에 의해 최초로 합성되었으며, (GaN)1-x(ZnO)x의 x가 증가함 에 따라 밴드갭 에너지가 감소하여 가시광선에 의한 광촉 매 특성이 개선된다[7-9]. 이와 같은 밴드갭의 감소는 O 2p 궤도보다 더 높은 위치 에너지를 갖는 N 2 p 및 O 2p 의 혼성화된 궤도에 의한 발생한다. 2005년 이후로 (GaN)1-x(ZnO)x의 높은 광 흡수를 위한 밴드갭 제어와 흡 수된 광자에 의해 생성된 전하(전자 및 정공)의 효율적인 분리와 표면으로의 이동 효율을 개선하기 위한 많은 연구 가 진행되고 있다[10-14]. 현재까지 (GaN)1-x(ZnO)x 고용체 의 밴드갭 에너지는 약 2.2~3.4 eV 범위에서 보고되고 있 으며[8, 10-14], Rh2-yCryO3 공촉매(co-catalyst)를 도입하여 가시광 조사 하에서 물 분해(수소와 산소)의 내부 양자 효 율을 5.9 %까지 개선한 연구가 보고된 바 있다[15].
- 현재까지 (GaN)1-x(ZnO)x 양자 효율을 개선하기 위한 연 구는 x를 증가시켜 밴드갭을 좁히고 이를 통해 가시광선 의 흡수를 극대화하는 것과 (GaN)1-x(ZnO)x의 나노화를 도 모해 비 표면적을 크게 하는 것에 집중되어 있다. 일반적 으로 (GaN)1-x(ZnO)x는 Ga2O3와 ZnO를 출발 물질로 하여 암모니아 가스를 이용한 질화처리를 통해 제조된다[7, 8]. 하지만 Ga2O3로부터 변환된 GaN이 ZnO와 고용체를 구성 하는 과정에서 환원성 분위기에 의해 ZnO가 Zn로 환원되 며, 환원된 Zn가 쉽게 휘발되는 문제가 있다. 특히, 이러 한 문제는 비 표면적이 큰 나노 크기의 출발 소재를 사용 해야 하는 (GaN )1-x(ZnO)x 나노입자를 합성하는 과정에서 더욱 두드러지게 나타난다. 이러한 문제로 인해 (GaN)1-x (ZnO)x 나노입자의 합성 및 특성 분석에 관한 연구가 미 비한 실정이며, 새로운 합성 방법의 개발에 관한 필요성이 대두되고 있다.
- 전술한 바와 같이, (GaN)1-x(ZnO)x 나노 구조체는 산화 물 상태의 출발 물질의 질화처리를 통해 제조되기 때문에 조성이 제어된 산화물 분말을 제조하는 것이 중요하다. 최 근 Y. Asakura 등은 수열합성법(hydrothermal method)을 이용하여 ZnGa2O4 나노입자를 합성하고 이를 질화 처리 하여 약 0.37의 Zn/Ga값을 갖는 50 nm 크기의 나노입자를 합성하였다[16]. 2020년 Y-L Hu 등은 침전법을 이용하여 Zn/Ga/CO3로 구성된 layered double hydroxide (LDH) 전 구체를 합성하고 질화처리 조건을 제어하여 Zn/Ga이 1인 약 200 nm 분말을 성공적으로 합성하였다[17]. 하지만 수 열합성법과 공침법과 같은 용액 기반의 합성법은 용매에 용해된 이온의 충돌에 의한 핵 생성 및 결정성장 또는 pH 변화에 의한 보다 안정한 형태로의 침전을 유도하는 방식 이기 때문에 다성분계 소재의 조성을 정확하게 제어하기 어렵다는 단점이 있다. 또한, 이들 방식은 배치(batch)형 공정으로써 제조 가능한 분말의 양이 반응기의 크기에 의 존하므로 연속 및 대량생산이 어렵다는 단점이 있다.
- 이와 같은 용액 공정과 달리, 초음파 분무 열분해법 (Ultrasonic Spray Pyrolysis, USP)은 전구체 용액에 초음파 를 인가하여 수백 나노미터에서 수 마이크론 크기의 액적 (droplet)을 형성하고 각각의 액적을 개별 미소 반응기 (micro-reactor)로 이용하여 직접 열분해하여 방식으로 분 말을 제조하는 공정이다[18-20]. 따라서 균질하며 제어된 조성의 다성분계 분말을 쉽게 제조할 수 있고, 액적의 발 생 및 공급, 이송 과정과 열분해(결정화)를 연속적으로 진 행할 수 있다는 장점으로 기존 공정의 한계를 극복할 수 있다. 본 연구에서는 USP를 이용하여 Zn/Ga가 각각 4, 1, 0.25로 제어된 산화물 분말을 제조하였으며, 이를 암모니 아 가스 분위기에서 다양한 온도로 질화 처리하여 (GaN)1-x (ZnO)x로 변환하고, 조성에 따른 분말의 형상, 크기 및 광 학적 성질의 변화를 체계적으로 고찰하였다.
1. 서 론
- (GaN)1-x(ZnO)x을 제조하기 위한 산화물 분말은 아세트 산 아연 {Zn(CH3COO)2·2H2O, 99.9%}과 질산 갈륨{gallium nitrate, Ga(NO3)2·xH2O}을 초순수(distilled water)에 용해 한 용액을 이용하여 제조하였다. 전구체 용액의 총 농도는 100 mM로 설정하였으며, Zn와 Ga 전구체를 각각 0.8:0.2, 0.5:0.5, 0.2:0.8로 제어하였다. 미세 액적을 형성하기 위한 초음파 분무는 2.0 l/min의 유량으로 공급되는 전구체 용 액을 1.7MHz의 초음파를 이용하여 실시하였다. 전구체의 분해와 결정화를 위한 열분해는 생성된 미세 액적을 2 lpm의 속도로 공급되는 산소 운반가스(carrier gas)를 통해 관상로(tube furnace)로 이송하여 진행하였고, 이때, 관상 로의 온도는 500°C로 유지하였다. 제조된 분말의 포집은 관상 로의 끝단에 필터페이퍼(filter paper)가 삽입된 유리 필터를 이용하여 진행하였다.
- 제조된 산화물의 형상과 결정구조를 비교하기 위해 기 존 연구를 참고하여 순수한 ZnO와 Ga2O3 분말을 각각 100 mM의 아세트산 아연과 질산 갈륨 수용액을 이용하여 같은 조건에서 제조하였다[21, 22]. 합성된 산화물 분말의 질화처리는 50 sccm로 공급되는 암모니아(NH3) 가스 분위 기에서 600, 650, 700, 750°C(승온속도: 5°C/min)로 10시 간 동안 열처리하여 실시하였다.
- 전구체 용액 내의 Zn과 Ga의 비율을 제어하여 제조된 산 화물 분말과 이를 다양한 조건에서 질화처리하여 얻은 분말 의 결정구조, 형상과 광학적 성질은 각각 X-선 회절분석기 (X-ray diffractometer, XRD, X'Pert3 Powder, PANalytical, Netherlands), 전계 방사형 주사 현미경(field emissionscanning electron microscopy, FE-SEM, JSM-6700F, JEOL, Japan)과 자외선/가시광선 분광광도계(UV-vis spectrophotometer, UV-2600, SHIMADZU, Japan)를 이용하여 분 석하였다. 또한, 질화 처리된 분말의 조성은 에너지 분산 형 X-선 분광법(energy-dispersive X-ray spectroscopy, EDX, JED-2300T, JEOL)을 이용하여 분석하였다.
2. 실험방법
- Fig. 1은 Zn과 Ga 전구체를 각각 1:0, 0.8:0.2, 0.5:0.5, 0.2:0.8 0:1로 제어하여 USP로 합성한 분말의 X-선 회절 분석 결과를 보여준다. Zn 전구체만을 이용하여 합성한 분말(Zn:Ga = 1:0)은 wurtzite ZnO(JCPDS #:36-1451)의 결 정구조를 갖는 것으로 확인되었다. 반면에 Ga 전구체만을 이용해 합성한 분말은 회절 패턴이 관찰되지 않아 비정질 상태로 판단된다. Zn와 Ga 전구체를 모두 포함한 용액으 로 합성한 분말의 결정구조는 Ga 전구체의 농도에 따라 각기 다른 회절 패턴을 보여주었다. 우선 Zn:Ga의 몰 비 가 0.8:0.2를 갖는 용액으로 합성한 분말은 순수한 ZnO의 회절 패턴을 보여주었지만, Ga에 의해 결정화가 억제되어 상대적으로 낮은 결정성을 나타내었다. 또한, Ga과 관련 된 회절 패턴은 관찰되지 않아 Ga과 관련된 산화물의 결 정화는 진행되지 않은 것으로 판단된다. 이와 같은 결정화 도의 감소는 Ga의 몰 분율을 0.5로 증가시킨 용액으로 합 성한 분말에서 더욱 명확하게 관찰되었다. Zn:Ga의 비율 을 0.2:0.8로 제조한 경우, spinel 구조의 ZnGa2O4(JCPDS #:38-1240)의 회절 패턴이 관찰되었다. 일반적으로 ZnGa2O4 상은 Ga/Zn의 원자 비가 최대 2.17 수준에서 형성되는 것 으로 알려져 있다[23]. 따라서 나머지의 Ga은 결정화가 진 행되지 않은 것으로 판단할 수 있다.
- Fig. 2는 USP로 제조된 분말의 낮은 배율과 높은 배율 에서 촬영한 주사전자현미경 사진이며, 조성에 따른 형상 차이를 명확하게 관찰할 수 있다. USP로 제조된 분말의 형상은 다양한 변수에 의해 결정되지만, 초음파에 의해 생 성된 미소 반응기 내 전구체의 분해 거동과 산화물로의 결정화 속도는 분말의 형상을 결정하는 주요 인지이다. ZnO의 경우, 전구체의 종류에 따라 중공 구조(질산 아연 사용)와 주름진 형상(아세트산 아연 사용)의 분말을 선택 적으로 합성할 수 있다고 보고된 바가 있다[21]. 아세트산 아연은 빠른 열분해 후에 결정화가 발생하는데, 급속한 열 분해에 의한 전구체 액적의 수축이 발생한 후 결정화되어 주름진 형상이 형성된다. USP로 제조된 분말 중 Zn 전구 체의 몰 분율이 높은 시편(Zn:Ga=0.8:0.2)의 경우, 위와 같 은 현상으로 인해 주름진 형상을 나타내었고, 0.5:0.5의 비 율을 갖는 분말은 주름진 정도가 상대적으로 줄어든 형상 이었다. 반면에 Ga의 비율이 높은 분말은 전구체의 분해 와 ZnGa2O4로의 결정화가 균형을 이뤄 USP로 제조된 전 형적인 분말의 형상인 구형을 나타내었다. 모든 분말은 수 백 나노미터에서 수 마이크로미터 수준의 입자 크기를 나 타내었다. 각 분말의 조성은 전구체 용액 제조 시 설정한 조성보다 Ga의 몰 분율이 감소하였으며, Zn과 Ga의 비율 이 각각 0.84:0.16, 0.62:0.38, 0.34:0.66으로 확인되었다. 이는 설정된 합성 온도에서 Ga가 충분히 결정화되지 못했 기 때문이라고 판단된다.
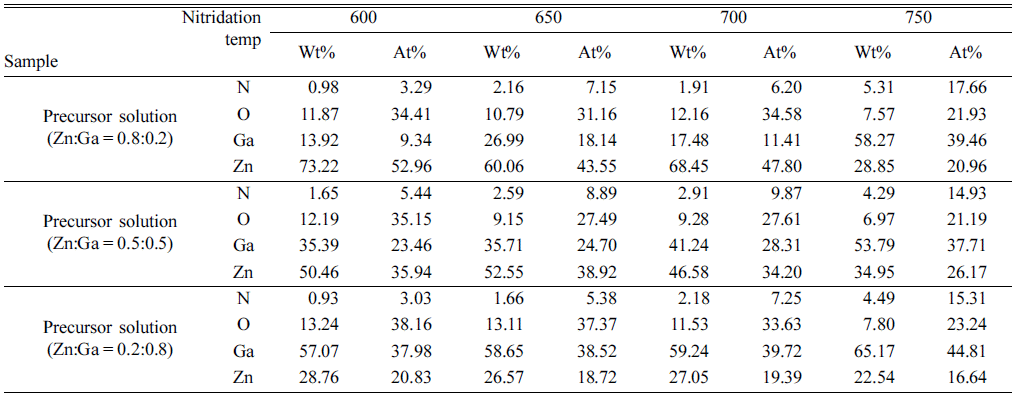
- Fig. 3-5는 USP로 제조한 분말을 질화 처리하여 얻은 분 말의 낮은 배율과 높은 배율에서 촬영한 주사전자현미경 사진을 보여준다. 모든 분말은 질화처리 전과 유사한 형상 과 크기의 입자로 구성되어 있었지만, 일부 조성과 질화처 리 온도 조건에서는 기존과 확연하게 다른 형상과 크기를 나타내었다. 가장 눈에 띄는 변화를 보여주는 분말은 전구 체 용액을 기준으로 Zn과 Ga의 몰 분율을 0.8:0.2로 설정 하여 제조한 산화물 분말을 750°C에서 질화 처리하여 얻 은 것이다. Fig. 3(d)과 3(h)에서 알 수 있듯이, 질화 처리 된 분말은 약 50 nm 수준의 나노입자로 확인되었다. 이러 한 변화는 질화처리 온도가 증가함에 따라 ZnO가 Zn로 환원되어 분해되는 양이 증가하기 때문에 발생한 것으로 설명할 수 있다. Table 1은 각 분말의 질화처리 온도에 따 른 조성 변화를 보여주며, 600°C, 650°C와 700°C에서 처 리한 분말은 산화물 상태와 유사한 몰 분율을 나타내었지 만, 750°C의 질화처리로 인해 Zn의 몰 분율이 약 35% 수 준으로 급격하게 감소한 것을 확인할 수 있다. 질화처리 온도에 따라 감소한 Zn의 몰 분율은 산화물 상태에서 Zn 의 몰 분율이 작을수록 감소하였고, 이에 따라 변환된 분 말의 형상에도 주목할만한 변화를 관찰하기 어려웠다. Fig. 4와 5에서 보여주듯이, 낮은 Zn 몰 분율을 갖는 산화 물에서는 질화처리에 따른 입자의 형상 및 크기가 변화하 는 정도가 상대적으로 낮았고, 산화물 분말의 크기와 형상 을 대부분 유지하는 것으로 확인되었다.
- 상대적으로 큰 폭의 조성 변화가 관찰되었지만, 가장 높 은 Zn의 몰 분율과 주름진 형상에 의해 작은 밴드갭 에너 지와 넓은 비 표면적이 기대되는 Zn과 Ga의 몰 분율 비 가 80:20으로 설정된 전구체 용액으로 합성한 분말로 추 가적인 분석을 진행하였다. Fig. 6은 전술한 분말의 질화 처리 온도에 따른 X-선 회절 분석 결과이다. ZnO와 GaN (JCPDS #:50-0792)은 모두 hexagonal wurtzite 구조이며, 거의 유사한 격자상수를 나타내어 전율 고용체를 형성할 수 있다. 따라서 두 재료는 거의 유사한 X-선 회절 패턴 을 보여주며, (GaN)1-x(ZnO)x의 회절 피크는 ZnO와 GaN 의 회절 피크 사이에서 관찰되는 것이 일반적이다. 또한, (GaN)1-x(ZnO)x에서 Zn의 몰 분율이 증가하여 높은 x를 보 여줄 때는 ZnO의 회절 피크에 가까운 쪽에서 관찰되며, 그 반대의 경우에는 GaN의 회절 피크에 근접하게 된다. Fig. 6에서 알 수 있듯이, 질화처리를 통해 변환된 분말의 회절 패턴은 모두 ZnO와 G aN 회절 패턴 사이에서 관찰 되어 성공적으로 (GaN)1-x(ZnO)x가 형성된 것을 확인할 수 있으며, 높은 온도에서 처리한 분말일수록 GaN의 회절 패 턴에 근접한 것을 알 수 있다. 이는 Table 1에서 확인한 바 와 같이, 질화처리 과정에서 발생하는 ZnO의 환원 및 Zn 의 증발 때문에 Zn의 몰 분율이 감소했기 때문이다.
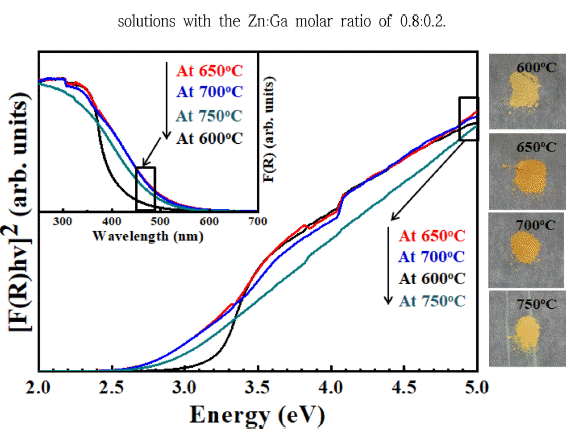
- USP와 질화처리로 합성된 (GaN)1-x(ZnO)x의 광학적 성 질은 자외선/가시광선 분광광도계를 이용하여 분석하였고, 각 분말의 흡광도와 확산 반사율(diffuse reflection)을 Kubelka-Munk식으로 변환한 그래프를 Fig. 7에 나타내었 다[24]. 잘 알려진 바와 같이, ZnO와 GaN의 밴드갭 에너 지는 각각 3.2 eV와 3.4 eV이다. 600°C에서 질화 처리된 분말은 가장 높은 Zn의 몰 분율을 보여주었지만, 흡광 거 동은 전형적인 ZnO의 흡광도와 유사하였고, 밴드갭 에너 지도 ZnO와 흡사한 3.22 eV로 확인되었다. 하지만 일반 적인 ZnO와 다르게 400 nm 이하에서 흡광이 관찰되었으 며, 이로 인해 분말이 노란빛을 나타내었다. 따라서 낮은 질화처리 온도에 따라 (GaN )1-x(ZnO)x의 형성이 원활하지 못했지만, 일부 형성되어 가시광 영역을 흡광하는 것으로 해석할 수 있다. 질화처리 온도를 650°C와 700°C로 설정 해 처리한 분말은 600°C에서 처리한 분말과 비교하여 확 연하게 가시광 영역의 흡광도가 증가한 것을 알 수 있다. 또한, 650°C와 700°C에서 처리된 분말은 각각 약 2.78 eV 과 2.75 eV의 밴드갭 에너지와 진한 주황색을 나타내었다. 이러한 결과는 상대적으로 높은 온도에 의해 (GaN)1-x (ZnO)x 고용체가 잘 형성되었다는 것을 보여준다. 하지만 750°C에서 처리한 분말의 경우, 상대적으로 낮은 온도에 서 처리된 분말보다 흡광 가능한 파장이 낮아졌으며, 밴드 갭 에너지가 약 2.90 eV로 증가하였으며, 분말의 색상도 노란빛을 나타내었다. 이는 EDX 결과에서 보여주듯이, 질 화처리 과정에서 Zn의 분해로 발생한 차이로 설명할 수 있다.
3. 결과 및 고찰
Fig. 1
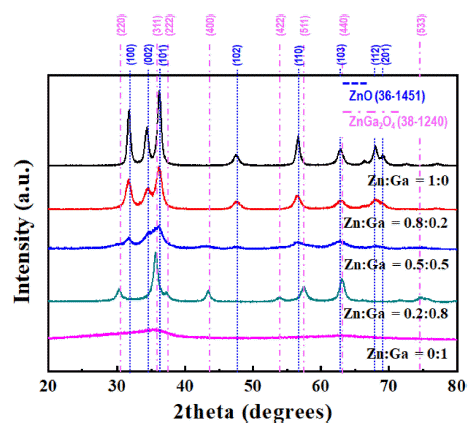
XRD patterns of the powders synthesized by the ultrasonic pyrolysis process with various zinc and gallium mole fractions.

Fig. 2

FE-SEM images of the oxide powders synthesized by the ultrasonic pyrolysis process at 500°C using the precursor solutions with different Zn:Ga molar ratio; (a, d) 0.8:0.2, (b, e) 0.5:0.5 and (c, f) 0.2:0.8.

Fig. 3

FE-SEM images of the powders transformed by a nitridation treatment at (a, e) 600°C, (b, f) 650°C, (c, g) 700°C and (d, h) 750°C from the oxide powder prepared using the precursor solutions with the Zn:Ga molar ratio of 0.8:0.2.

Fig. 4

FE-SEM images of the powders transformed by a nitridation treatment at (a, e) 600°C, (b, f) 650°C, (c, g) 700°C and (d, h) 750°C from the oxide powder prepared using the precursor solutions with the Zn:Ga molar ratio of 0.5:0.5.

Fig. 5

FE-SEM images of the powders transformed by a nitridation treatment at (a, e) 600°C, (b, f) 650°C, (c, g) 700°C and (d, h) 750°C from the oxide powder prepared using the precursor solutions with the Zn:Ga molar ratio of 0.2:0.8.

Table 1
Energy Dispersive X-ray (EDX) Analysis results of the powders transformed by a nitridation treatment at 600°C, 650°C, 700°C and 750°C from the oxide powder prepared using the precursor solutions with the Zn:Ga molar ratio of 0.8:0.2, 0.5:0.5 and 0.2:0.8
|
Fig. 6
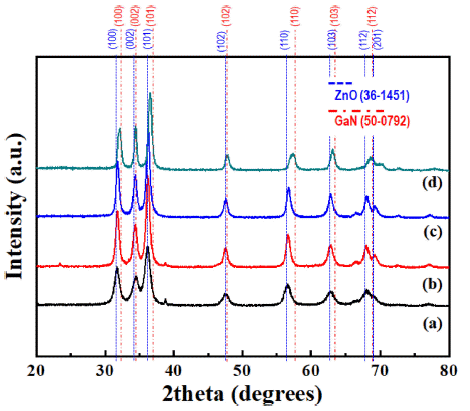
XRD patterns of the powders transformed by a nitridation treatment at (a) 600°C, (b) 650°C, (c) 700°C and (d) 750°C from the oxide powder prepared using the precursor solutions with the Zn:Ga molar ratio of 0.8:0.2.

- 본 연구에서는 다성분계 분말의 조성을 넓은 범위에서 쉽게 제어할 수 있는 USP 공정을 이용하여 다양한 조성 의 Zn-Ga 산화물 분말을 제조하고 이를 암모니아 가스 분 위기에서 질화 처리하여 (GaN )1-x(ZnO)x 나노입자를 성공 적으로 합성하였다. 산화물의 조성에 따라 (GaN)1-x(ZnO)x 로의 변환 과정에서 발생하는 ZnO의 환원 및 분해 거동 이 명확하게 구별되어 변환된 분말의 형상 및 크기의 차 이가 발생하였다. 초기 전구체 조성으로 Zn와 Ga의 비율 을 0.8:0.2로 설정한 용액으로부터 합성한 분말은 700°C에 서의 질화처리를 통해 초기 설정한 몰 분율과 유사한 약 0.8 수준의 Zn로 구성된 것을 확인하였다. 또한, (GaN)1-x (ZnO)x의 X-선 회절 패턴을 나타내었으며, 가시광선의 강 한 흡광과 약 2.78 eV의 밴드갭 에너지를 보여주어 수소 생산 광촉매로의 활용 가능성을 확인할 수 있었다.
4. 결 론
-
Acknowledgements
- 이 연구는 서울과학기술대학교 교내연구비의 지원으로 수행되었습니다.
감사의 글
- 1. B. Liu, J. Li, W. Yang, X. Zhang, X. Jiang and Y. Bando: Small, 13 (2017) 1701998..ArticlePubMed
- 2. L. W. Yin and S. T. Lee: Nano Lett., 9 (2009) 957..ArticlePubMed
- 3. B. Liu, Y. Bando, L. Liu, J. Zhao, M. Masanori, X. Jiang and D. Golberg: Nano Lett., 13 (2013) 85..ArticlePubMed
- 4. J. N. Hart and N. L. Allan: Adv. Mater., 25 (2013) 2989..ArticlePubMed
- 5. Z. Deng, H. Yan and Y. Liu: J. Am. Chem. Soc., 131 (2009) 17744..ArticlePubMed
- 6. Y. Wang, J. Xu, P. Ren, Q. Zhang, X. Zhuang, X. Zhu, Q. Wan, H. Zhou, W. Hu and A. Pan: Phys. Chem. Chem. Phys., 15 (2013) 2912..ArticlePubMed
- 7. K. Maeda, T. Takata, M. Hara, N. Saito, Y. Inoue, H. Kobayashi and K. Domen: J. Am. Chem. Soc., 127 (2005) 8286..ArticlePubMed
- 8. T. Hisatomi, J. Kubota and K. Domen: Chem. Soc. Rev., 43 (2014) 7520..ArticlePubMed
- 9. J. Kou, Z. Li, Y. Guo, J. Gao, M. Yang and Z. Zou: J. Mol. Catal. A: Chem., 325 (2010) 48..Article
- 10. A. Wu, J. Li, B. Liu, W. Yang, Y. Jiang, L. Liu, X. Zhang, C. Xiong and X. Jiang: Dalton Trans., 46 (2017) 2643..ArticlePubMed
- 11. K. Lee, B. M. Tienes, M. B. Wilker, K. J. Schnitzenbaumer and G. Dukovic: Nano Lett., 12 (2012) 3268..ArticlePubMed
- 12. C. H. Chuang, Y. G. Lu, K. Lee, J. Ciston and G. Dukovic: J. Am. Chem. Soc., 137 (2015) 6452..ArticlePubMed
- 13. K. Lee, Y. G. Lu, C. H. Chuang, J. Ciston and G. Dukovic: J. Mater. Chem. A, 4 (2016) 2927..Article
- 14. J. Li, B. Liu, W. Yang, Y. Cho, X. Zhang, B. Dierre, T. Sekiguchi, A. Wu and X. Jiang: Nanoscale, 8 (2016) 3694..ArticlePubMed
- 15. K. Maeda, K. Teramura and K. Domen: J. Catal., 254 (2008) 198..Article
- 16. Y. Asakura, Y. Nishimura, Y. Masubuchi and S. Yin: Eur. J. Inorg. Chem., 2019 (2019) 1999..Article
- 17. Y.-L. Hu, S. Wang, Z. Zhang, Q. Luo, S. Xiang, Y. Deng, H. Ji, J. Huang, L. Sun, D. Wang and T. Ma: Inorg. Chem., 59 (2020) 7012..ArticlePubMed
- 18. Y. Hwangbo and Y.-I. Lee: J. Alloys Compd., 771 (2019) 821..Article
- 19. J.-H. Yoo, M. Ji, J. H. Kim, C.-H. Ryu and Y.-I. Lee: J. Photochem. Photobiol. A: Chem., 401 (2020) 112782..Article
- 20. J. H. Bang and K. S. Suslick: Adv. Mater., 22 (2010) 1039..ArticlePubMed
- 21. Y. Choi and Y.-I. Lee: J. Korean Ceram. Soc., 55 (2018) 261..Article
- 22. M.-J. Ji, J.-H. Yoo and Y.-I. Lee: J. Korean Powder Metall. Inst., 25 (2018) 482..Article
- 23. Z. Galazka, S. Ganschow, R. Schewski, K. Irmscher, D. Klimm, A. Kwasniewski, M. Pietsch, A. Fiedler, I. Schulze-Jonack, M. Albrecht, T. Schröder and M. Bickermann: APL Mater., 7 (2019) 022512..Article
- 24. P. Kubelka and F. Munk: Z. Tech. Phys., 12 (1931) 59..
Figure & Data
References
Citations
Citations to this article as recorded by 

Synthesis and Optical Property of (GaN)1-x(ZnO)x Nanoparticles Using an Ultrasonic Spray Pyrolysis Process and Subsequent Chemical Transformation
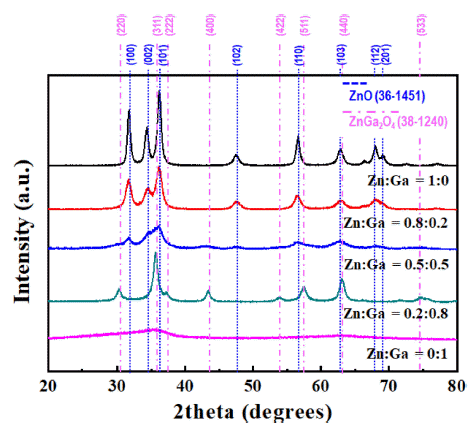




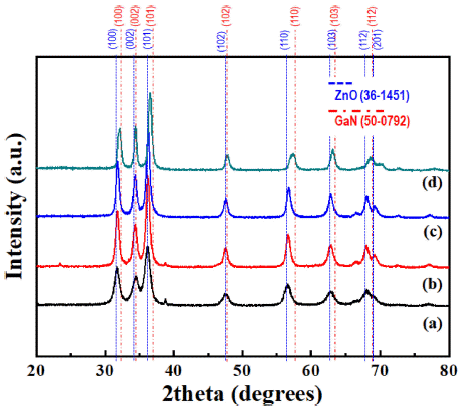
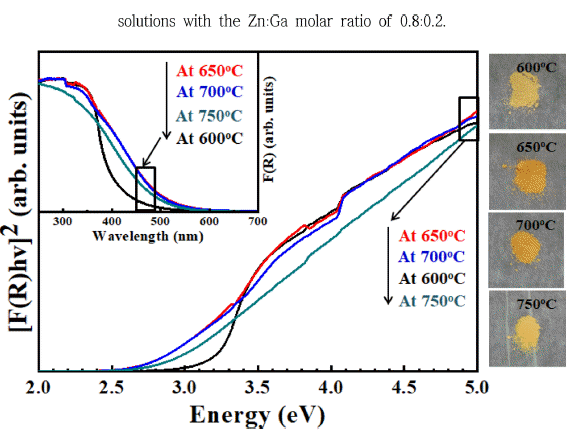
Fig. 1
XRD patterns of the powders synthesized by the ultrasonic pyrolysis process with various zinc and gallium mole fractions.
Fig. 2
FE-SEM images of the oxide powders synthesized by the ultrasonic pyrolysis process at 500°C using the precursor solutions with different Zn:Ga molar ratio; (a, d) 0.8:0.2, (b, e) 0.5:0.5 and (c, f) 0.2:0.8.
Fig. 3
FE-SEM images of the powders transformed by a nitridation treatment at (a, e) 600°C, (b, f) 650°C, (c, g) 700°C and (d, h) 750°C from the oxide powder prepared using the precursor solutions with the Zn:Ga molar ratio of 0.8:0.2.
Fig. 4
FE-SEM images of the powders transformed by a nitridation treatment at (a, e) 600°C, (b, f) 650°C, (c, g) 700°C and (d, h) 750°C from the oxide powder prepared using the precursor solutions with the Zn:Ga molar ratio of 0.5:0.5.
Fig. 5
FE-SEM images of the powders transformed by a nitridation treatment at (a, e) 600°C, (b, f) 650°C, (c, g) 700°C and (d, h)
750°C from the oxide powder prepared using the precursor solutions with the Zn:Ga molar ratio of 0.2:0.8.
Fig. 6
XRD patterns of the powders transformed by a nitridation treatment at (a) 600°C, (b) 650°C, (c) 700°C and (d) 750°C from the oxide powder prepared using the precursor solutions with the Zn:Ga molar ratio of 0.8:0.2.
Fig. 7
(Inset) UV-Vis diffuse absorption spectra and the plots of the transformed Kubelka-Munk function versus the absorbed light energy of (GaN)1-x(ZnO)x powders transformed at 600°C, 650°C, 700°C and 750°C.
Fig. 1
Fig. 2
Fig. 3
Fig. 4
Fig. 5
Fig. 6
Fig. 7
Synthesis and Optical Property of (GaN)1-x(ZnO)x Nanoparticles Using an Ultrasonic Spray Pyrolysis Process and Subsequent Chemical Transformation
Table 1
Energy Dispersive X-ray (EDX) Analysis results of the powders transformed by a nitridation treatment at 600°C, 650°C, 700°C
and 750°C from the oxide powder prepared using the precursor solutions with the Zn:Ga molar ratio of 0.8:0.2, 0.5:0.5 and 0.2:0.8
Table 1
TOP
 KPMI
KPMI

 ePub Link
ePub Link Cite this Article
Cite this Article







