Articles
- Page Path
- HOME > J Korean Powder Metall Inst > Volume 27(5); 2020 > Article
-
ARTICLE
수열반응을 이용한 침상형 5Mg(OH)2·MgSO4·3H2O 합성에 대한 H2SO4와 반응 시간의 영향 - 최아름a,b, 오누리b, 김유진a,*
- Effect of H2SO4 and Reaction Time on Synthesis of 5Mg(OH)2∙MgSO4∙3H2O Whiskers using Hydrothermal Reaction
- Areum Choia,b, Nuri Ohb, YooJin Kima,*
-
Journal of Korean Powder Metallurgy Institute 2020;27(5):401-405.
DOI: https://doi.org/10.4150/KPMI.2020.27.5.401
Published online: September 30, 2020
a 한국세라믹기술원 엔지니어링세라믹센터
b 한양대학교 신소재공학과
a Engineering Ceramic Center; Korea Institute of Ceramic Engineering & Technology, Icheon, Republic of Korea
b Division of Materials Science & Engineering, Hanyang University, Seoul, Republic of Korea
- *Corresponding Author: YooJin Kim, TEL: +82-31-645-1427, FAX: +82-31-645-1420, E-mail: yjkim@kicet.re.kr
- - 최아름: 학생, 오누리: 교수, 김유진: 책임연구원
• Received: October 5, 2020 • Revised: October 22, 2020 • Accepted: October 23, 2020
© The Korean Powder Metallurgy Institute. All rights reserved.
- 1,034 Views
- 2 Download
- 3 Crossref
Abstract
- Magnesium hydroxide sulfate hydrate (MHSH) whiskers were synthesized via a hydrothermal reaction by using MgO as the reactant as well as the acid solution. The effects of the H2SO4 amount and reaction time at the same temperature were studied. In general, MHSH whiskers were prepared using MgSO4 in aqueous ammonia. In this work, to reduce the formation of impurities and increase the purity of MHSH, we employed a synthesis technique that did not require the addition of a basic solution. Furthermore, the pH value, which was controlled by the H2SO4 amount, acted as an important factor for the formation of high-purity MHSH. MgO was used as the raw material because it easily reacts in water and forms Mg+ and MgOH+ ions that bind with SO4 2- ions to produce MHSH. Their morphologies and structures were determined using X-ray diffraction (XRD) and scanning electron microscopy (SEM).
- 침상형 5Mg(OH)2∙MgSO4∙3H2O(513MHSH)은 건축 자 재와 플라스틱 시장에서 석면의 대체재로 주목받고 있으 며, 물 분자가 포함되어 있어 열을 가할 시 수화물이 탈수 화 되면서 흡열반응이 일어나기 때문에 난연재로 사용될 수 있다[1, 2]. 게다가, 고유의 탄성력 때문에 필러나 고무 마찰재로 응용이 가능하다[3, 4].
- 일반적으로 침상형 513MHSH는 MgO와 MgSO4 두가지 전구체로 염기성 조건하에 수열반응으로 합성된다[5-7]. 이전에 우리 연구팀은 MgO, MgSO4∙7H2O 두 가지 종류의 전구물질의 비율을 조절하여 침상형 513MHSH를 합성하 였다[8, 9]. 이를 통해 513MHSH 생성에 중요한 요소인 pH의 영향을 확인하였으며, pH가 높은 경우 합성이 어렵 다. 따라서, NaOH보다 pH 조절에 용이한 약염기인 NH4OH를 사용하여 고순도 513MHSH 합성이 가능하다[8, 10]. 또한, 단일 전구체인 MgSO4∙7H2O의 one step 공정으 로 합성이 가능하며, NH4OH의 첨가량만으로 침상형 513MHSH 순도를 제어할 수 있다[8, 10]. 하지만 수용액상 에서 OH-농도가 높을 경우에는 Mg2+와 반응하여 불순물 인 판상형의 Mg(OH)2가 형성되기 때문에 염기성 용매를 사용할 경우 균일한 형상의 MHSH를 조제하기에 어려움 이 있다[11]. 또한, SO42-이온의 양이 너무 적은 경우에도 Mg(OH)2가 형성되기 때문에 SO42-이온은 침상형으로 성 장하는데 중요한 요인으로 작용한다[9]. 따라서, 이번 연구 에서는 염기 용액 NH4OH가 아닌 산 용액 H2SO4을 사용 하여 513MHSH의 순도를 제어하였다.; ~(1), (2), (3)[8].
- 본 연구에서는 한가지의 출발물질, MgO를 사용하였으 며 H2SO4 용액으로 SO42-이온의 양 즉, pH를 조절하였다. 또한, Mg(OH)2 대신에 MgO를 사용하였는데, MgO는 물 속에서 쉽게 반응하여 Mg+와 MgOH+이온을 형성하게 되 며 이러한 형태의 이온들은 우선적으로 SO42-이온과 결합 하기 때문이다[12, 13]. 전구체인 MgO의 농도, pH, 반응 시간을 조절하여 불순물 Mg(OH)2의 형성을 억제하고 고 순도의 513MHSH를 얻고자 하였다.
1. 서 론
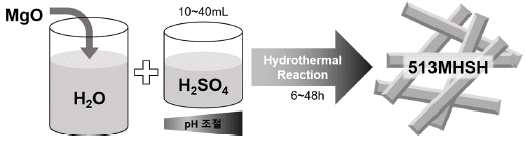
- 본 연구에서는 출발물질로 산화 마그네슘(MgO), 황산 (H2SO4), 증류수를 사용하여 침상형 마그네슘 화합물(513 MHSH)을 제조하였다. 증류수 50 mL에 MgO 분말을 넣어 4 M MgO 수용액을 제조하고 30분간 교반 한 후, 5 M H2SO4 수용액을 제조한 뒤 10~40 mL로 조절하여 첨가하 였다. 혼합 용액을 100mL 용량의 수열합성 용기에 옮겨 담은 후 140oC에서 6~48시간동안 합성을 진행한다. 반응 이 끝난 후 상온까지 냉각 후 원심분리를 이용하여 침전 물을 수득한 후 증류수로 수차례 세척하여 50°C 건조오븐 에서 건조한다. 수득한 생성물은 형상 및 구조를 전자주사 현미경(SEM, Model JSM-6390, JEOL, Japan)과 X-ray 회 절분석기기(XRD, Model D/max 2500, Riguaku, Japan)로 평가하였다.
2. 실험방법
- 3.1. Influence of Reactant on the Formation of 513MHSH
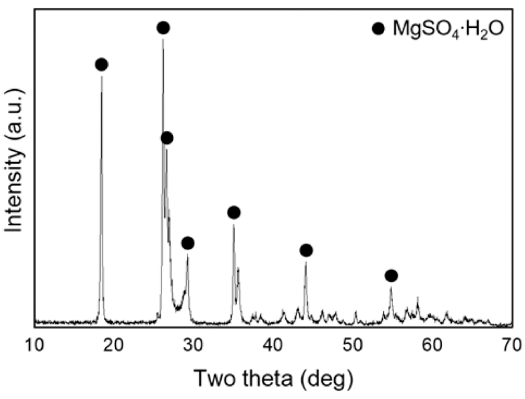
- 그림 2는 4M MgO 수용액에 H2SO4 양을 조절하여 140°C에서 24시간동안 합성한 물질의 XRD 분석 결과와 SEM 이미지다. 5M H2SO4 수용액이 10mL 첨가되었을 경우 Mg(OH)2 단일상이 합성되었고(그림 2(a(1))), 판상형 응집체 형태로 존재함(그림 2(b(1)))을 확인하였다. 20 mL 일 때는 Mg(OH)2와 513MHSH가 섞여 있었으며(그림 2(a(2))) 30 mL를 넣었을 때는 대부분 침상형 513MHSH가 형성되었다(그림 2(a(3))). 40 mL를 넣었을 때는 혼합물이 투명해지며 수득물이 관찰되지 않았다. 위 실험 결과를 통 해 황산의 양이 많을수록, 즉, pH 8에서 pH 12까지 약염 기 범위 내에서 pH가 낮을수록 불순물인 Mg(OH)2가 사 라지고 순수한 513MHSH가 형성됨을 알 수 있다. H2SO4 의 양이 적을 경우, 상대적으로 SO42-농도가 낮아져 수열 반응이 진행되는 동안 생성되는 중간 생성물인 Mg2+, MgOH+가 SO42-이온과 반응하기보다는 OH-이온과 반응 하여 Mg(OH)2가 형성된다. 그러나, H2SO4가 과도하게 첨 가되어 수용액 내 MgO와 H2SO4의 몰 비가 6:1 이하가 되 면 수득물을 얻을 수 없었다. 수용액이 투명해지고 pH 2 이하로 낮아지는데 이는 물에 잘 용해되는 MgSO4가 형성 되었음을 알 수 있으며 XRD로 확인하였다(그림 3).
- 3.2. Influence of Reaction Time on the Formation of 513MHSH
- 위의 실험에서는 모두 24시간동안 수열반응을 통해 수 득물이 생성되었다. 4M MgO 수용액에 H2SO4를 30mL를 넣고 24시간동안 수열반응을 진행하였을 때 513MHSH 단일상이 나왔으며, 같은 수용액에 H2SO4를 20mL 넣은 경우에는 Mg(OH)2와 513MHSH가 섞인 수득물이 관찰되 었다. 반응 시간에 따른 수득물을 확인하기위해 동일한 조 건에서 시간만 바꾸어 실험해보았다.
- 앞서 말했듯이 4M MgO 수용액에 5M H2SO4 수용액 30 mL을 넣은 후 24시간동안 수열반응을 진행하였을 때, 순수한 침상형이 나왔으며 12시간 반응하였을 때는 Mg(OH)2와 513MHSH가 섞여 나왔으며, 6시간 동안 반응 하였을 때도 섞여 나왔지만 513MHSH에 비해 Mg(OH)2 가 증가하였다. (그림 4) 시간이 짧아질수록 불순물인 Mg(OH)2가 증가하고 513MHSH의 생성이 감소함을 알 수 있다.
- 24시간 반응했을 때 Mg(OH)2와 513MHSH가 섞여 나온 조건의 시간을 48시간으로 증가했을 때, Mg(OH)2가 사라 지고 513MHSH만 수득 된 것을 볼 수 있다(그림 5(a, c)). 48시간 반응을 통해 얻어진 513MHSH는 침상형으로 길이 10~30 μm 범위를 가졌다(그림 5(b)). 시간이 증가할수록 불순물인 Mg(OH)2의 결정상은 점차 사라지고 513MHSH 가 생성되었다. Mg2+, MgOH+ 이온들이 OH-와 반응하여 Mg(OH)2가 되더라도 반응시간이 길어질수록 SO42-이온과 배위되어 침상형 513MHSH를 얻을 수 있다[8]. H2SO4 수 용액을 20 mL 넣었을 경우에는 반응 시간 48시간일 때 고순도의 침상형MHSH를 얻을 수 있었지만 H2SO4 수용 액을 30 mL 넣었을 경우에는 반응 시간이 24시간일 때 이미 순수한 침상형 513MHSH를 얻을 수 있었으며, 20 mL 넣었을 경우의 48시간 반응 결과와 비교가 될 수 있다.
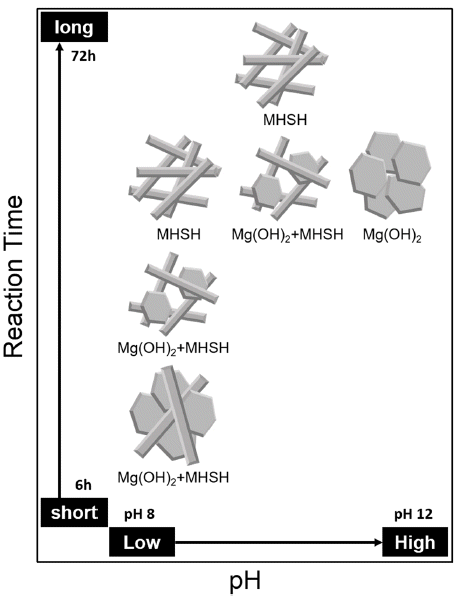
- 그림 6은 실험조건에 대한 생성물의 변화를 나타냈다. pH가 높을수록 Mg(OH)2가 생성되며, pH가 상대적으로 높더라도 시간이 길어질수록 침상형 513MHSH가 생성되 는 것을 알 수 있다.
3. 실험 결과
Fig. 2
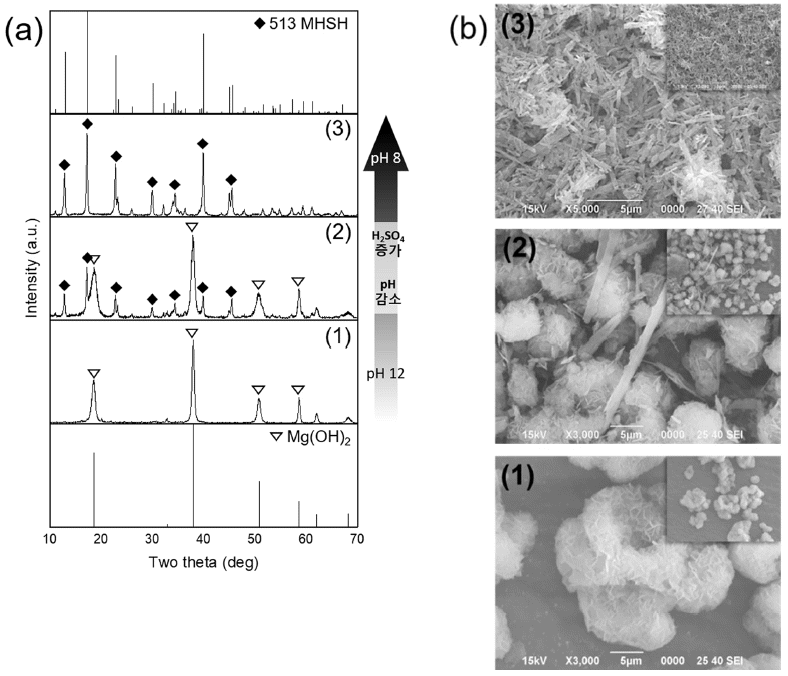
(a) XRD patterns of the products synthesized with 4M MgO at different H2SO4 solution: (1) 10 mL, (2) 20 mL and (3) 30 mL. (b) SEM images of the products synthesized with 4M MgO at different H2SO4 solution : (1) 10mL, (2) 20mL and (3) 30 mL.

Fig. 4
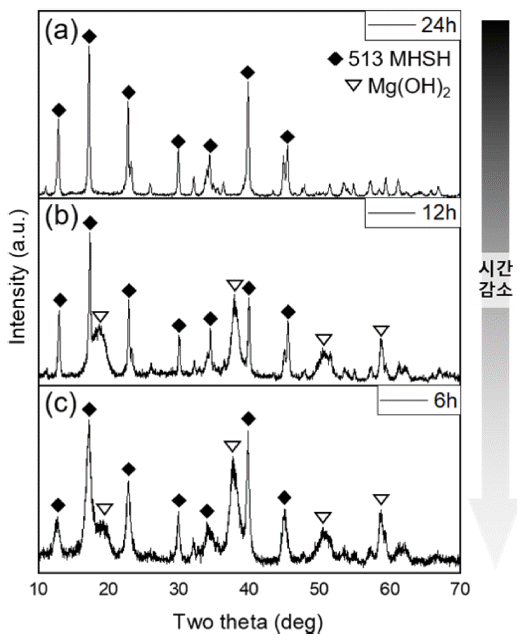
XRD patterns of the products synthesized with 4M MgO and H2SO4 30 mL at different reaction times: (a) 24 h, (b) 12 h, (c) 6 h.

Fig. 5
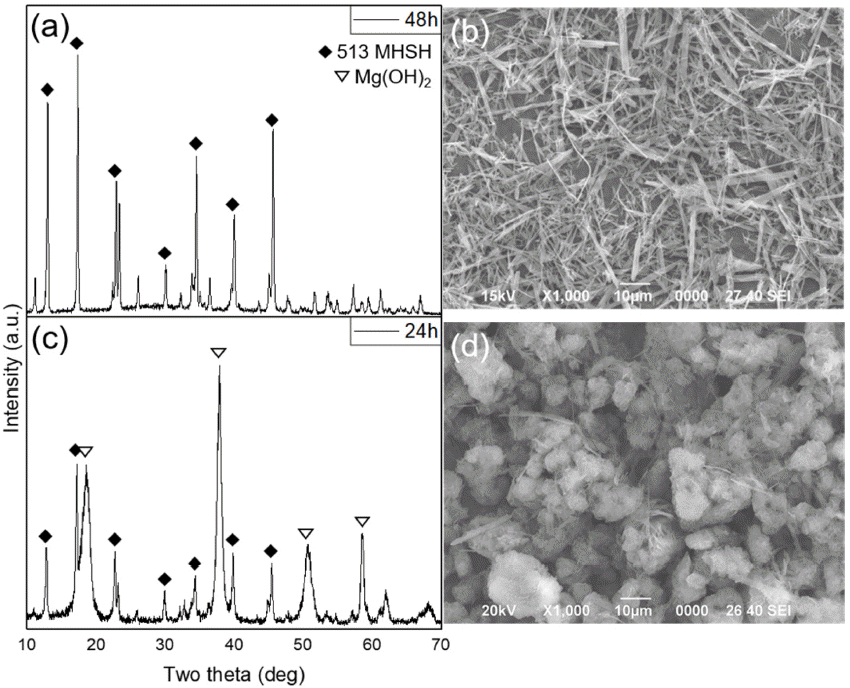
XRD patterns and SEM images of the products synthesized with 4M MgO and H2SO4 20 mL at different reaction times: (a) and (b) 48h, (c) and (d) 24 h.

- 본 연구에서는 염기 용액이 아닌 산 용액으로 pH를 조 절하여 수열반응으로 513MHSH를 합성하였다. OH-의 농 도가 높을수록, SO42-의 농도가 낮을수록 불순물인 Mg(OH)2가 생성되기 때문에 H2SO4를 사용하였으며, 물 속에서 SO42-이온과 우선적으로 결합하는 Mg+와 MgOH+ 이온을 형성하는 MgO를 단일 전구물질로 사용하였다. pH가 낮을수록 513MHSH의 비율이 높아지는 경향을 보 였지만 일정 수준 이상인 경우 수용액이 투명해지면서 수 득물이 생성되지 않았다. 또한, 513MHSH와 Mg(OH)2가 혼재되어 있는 경우, 반응 시간을 증가시키면 불순물인 Mg(OH)2가 사라지고 순수한 침상형 513 MHSH를 얻을 수 있었다.
4. 결 론
-
Acknowledgements
- This work was supported by the Industry Core Technology Development Program (10052730) funded by the Ministry of Trade, Industry and Energy (MOTIE), Republic of Korea.
Acknowledgement
- 1. H. Lu, Y. Hu, L. Yang, Z. Wang, Z. Chen and W. Fan: Macromol. Mater. Eng., 289 (2004) 984. .Article
- 2. C. Gao, X. Li, L. Feng, Z. Xiang and D. Zhang: Chem. Eng. J., 150 (2009) 551. .Article
- 3. H. Iwanaga, T. Iwasaki, K. Reisen, T. Matusunami, M. Ichihara and S. Takeunchi: J. Am. Ceram. Soc., 75 (1992) 1297. .Article
- 4. H. Lu, Y. Hu, J. Xiao, Z. Wang, Z. Chen and W. Fan: J. Mater. Sci., 41 (2006) 363. .Article
- 5. L. Xiang, F. Liu, J. Li and Y. Jin: Mater. Chem. Phys., 87 (2004) 424. .Article
- 6. J. Li, L. Xiang and Y. Jin: J. Mater. Sci., 41 (2006) 1345. .Article
- 7. X. T. Sun, W. T. Shi and W. C. Zhu: Nanoscale Res. Lett., 3 (2008) 386. .ArticlePMC
- 8. R. Yu, J. H. Pee, H. T. Kim, K. J. Kim, Y. W. Kim, W. Kim and Y. Kim: J. Korean Powder Metall. Inst., 18 (2011) 283. .Article
- 9. R. Yu, J. H. Pee, H. T. Kim and Y. Kim: J. Korean Ceram. Soc., 50 (2013) 201. .Article
- 10. R. Yu and J. Kim: J. Korean Powder Metall. Inst., 26 (2019) 195. .Article
- 11. C. Henrist, J. P. Mathieu, C. Vogels, A. Rulmont and R. Cloots: J. Cryst. Growth, 249 (2003) 321. .Article
- 12. X. Yan, D. Xu and D. Xue: Acta Mater., 55 (2007) 5747. .Article
- 13. H. Watanabe, S. Iwata, K. Hashimoto, F. Misaizu and K. Fuke: J. Am. Chem. Soc., 117 (1995) 755. .Article
Figure & Data
References
Citations
Citations to this article as recorded by 

- Synthesis and Morphology Control of Needle Type 513 MHSH and Mg(OH)2 from Dolomite
Jiyeon Kim, HyunSeung Shim, Seong-Ju Hwang, YooJin Kim
Journal of Powder Materials.2025; 32(5): 399. CrossRef - Study of SiO2 coating and carboxylic surface-modification on Mg-based inorganic fiber by one-step reflux reaction
Minsol Park, Areum Choi, Seiki Kim, Wooyoung Shim, YooJin Kim
Journal of the Korean Ceramic Society.2022; 59(6): 869. CrossRef - Effect of sulfate ion on synthesis of 5 Mg(OH)2·MgSO4·3H2O whiskers using non-hydrothermal method with acid catalyst
Areum Choi, Nuri Oh, YooJin Kim
Journal of the Korean Ceramic Society.2022; 59(2): 224. CrossRef
Effect of H2SO4 and Reaction Time on Synthesis of 5Mg(OH)2∙MgSO4∙3H2O Whiskers using Hydrothermal Reaction

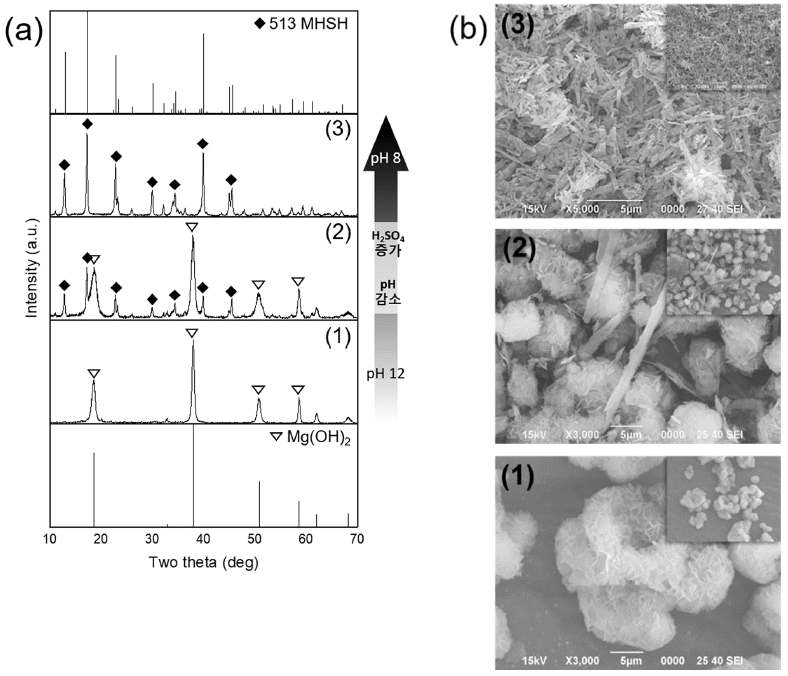
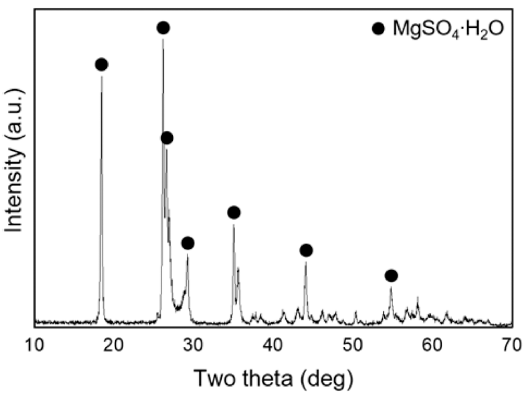
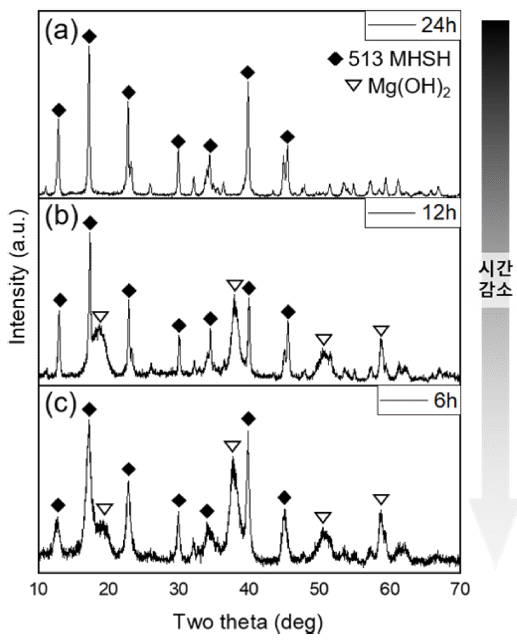

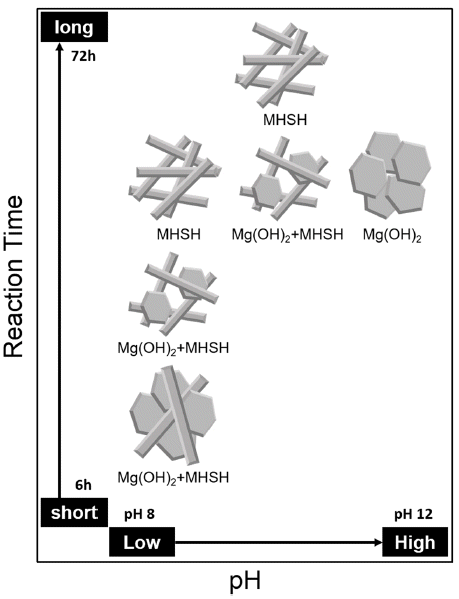
Fig. 1
Schematic diagram of the synthesis of 513MHSH by hydrothermal method.
Fig. 2
(a) XRD patterns of the products synthesized with 4M MgO at different H2SO4 solution: (1) 10 mL, (2) 20 mL and (3) 30 mL. (b) SEM images of the products synthesized with 4M MgO at different H2SO4 solution : (1) 10mL, (2) 20mL and (3) 30 mL.
Fig. 3
XRD patterns of the product synthesized with 4M MgO and 40 mL H2SO4 solution
Fig. 4
XRD patterns of the products synthesized with 4M MgO and H2SO4 30 mL at different reaction times: (a) 24 h, (b) 12 h, (c) 6 h.
Fig. 5
XRD patterns and SEM images of the products synthesized with 4M MgO and H2SO4 20 mL at different reaction times: (a) and (b) 48h, (c) and (d) 24 h.
Fig. 6
Synthetic scheme of the 513MHSH.
Fig. 1
Fig. 2
Fig. 3
Fig. 4
Fig. 5
Fig. 6
Effect of H2SO4 and Reaction Time on Synthesis of 5Mg(OH)2∙MgSO4∙3H2O Whiskers using Hydrothermal Reaction
TOP
 KPMI
KPMI

 Cite this Article
Cite this Article






