Articles
- Page Path
- HOME > J Korean Powder Metall Inst > Volume 23(5); 2016 > Article
-
Article
TiO2 분말 합성을 위한 Ammonium Hexafluofide Titanate의 열적 거동 연구 - 이덕희, 박재량, 이찬기, 박경수*, 김현모a
- Study on thermal behavior of Ammonium Hexafluofide Titanate for Synthesis of TiO2 Powders
- Duk-Hee Lee, Jae-Ryang Park, Chan-Gi Lee, Kyung-Soo Park*, Hyeon-Mo Kima
-
Journal of Korean Powder Metallurgy Institute 2016;23(5):353-357.
DOI: https://doi.org/10.4150/KPMI.2016.23.5.353
Published online: September 30, 2016
고등기술연구원 신소재공정센터
주)모노리스
Advanced Materials & Processing Center, Institute for Advanced Engineering, Gyeonggi-do 17180, Korea
a Monolith Co. Ltd., Seocho-gu 1364, Seoul, Korea
- * Corresponding Author: Kyung-Soo Park, TEL: +82-31-330-7422, FAX: +82-31-330-7116, E-mail: kspark@iae.re.kr
• Received: August 4, 2016 • Revised: August 24, 2016 • Accepted: August 31, 2016
© The Korean Powder Metallurgy Institute. All rights reserved.
- 603 Views
- 1 Download
- 1 Crossref
Abstract
- In this study, TiO2 powders are synthesized from ammonium hexafluoride titanate (AHFT, (NH4)2TiF6) as a precursor by heat treatment. First, we evaluate the physical properties of AHFT using X-ray diffraction (XRD), particle size analysis (PSA), thermogravimetric analysis (TGA), and field-emission scanning electron microscopy (FESEM). Then, to prepare the TiO2 powders, is heat-treated at 300-1300°C for 1 h. The ratio of anatase to rutile phase in TiO2 is estimated by XRD. The anatase phase forms at 500°C and phase transformation to the rutile phase occurs at 1200°C. Increase in the particle size is observed upon increasing the reaction temperature, and the phase ratio of the rutile phase is determined from a comparison with the calculated XRD data. Thus, we show that anatase and rutile TiO2 powders could be synthesized using AHFT as a raw material, and the obtained data are utilized for developing a new process for producing high-quality TiO2 powder.
- TiO2는 산화력이 크고 인체에 무해하며 가시광선과 근 자외선 영역에서 높은 투과율 및 굴절률을 가지는 화학적 으로 매우 안정한 물질로써 안료, 광촉매, 자외선차단제 등의 산업 분야에 널리 사용되고 있을 뿐만 아니라 학문 적인 측면에서도 활발하게 연구가 진행되고 있는 금속산 화물이다[1-3]. 이러한 TiO2는 결정구조 및 물리화학적 특 성에 따라 anatase, rutile, brookite의 3가지 상으로 분류될 수 있지만, brookite의 경우 상 자체가 매우 불안정하며 고 온 합성이 어렵기 때문에 산업적으로 사용이 어려워 일반 적으로 TiO2를 산업적으로 분류할 때에는 anatase와 rutile 로 나뉘어진다. Anatase 상은 높은 밴드갭(band-gap), 광활 성도, 강한 산화력 때문에 우수한 광촉매로써 환경 정화 분야 및 태양전지에 응용되고 있다[4-5]. 반면, rutile은 고 온 안정상으로써 높은 반사율 및 굴절률, 우수한 착색력, 화학적 안정성 때문에 안료나 코팅용으로 광범위하게 사 용되는 물질이다[6].
- 일반적으로 TiO2는 황산법[7], 염소법[8], 수열합성법[9- 10], 졸-겔법[11-12] 등과 같은 공정을 통해 타이타늄광 및 타이타늄염 또는 알콕사이드(alkoxide) 용액으로부터 제조 되고 있다. 우선, 황산법은 대량생산에는 유리하나 가혹한 분쇄 공정 및 고농도 황산의 사용으로 인해 많은 공정이 요구되며 그 과정에서 불순물의 혼입으로 최종 제품의 품 질이 크게 저하되는 문제가 있다. 염소법은 비교적 고순도 rutile TiO2의 제조 및 제품의 품질이 우수하다는 장점이 있지만 rutile sand와 같은 원료 공급이 한정적이고 반응 중 발생하는 부식성 가스(HCl, Cl2)로 인해 독성과 안정성 이 문제된다. 수열합성법 역시 출발물질로 염소화합물 (TiCl4, TiOCl2)을 포함하고 있어 합성 후에도 제거가 어렵 고 물성을 떨어드리는 단점이 있다. 가수분해 반응 및 열 처리 공정을 통해 TiO2를 제조하는 졸-겔법은 고순도의 작은 크기 입자 생성 및 박막 코팅에 유용하다는 장점이 있지만 고가의 원료 사용으로 인해 제품 단가가 높다는 결함을 가지고 있다. 따라서, 기존 TiO2 합성 공정의 문제 점을 개선하기 위한 다양한 연구가 진행되고 있지만 효과 가 미비한 실정이기 때문에 경제성과 안정성을 갖는 새로 운 공정 개발이 필요하다. 더욱이, TiO2의 경우 상변화 특 성에 대한 연구 및 해석이 다양한 산업 분야에 적용하기 위해 매우 중요한 부분이므로 새로운 공정 설계에 앞서 선행되어야 할 부분이라 할 수 있다.
- 본 연구는 새로운 공정에 의해 TiO2 분말을 생산하기 위 한 기초 단계로써 TiO2 분말을 제조하기 위해 전구체인 ammonium hexafluoride titanate (AHFT, (NH4)2TiF6)를 원 료로 사용하여 다양한 열처리 온도에 따른 상 변화 거동 을 파악하였고 합성된 분말을 여러 특성분석 방법을 통해 분석하였다. 이러한 결과를 바탕으로 간단한 공정을 통해 anatase 및 rutile 상의 TiO2를 제조할 수 있음에 대한 가능 성을 제시하고자 한다.
1. 서 론
- 2.1. 원료 및 TiO2 합성
- 본 연구에서 TiO2 분말을 제조하기 위한 실험 과정을 그 림 1에 나타내었다. 전구체로 사용된 AHFT (purity: 99.6%, size: ~500 μm)는 중국으로부터 수입된 것이며 분쇄를 통 해 분말화시킨 후 추가적인 정제과정 없이 원료로 사용하 였다. AHFT의 열처리 온도에 따른 상변화 거동을 확인하 기 위해 분쇄된 원료 5 g을 알루미나 도가니에 넣고 박스 로에 주입하여 열처리를 실시하였다. 열처리 온도는 300~1300°C (승온속도: 5°C/min)로 변화시켰으며, 모든 열 처리는 대기 분위기에서 1시간 동안 수행되었다.
- 2.2. 분석
- 원료인 AHFT 및 열처리된 시료들의 결정 분석을 위해 서 X선 회절 분석기(XRD, XRD-6100F, Shimadzu)를 이 용하였다. 시료의 미세구조 및 조성은 주사전자현미경 (FE-SEM & EDS, JSM-6700F, JEOL)을 사용하여 분석하 였고, 입도분석 측정기(PSA, Microtrac Bluewave, Dream corp.)를 이용하여 원료의 입자크기 분포도를 측정하였다. 또한, 원료의 상변화에 따른 열적인 거동을 알아보기 위해 열중량분석기(TGA, DTG-60H, Shimadzu)를 이용하여 상 온에서 800°C까지(승온속도: 5°C/min) 대기 분위기에서 분석을 실시하였다.
2. 실험방법
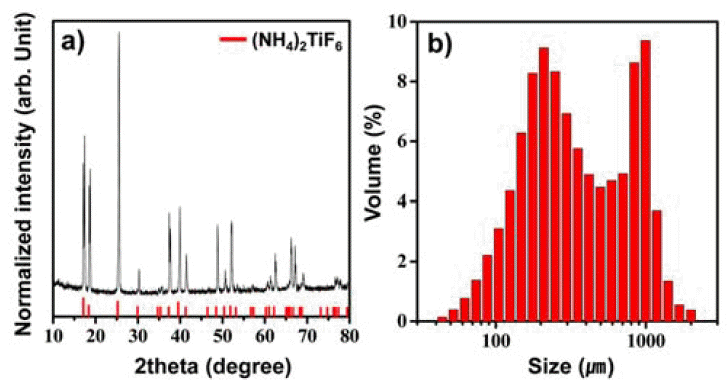
- TiO2 분말 제조를 위해 원료로 사용된 AHFT의 결정구 조 및 평균 입자크기 분석결과를 그림 2에 나타내었다. 그 림 2(a)의 XRD 결과에서 보는 바와 같이 원료의 peak는 hexagonal 구조의 (NH4)2TiF6 (JCPDS card No. 73-2279)와 일치하는 것을 확인할 수 있으며 다른 이차상은 관찰되지 않았다. 그림 2(b)는 밀링 장치를 통한 분쇄 후 AHFT의 입자크기 및 입도분포 특성을 나타낸 것이며 그 결과 수 십 μm에서 수 mm까지 다양한 크기의 입자들이 존재하는 것을 확인하였다(평균 입자 크기는 약 428 μm).
- AHFT 원료의 형상과 조성 분석을 위해 FE-SEM 및 EDS 분석을 수행하였으며 그 결과를 그림 3에 나타내었 다. 그림 3(a, b)로부터 AHFT는 불규칙한 형상을 갖는 입 자들로 존재하며 그 크기는 입도 분포 결과와 일치하는 500 μm 전·후 정도임을 확인할 수 있다. 또한, AHFT의 표면은 매끄럽지 못하고 나노미터 크기의 작은 입자들이 붙어있는 것과 같은 거친 표면을 가지고 있음을 알 수 있 다(그림 3(b)). 그림 3(c)는 원료의 성분 및 조성 분석을 위 해 실시한 EDS spectrum 결과를 나타낸 것으로 F가 약 60 wt% 정도의 양을 차지하였으며 28 wt%의 Ti와 12 wt% 의 N이 측정되었다. AHFT ((NH4)2TiF6) 분자에서 원소별 로 차지하는 이론적 무게 비를 계산하면 (H 제외) F가 60%, Ti 25%, N 15%가 된다. 이는 실제 원료에서 측정된 EDS 결과와 비슷한 수치임을 알 수 있으며, 이러한 결과는 XRD 데이터에서 이차상이 없이 거의 단일상으로 원료가 이루어져 있다는 것의 근거가 될 수 있다(그림 2(a)).
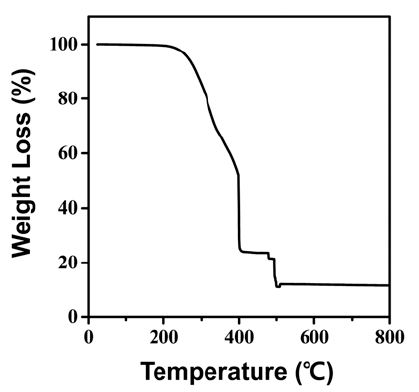
- 그림 4는 원료의 열 중량 분석 결과로 온도에 따른 질량 변화를 통해 물질의 상 변화를 예측할 수 있다. 그래프에 서 보듯이 ~200°C까지는 중량 변화가 없었으며 ~250°C부 터 ~400°C까지 급격한 중량 변화가 일어난다. 또한, ~400°C부터 ~500°C까지 무게를 유지하다가 ~500°C 부근 에서 급격하게 중량 변화가 일어나고 최종적으로 그 이후 에는 중량을 유지하는 결과를 얻었다. 기존에 Zhang 등은 합성된 AHFT를 이용해 TiO2를 제조하는 연구에서 다음과 같은 상 변화를 통해 TiO2가 제조된다고 가정하였다[13].
- 이러한 TGA 분석결과는 뒤에서 열처리 실험 결과와 함 께 더 자세히 다루도록 하겠다. 한편, 500°C 이후 열분해 및 상변화 과정을 통해 최종적으로 남아있는 잔여물(TiO2) 은 초기 무게 대비 10%를 나타내는데, 사실 원료에 존재 하는 Ti가 전부 TiO2 생성에 참여했다고 가정하면 최종 무 게는 초기 대비 43%가 되어야 한다. 이러한 결과의 차이 는 AHFT에 존재하는 Ti가 TiO2 상으로 생성되는 반응에 전부 참여하지 못하고 많은 부분이 열에너지에 의해 AHFT 자체 또는 중간 상인 NH4TiOF3, TiOF2의 형태로 기화되어 손실되기 때문인 것으로 판단된다.
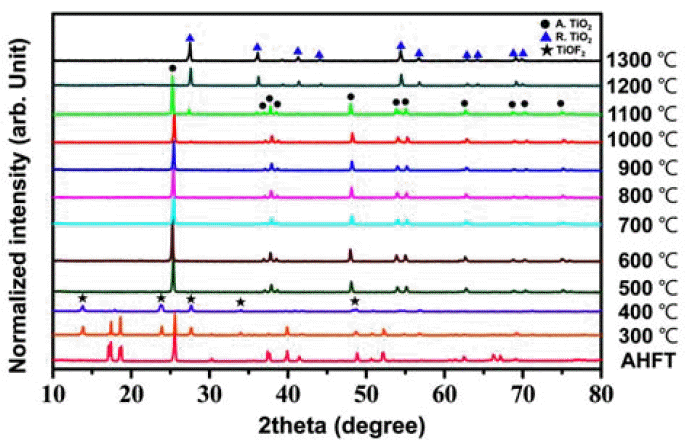
- TGA 분석 결과를 기반으로 AHFT의 완전한 분해와 TiO2로의 상변화 거동을 확인하기 위해 300~1300°C까지 1시간 동안 대기 분위기에서 열처리를 실시하였으며, 열처 리 온도에 따른 XRD 분석 결과를 그림 5에 나타내었다. 그림 5에서 보는 바와 같이 300°C에서는 원료의 일부가 TiOF2 (JCPDS card No. 01-0490)로 변하는 것을 확인할 수 있었다. 한편, TGA 데이터에서 언급했던 Zhang 등이 제시한 상 변화 거동과는 다르게 300°C에서 NH4TiOF3 peak을 관찰할 수 없었다. 이는 기존 논문에서 보고되었던 제조 AHFT의 경우 waste anodic electrolyte로부터 합성되 는 과정에서 발생하는 Ethylene Glycol(EG), H2O, NH4F의 잔류물, 복잡한 화학 조성 및 결합 등이 본 연구에서 이용 된 원료와는 차이가 있기 때문인 것으로 판단된다. 그림 5 에서 제시된 400°C 열처리 샘플의 XRD 결과는 모든 peak 들이 TiOF2와 일치하는 것을 확인할 수 있다. 이러한 결 과를 통해 본 연구에서 사용한 AHFT는 NH4TiOF3 상을 거치지 않고 바로 TiOF2로 상변화 한다는 결론을 내릴 수 있다. 즉, TGA 데이터에서 나타나는 약 250~400°C 사이 의 중량 감소 결과는 AHFT가 TiOF2로 상변화 하는 과정 에서 생긴 부분과 일부 물질들의 기화에 따른 것이라 할 수 있다. 한편, 열처리 온도를 500°C로 상승시키면 TiOF2 가 단일상의 anatase TiO2 (JCPDS card No. 21-1272)로 상변 화 하게 되는데 이는 TGA 데이터와 일치하는 결과이다. 이 렇게 형성된 anatase TiO2는 900°C까지 상의 변화 없이 결 정을 유지하게 된다. 일반적으로 anatase의 표면에너지가 rutile 보다 작기 때문에 낮은 온도에서 합성이 가능하지만 열처리 온도가 증가하면서 TiO2가 열역학적으로 안정한 rutile 상으로 변화하게 된다[14-16]. 이러한 상변화 온도는 400~1200°C로 매우 다양한데 그 이유는 anatase에서 rutile 로의 상변태에 영향을 미치는 요소가 합성방법, 원료, 입 자 크기 및 형상, 표면적, 승온 속도, 불순물 등 너무 다양 하기 때문이다[17-18]. 하지만 고순도 벌크 TiO2의 경우 일반적으로 약 600°C에서 상변화가 일어나는 것으로 알려 져 있다[19-20]. 본 연구에서는 1000°C 열처리 샘플에서부 터 rutile TiO2 (JCPDS card No. 21-1276)가 형성되기 시작 하였고 ICP 분석 결과 순도는 99.97%로 나타났다. 1100°C 로 열처리온도가 증가함에 따라 rutile의 비율이 늘어나는 것을 확인할 수 있었으며, 1200°C 이상의 열처리를 통해 anatase는 모두 rutile로 상변화 되는 것을 관찰할 수 있었 다. 이러한 상변화 거동에 대한 속도론적인 해석 및 활성 화 에너지 계산을 위해서는 열처리 시간에 대한 추가적인 연구와 분석이 필요하겠다.
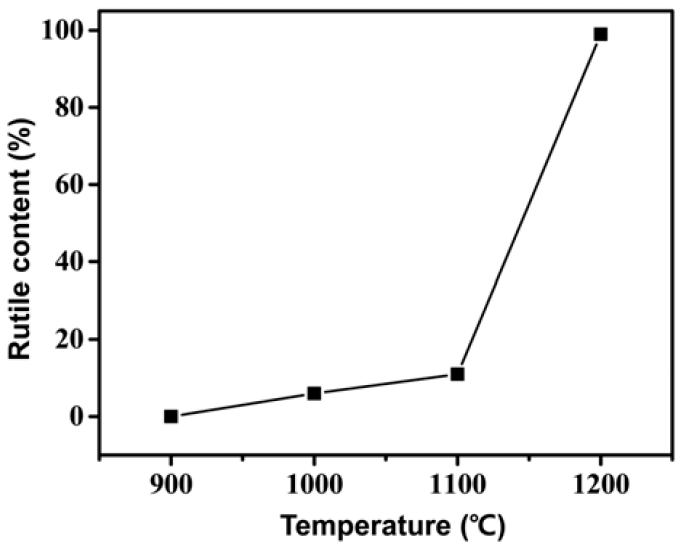
- 다음의 식은 그림 6의 XRD 분석 결과를 바탕으로 열처 리 온도에 따른 anatase에대한 rutile의 상 비율을 계산하 기 위해 적용되었다[21].
- 여기에서, R(T)는 각 온도에서의 rutile 상의 함량 (%)을 나타내며 IR과 IA는 XRD 결과 중 rutile (main peak = (110), 2θ = 27.44°)과 anatase (main peak = (101), 2θ = 25.3°) 결정 상의 제 1피크의 intensity를 나타낸다. 위 식을 기반으로 rutile 상의 비율은 1000, 1100, 1200°C에서 6%, 11%, 100% 로 계산되었으며 그 결과를 그림 6에 나타내었다. 이러한 결과를 통해 1100°C와 1200°C 사이에서 anatase에서 rutile 로의 급격한 상변화가 일어남을 알 수 있다.
- 그림 7은 800°C와 1200°C에서 열처리된 샘플에 대한 FE-SEM 결과이다. 800°C에서 열처리된 anatase TiO2의 경우 100 nm~1 μm 정도의 불규칙한 크기와 형상을 갖는 입자들로 구성되어 있음을 확인할 수 있다(그림 7(a)). 1200°C에서 열처리된 샘플의 경우는 열처리 온도가 증가 하면서 anatase에서 rutile로 상변화 뿐만 아니라 TiO2의 소결에 의해 입자들 간에 neck이 형성되면서 입자들끼리 서로 이어지고 표면은 매끄럽게 변화되는 것이 관찰되었 다(그림 7(b)). TiO2를 산업에 적용하기 위해서는 응용 분 야에 따라 입자의 형상 및 크기가 매우 중요한 요인이므 로 향후 AHFT를 이용해 TiO2를 제조하는 공정 개발에 있 어서는 형상 및 크기 제어를 위한 요소 기술 개발이 선행 되어야 할 것으로 사료된다.
3. 결과 및 고찰
- 본 연구에서는 TiO2 분말 합성을 위한 AHFT 원료의 열 적 거동을 다양한 열처리 공정을 통해 분석하였다. 열처리 온도에 따른 XRD 분석 결과, 300°C에서 중간 상인 TiOF2 가 생성되기 시작하여 400°C에서는 단일상의 TiOF2가 형 성되었다. 이러한 TiOF2는 500°C에서 완전히 anatase TiO2 로 상변화되어 900°C까지 같은 상을 유지하였으며, 열처 리 온도가 더욱 높아짐에 따라 rutile 상이 나타나다가 1200°C 이상에서는 완전한 rutile 상으로 변화됨을 확인하 였다. 한편, 1000, 1100, 1200°C에서 anatase에 대한 rutile 상의 비율은 6%, 11%, 100%로 계산되어 1100°C와 1200°C 사이에서 rutile로의 급격한 상변화가 이뤄진다는 것을 알 수 있었다. 결론적으로 AHFT를 원료로 이용하여 anatase 및 rutile 상을 갖는 TiO2 분말 합성이 가능하며, 이러한 결 과는 고품질의 TiO2 분말을 생산하는 신공정 개발에 기초 데이터로써 활용이 가능할 것으로 사료된다.
4. 결 론
-
Acknowledgements
- 본 논문은 산업통상자원부 에너지기술개발사업의 지원 으로 수행되었으며 이에 감사드립니다(20152510101950).
감사의 글
- 1. H. Chang, J. Ma, Z. Zhao and L. Qi: Chem. Mater., 7 (1995) 663. .Article
- 2. B. S. Lee, D. Y. Shin and S. M. Han: J. Korean Ceram. Soc., 37 (2000) 308. .
- 3. J. Yang, S. Mei and J. M. Ferreira: J. American Ceramic Soc., 83 (2000) 1361. .Article
- 4. J. G. Kim and I. C. Kang: J. Korean Powder Metall. Inst., 19 (2012) 196. .Article
- 5. H. S. Park, S. Y. Joo, J. P. Choi and W. B. Kim: J. Korean Powder Metall. Inst., 22 (2015) 396. .Article
- 6. L. Gao and Q. Zhang: Materials Transactions, 42 (2001) 1676. .Article
- 7. S. O. Choi, J. H. Cho, W. Y. Kim and S. W. Lim: Korean J. Met. Mater., 50 (2012) 523. .Article
- 8. J. H. Braun, A. Baidins and R. E. Marganski: Prog. Org. Coat., 20 (1992) 105. .Article
- 9. A. S. Attar, M. S. Chamsari, F. Hajesmaeilbaigi and S. Mirdamadi: J. Mater. Sci., 43 (2008) 1723. .Article
- 10. H. Yin, Y. Wada, T. Kitamura, S. Kambe, S. Murasawa, H. Mori, T. Sakata and S. Yanagida: J. Mater. Chem., 11 (2001) 1694. .Article
- 11. T. Sugimoto, X. Zhou and A. Muramastu: J. Colloid Interface Sci., 259 (2003) 53. .ArticlePubMed
- 12. N. Venkatachalam, M. Palanichamy and V. Murugesan: Mater. Chem. Phys., 104 (2007) 454. .Article
- 13. A. Y. Zhang, L. L. Long, C. Liu, W. W. Li and H. Q. Yu: Green Chem., 16 (2014) 2745. .Article
- 14. H. J. Noh, J. K. Lee, D. S. Seo and K. H. Hwang: J. Kor. Ceram. Soc., 39 (2002) .
- 15. H. Nishzawa, N. Yamasaki and K. Matsuoka: J. Am. Ceram. Soc., 65 (1982) 343. .Article
- 16. S. D. Mo and W. Y. Ching: Phys. Rev. B, 51 (1995) 13023. .ArticlePubMed
- 17. O. Carp, C. L. Huisman and A. Reller: Prog. Solid State Chem., 21 (2004) 33. .Article
- 18. J. Kim, K. C. Song, S. Foncillas and S. Pratsinis: J. Eur. Ceram. Soc., 21 (2001) 2863. .Article
- 19. T. B. Ghosh, S. Dhabal and A. K. Datta: J. Appl. Phys., 94 (2003) 4577. .Article
- 20. M. Hirano, N. Nakahara, K. Ota, O. Tanaike and N. Inagaki: J. Solid State Chem., 170 (2003) 39. .Article
- 21. J. Arbiol, J. Cerda, G. Dezanneau, A. Cirera, F. Peiro, A. Cornet and J. R. Morante: J. Appl. Phys., 92 (2002) 85..Article
Figure & Data
References
Citations
Citations to this article as recorded by 

- Photocatalytic activity of rutile TiO2 powders coupled with anatase TiO2 nanoparticles using surfactant
Jong Min Byun, Chun Woong Park, Young In Kim, Young Do Kim
journal of Korean Powder Metallurgy Institute.2018; 25(3): 257. CrossRef
Study on thermal behavior of Ammonium Hexafluofide Titanate for Synthesis of TiO2 Powders
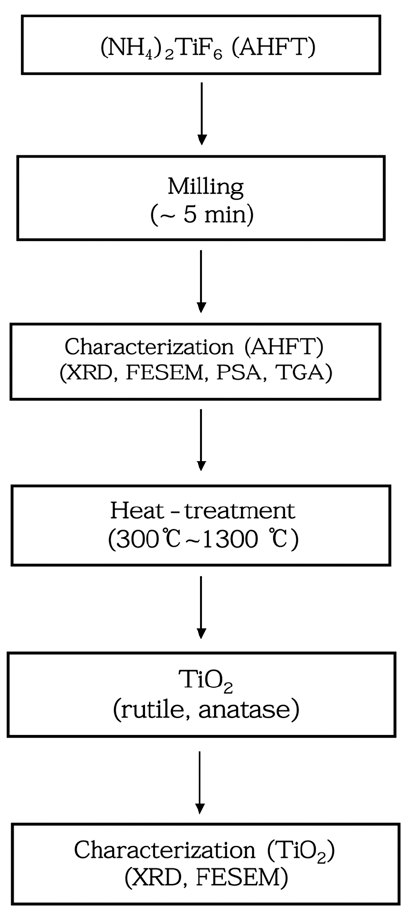

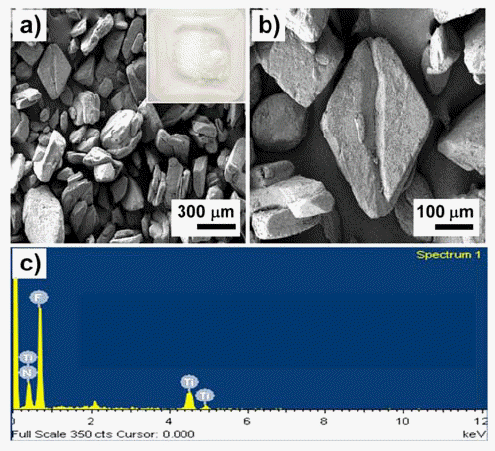
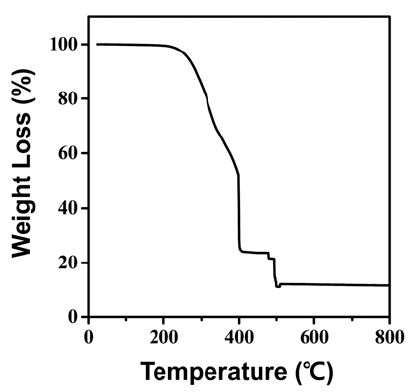

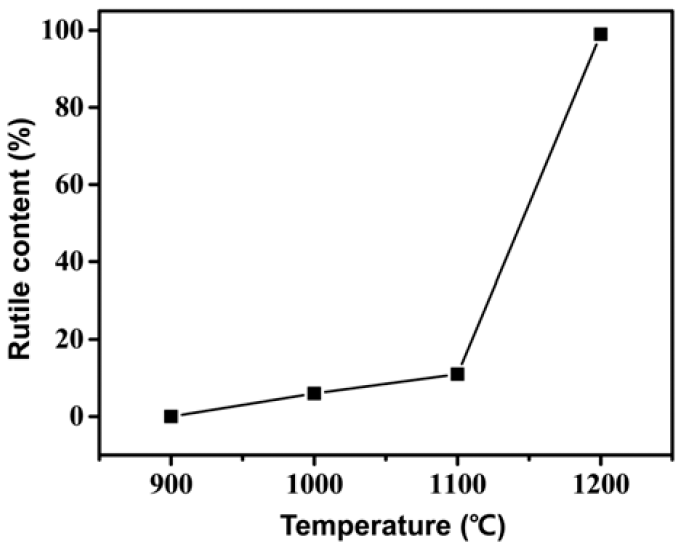

Fig. 1
The flowsheet of the TiO2 preparation.
Fig. 2
The (a) XRD and (b) PSA analysis of AHFT.
Fig. 3
FE-SEM images and EDS element analysis of AHFT powders.
Fig. 4
The TGA curve of AHFT.
Fig. 5
XRD patterns of AHFT at different temperature.
Fig. 6
Effects of temperature on phase ratio of rutile TiO2.
Fig. 7
The FE-SEM images of (a) anatase TiO2 at 800°C and (b) rutile TiO2 at 1200°C.
Fig. 1
Fig. 2
Fig. 3
Fig. 4
Fig. 5
Fig. 6
Fig. 7
Study on thermal behavior of Ammonium Hexafluofide Titanate for Synthesis of TiO2 Powders
TOP
 KPMI
KPMI



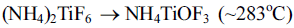
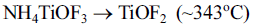


 Cite this Article
Cite this Article







