Articles
- Page Path
- HOME > J Korean Powder Metall Inst > Volume 25(3); 2018 > Article
-
ARTICLE
저농도 은이 함유된 LTCC 전극공정부산물로부터 은 회수 및 나노입자 제조 연구 - 주소영, 안낙균, 이찬기, 윤진호*
- Study on the Recovery Silver and Nanoparticles Synthesis from LTCC By-products of Lowly Concentrated Silver
- Soyeong Joo, Nak-Kyoon Ahn, Chan Gi Lee, Jin-Ho Yoon*
-
Journal of Korean Powder Metallurgy Institute 2018;25(3):232-239.
DOI: https://doi.org/10.4150/KPMI.2018.25.3.232
Published online: May 31, 2018
고등기술연구원 신소재공정센터
Advanced Materials & Processing Center, Institute for Advanced Engineering (IAE), Yongin 17180, Korea
- *Corresponding Author: Jin-Ho Yoon, TEL: +82-31-330-7491, FAX: +82-31-330-7116, E-mail: yjh6373@iae.re.kr
• Received: June 1, 2018 • Revised: June 15, 2018 • Accepted: June 18, 2018
© The Korean Powder Metallurgy Institute. All rights reserved.
- 815 Views
- 4 Download
Abstract
- In this paper, the recovery and nanoparticle synthesis of Ag from low temperature co-fired ceramic (LTCC) by-products are studied. The effect of reaction behavior on Ag leaching conditions from the LTCC by-products is confirmed. The optimum leaching conditions are determined to be: 5 M HNO3, a reaction temperature of 75°C, and a pulp density of 50 g/L at 60 min. For the selective recovery of Ag, the [Cl]/[Ag] equivalence ratio experiment is performed using added HCl; most of the Ag (more than 99%) is recovered. The XRD and MP-AES results confirm that the powder is AgCl and that impurities are at less than 1%. Ag nanoparticles are synthesized using a chemical reduction process for recycling, NaBH4 and PVP are used as reducing agents and dispersion stabilizers. UV-vis and FE-SEM results show that AgCl powder is precipitated and that Ag nanoparticles are synthesized. Ag nanoparticles of 100% Ag are obtained under the chemical reaction conditions.
- 유가자원에서의 은(Silver; Ag)은 높은 열전도성과 전기 전도성, 우수한 내산화성, 항균작용 등의 특성을 지닌 귀 금속으로 스퍼터, 타겟, 디스플레이 소자와 각종 기판 전 극 소재의 전자 산업분야 및 화학, 의학 분야 등에서 매우 광범위하게 사용되고 있으나 발생되는 폐기물에 비해 유 가금속의 회수는 상대적으로 미비한 실정이다[1-7]. 자원 의 부족으로 인한 귀금속 관련 산업원료를 전량 수입에 의존하는 현재로서는 전자산업에서 발생하는 유가금속 회 수가 자원의 안정적 확보 차원에서 중요하며 유가금속 회 수를 통한 재자원화가 시급하다[2,8-10]. 전자산업에서 발 생되는 폐기물에는 Ag를 포함한 Au, Pt, Pd, Rd 등의 귀 금속 및 Ni, Co 등 유가금속이 함유되어 있다. 귀금속 기 반 금속의 경우 촉매작용, 광화학 및 전자공학의 응용 분 야에서 흥미로운 특성을 지님에 따라 전자산업 폐기물로 부터의 귀금속 회수 연구가 중요하게 대두되고 있어 해외 선진국에서는 이미 오래 전부터 기술개발을 진행하여 상 용화 단계에 있다. 특히, Ag를 포함한 폐기물로부터의 회 수는 자원 재활용과 나아가 재자원화 측면에서 중요하다. 전자산업 폐기물로부터 귀금속 회수의 경우에는 크게 건 식공정과 습식공정으로, 건식공정의 경우 고농도의 대용 량의 폐기물 처리에서 주로 사용되나 이와 같이 대량 처 리를 위한 높은 초기투자 비용과 높은 에너지를 소모하며 특히, 과량의 슬러그 발생으로 인한 귀금속 손실이 발생하 게 된다. 습식공정은 건식공정에 비해 처리 용량은 상대적 으로 적으나 저가의 초기 설치비용과 슬러그 발생이 없어 환경적 및 경제성의 선호도가 높으며 산 기반의 용액을 사용하여 목표하는 귀금속을 선택적으로 분리하는 방식으 로 본 연구에서 회수하고자 하는 Ag 회수에 있어서 가장 적합하다. 또한, 기존의 Ag 회수기술은 전자산업 폐기물 로부터의 고농도 Ag 회수기술이 대부분이며, 1% 미만의 저농도 Ag에 대한 회수공정은 상대적으로 미비하므로, 저 농도 Ag를 함유하고 있는 산업원료 폐기물에 대한 Ag 회 수 연구가 필요하다[8-10,21]. 또한, 회수된 Ag를 산업원 료로의 사용을 위해 Ag 나노입자(silver nanoparticles, Ag NPs) 제조 연구가 필요하다[22].
- Ag 나노입자는 Ag 금속이 가지고 있는 항균 및 살균효 과 그리고 우수한 열전도성 및 전기전도성의 특성 극대화 가 가능하며, 입자크기와 형상에 따라 나노입자의 특성변 화를 나타내어 산업분야에서의 다양한 적용이 가능하다 [11-14]. Ag 나노입자의 제조공정에는 스퍼터를 이용한 증 착법, 열분해법, 수소환원법, 화학환원법, 전기적환원법 등 다양한 방법으로 나노입자를 제조한다[15-20]. 가장 일반 적인 화학환원공정은 저비용의 단순공정으로 대량의 입자 제조를 통해 수득률이 높고, 입자의 균일성 및 분산성과 형상을 확보할 수 있다[21,22]. 또한, 전구체로부터 금속이 온이 전자를 공급 받아 금속 입자로 성장시키는 bottomup 방식이기 때문에 계면활성제, pH, 반응온도, 반응시간, 환원제 농도 등의 합성조건에 따라서 핵 생성 단계부터 입도제어가 가능하므로 Ag 나노입자 제조에는 가장 효율 적이다[23-25,29]. 이와 같이 환원제를 통한 bottom-up 방 식에서의 나노입자 제조는 핵 성장에 따른 입자간의 뭉침 을 방지하기 위해 유기물이나 고분자 물질 등의 구조제어 특성이 높은 분산안정제의 사용이 중요하다. 이러한 용액 내의 뭉침현상을 감속시키기 위한 분산안정제로써 계면활 성제를 사용하는데, 이는 서로 다른 입자의 표면에 흡착하 여 표면장력을 낮춤에 따라 안정된 상태로 존재할 수 있 도록 하는 역할을 한다[26-28,30].
- 따라서, 본 연구에서는 저농도 Ag가 함유되어 있는 LTCC(Low Temperature Co-fired Ceramic) 전극공정부산 물로부터 안정한 특성을 갖는 Ag의 효율적인 분리를 위해 강산 기반의 용액을 기반으로 침출제 농도, 침출공정의 반 응온도, 침출공정의 반응시간 그리고 원료와 침출제와의 비율인 고액비(pulp density) 조건에서의 Ag 침출거동을 확인하였으며, 최적침출조건을 도출하였다. 얻어진 침출용 액으로부터 불순물 제거를 통한 선택적인 Ag 회수를 위해 AgCl 침전 실험을 실시하였다. 또한, 재자원화를 통한 응 용분야에서의 적용을 위해 agent를 이용하여 고농도 Ag 나노입자를 제조하였다.
서 론
- 2.1 실험재료
- 본 연구에서는 1000°C 이하에서 Ag 및 Cu계 금속이 도 포된 도전체 페이스트와의 동시 소성 방법을 이용하여 형 성된 적층구조의 기판인 LTCC 전극에서 배출되는 공정부 산물을 실험원료로 사용하였다. 적층구조의 기판 형태인 LTCC 전극공정부산물의 원료 조성 확인을 위한 원소분석 을 위해 우선 분쇄기(JL-1000, Hibell)를 이용하여 분말화 를 실시하였으며, 분말화된 원료는 X-선 형광분석법(XRF, X-ray fluorescence spectroscopy, ZSX Primus II, Rigaku) 을 통해 확인하였다. 분석한 원료의 조성은 표 1에 나타내 었다. 표 1에서 보는 바와 같이 LTCC 전극공정부산물 원 료의 주성분은 Si, Al, Fe, Ca, Sr 그리고 Ag 성분이 함유 되어있음을 알 수 있었으며, LTCC 전극의 주성분인 Si 함 량이 48.00 wt%로 가장 높은 것을 확인하였다. 고가의 귀 금속인 Ag의 함량은 1.03 wt%로 저농도 Ag가 함유되어 있음을 확인하였다.
- 2.2 불순물 저감 공정을 이용한 선택적 Ag 분리회수
- 본 연구의 Ag 분리회수 및 나노입자 제조까지의 전체적 인 개략도는 그림 1에 나타내었다. 앞서 X-선 형광분석을 통해 확인된 저농도 Ag(1.03 wt%)가 함유된 LTCC 공정 부산물로부터 Ag를 분리하기 위하여 습식침출공정을 실 시하였다. 습식침출공정에는 질산(60% HNO3, Daejung)를 사용하였으며, 용액의 균일한 온도 구배를 위해 교반기와 온도센서가 수반된 가열용 맨틀(heating mantle)에 500 ml 3구 둥근 플라스크를 넣어 침출실험을 실시하였다. 이때, 가열로 인해 용액으로부터 발생된 증기는 환류 응축기 (reflux condenser)를 반응조에 부착시킴으로써 증기에 의 한 손실을 최소화하였다.
- 최적 Ag 침출조건을 확립하기 위해 다양한 조건에 대한 실험을 수행하였으며, 연구에 사용된 원료의 침출특성 파 악을 위해 산 농도(1~5 M), 침출온도(25~75°C), 침출시간 (10~180 min) 그리고 고액비(25~200 g/L)의 조건을 두어 실험을 진행하였고, LTCC 전극공정부산물 원료로부터의 Ag 침출거동을 확인하였다. 우선, 원료로부터 Ag 분리를 위하여 HNO3가 들어있는 500 ml 3구 둥근 플라스크를 가 열용 맨틀을 통해 온도를 가해주며 실험을 실시하였고, 시 간에 따른 침출거동을 살펴보기 위하여 정해진 시간에 따 라 샘플을 채취하였다. 각 침출시간에 따라 채취한 샘플은 필터페이퍼를 통해 고액분리를 실시했으며, 분리된 잔사 는 제거하였다.
- 잔사가 제거된 침출용액으로부터 최대의 Ag 회수를 위 해 Ag와 Cl 당량비([Cl]/[Ag] mol=0.5~2.0) 조건에 따라 침전실험을 진행하였으며, 원료로부터 Ag가 분리된 침출 용액에 염산(35% HCl, Daejung)를 투입한 후, 충분한 시 간 동안 상온에서 교반을 통해 반응시켰다. 반응이 완료된 후, 증류수(distilled-water)를 이용하여 3회 이상 정제하였 으며, 원심분리(centrifugation; 10,000 rpm, 10 min)를 통 해 최종적으로 고액분리하여 얻어진 분말을 회수하였다.
- 2.3 화학환원공정을 이용한 Ag 전구체로부터 나노입자 제조
- LTCC 전극공정부산물로부터 분리회수한 Ag의 고순도 화를 위한 전구체로는 25 ml 암모니아수(28~30% NH4OH, Junsei)에 회수된 분말을 용해하여 사용하였으며, 전구체 의 농도는 0.05 M로 고정하여 화학환원공정을 통해 Ag 나노입자 제조실험을 진행하였다. 환원공정에서의 Ag 환 원제로는 제조되는 입자의 입도분포가 가장 균일한 입자 성장을 위해 수소화붕소나트륨(98% NaBH4, Daejung)를 사용하였고[31], 환원제에 의해 생성되는 나노입자의 입도 분포가 균일하지 않으므로 안정적이며 균일한 입도분포를 위해 분산안정제로는 고분자인 폴리(비닐피롤리돈)(MW= 40,000 PVP, Sigma-aldrich)을 사용하였다. 모든 Ag 나노입 자 제조공정은 상온에서 교반기를 이용하여 진행하였으며, 분산안정제-환원제 순서로 교반중인 전구체에 agent를 투 입하여 반응시켰다. 반응이 완료된 후 생성된 Ag 나노입 자를 불순물 및 잔류 유기용매 제거를 위해 증류수와 에 탄올(95% ethanol, Daejung)로 정제하였다. 전체 화학환원 공정은 모두 상온에서 진행하였다.
- 2.4 특성평가
- LTCC 전극공정부산물로부터 저농도 Ag을 분리회수하 기 위한 최적침출조건 도출을 위해 습식침출공정을 실시 하였으며, 각 실험조건에 따른 Ag 함유량 확인을 위하여 마이크로웨이브 플라즈마-원자 방출 분광기(MP-AES, Microwave plasma-atomic emission spectrometer, 4100 MP-AES, Agilent)를 통해 원소분석을 진행하였다. X-선 회절분석법(XRD, X-ray diffraction spectroscopy, XRD- 6100, Shimadzu)을 통해 당량비 조건에 따른 침전실험에 서 생성된 분말 및 생성된 분말로부터 제조한 나노입자의 결정성을 확인하였다.
- 또한, Ag 고순도화를 위한 화학환원공정에서 제조된 나 노입자의 환원정도와 분산정도 확인을 위하여 자외선-가시 광선 분광광도계(UV-vis, Ultraviolet–visible spectroscopy, V- 730, Jasco, Japan)를 이용하여 표면 플라즈몬 공명(SPR, Surface plasmon resonance)을 통한 흡수 스펙트럼을 확인 하였고, 입자크기 및 성분확인을 위하여 전계방출형 주사 전자현미경(FE-SEM, Field emission-scanning electron microscopy, Tecnai G2 F20S-Twin TmP)을 이용하여 분석 을 진행하였다.
실험 방법
Table 1
Chemical Compositions of LTCC by-product used in the study
| Metal | Ag | SiO2 | Al2O3 | CaO | SrO | Fe2O3 |
|---|---|---|---|---|---|---|
|
|
||||||
| Content (wt.%) | 1.03 | 48 | 43.3 | 5.12 | 2.44 | 0.06 |
- 3.1 침출조건에 따른 Ag 침출거동
- 그림 2(a)는 저농도 Ag이 함유되어 있는 LTCC 공정부 산물로부터의 선택적인 Ag 분리를 위한 HNO3 농도조건 에 따른 Ag의 침출거동 결과이다. HNO3 농도조건에 따른 침출거동을 확인하기 위하여 1 M, 3 M, 5 M 농도에서 진 행하였으며, 침출공정의 반응온도, 반응시간, 고액비는 75°C, 180 min, 25 g/L로 고정하였다. HNO3 농도에 따른 Ag 침출률은 HNO3=1 M, 3 M, 5 M 일 때, 각각 70%, 82%, 99%로 HNO3 농도가 증가함에 따라 침출률도 증가 하였으며, 5 M HNO3에서 가장 높은 Ag 침출률을 나타내 는 것을 확인하였다. HNO3 농도에 따른 결과를 바탕으로 HNO3 농도는 5 M일 때가 최적임을 알 수 있었으며, 본 연구에서 사용하는 원료는 Ag의 함량이 1.03 wt%로 미량 일 뿐 아니라 5 M HNO3에서 이미 99%의 Ag 침출률을 보였으므로 이후 실험에서는 5 M HNO3로 고정한 후, 다 른 변수에 따른 최적의 침출조건 실험을 진행하였다.
- 그림 2(b)와 (c)는 5 M HNO3, 고액비 25 g/L의 고정조 건에서의 반응온도 25°C, 50°C, 75°C와 반응시간=10 min, 30 min, 60 min, 120 min, 180 min에 따른 침출거동을 나 타낸 결과이다. 반응온도에 따른 Ag 침출률은 반응온도 =25°C, 50°C, 75°C일 때, 각각 84%, 96%, 99%를 나타내 었고 반응온도가 증가함에 따라 침출률도 증가하였으며, 75℃의 반응온도에서 가장 높은 Ag 침출률을 나타내는 것 을 확인하였다. 반응온도가 증가함에 따른 Ag 침출률 증 가는 선행연구로 진행된 L. H. Le et al.의 연구결과와 일 치한다[2]. 또한, 반응시간에 따른 Ag 침출거동을 확인한 결과, 반응시간의 지남에 따라 Ag 침출률이 증가했다. 교 반중인 침출제에 원료를 투입한 시점부터 반응시간 10 min일 때 87%의 Ag 침출률을 나타냄으로써 Ag 침출이 급격히 상승했음을 알 수 있었고, 반응시간 60 min 이후 부터는 지속적으로 99% 이상의 Ag 침출률을 확인할 수 있었는데, 이는 60 min 이내에 Ag 침출이 거의 완료되는 것을 알 수 있었다.
- 원료-침출제 비율에 따른 고액비의 Ag 침출거동 결과는 그림 2(d)에 나타내었고, 고액비=25 g/L, 50 g/L, 100 g/L, 150 g/L, 200 g/L에 따른 Ag 침출률을 확인하였다. 고정조 건으로는 5 M HNO3, 75°C, 180 min으로 두어 실험을 진 행하였다. 실험결과, 고액비가 증가함에 따른 Ag 침출률은 감소하였으며, 50 g/L 이상에서의 Ag 침출은 급격히 낮아 짐을 확인하였다. 5M HNO3, 75°C, 180 min의 조건에서의 Ag 침출에는 고액비 50 g/L 이하의 조건에서 높은 Ag 침 출률을 나타냄을 확인하였다. 그림 2(d)에서 고액비 50 g/L 이상인 조건에서의 급격한 침출률 저하 원인은 금속의 용 해반응에 필요한 HNO3 용액의 고갈현상으로 판단된다.
- 3.2 HCl 투입에 따른 선택적 Ag 회수
- 앞서 진행한 Ag 침출공정에서 도출한 최적침출조건인 5 M HNO3, 75°C, 60 min 그리고 고액비 50 g/L로 Ag를 침출한 침출용액(AgNO3)으로부터의 Ag 회수실험을 진행 하였다. 그림 3(a)는 최적의 Ag 회수률을 얻기 위해 HCl 을 첨가할 때의 [Cl]/[Ag] 당량비에 따른 침전률 결과를 나타내었다. AgCl 반응식은 식 (1)과 같으며 당량비는 [Cl]/[Ag]=0.5, 1.0, 1.5, 2.0로 두어 침전되는 분말의 효율 을 확인하였다.
- 당량비 [Cl]/[Ag]=1.0의 경우 Ag의 침전률이 약 66%로 34%의 잔류 Ag가 있음을 알 수 있으며 당량비 [Cl]/ [Ag]=1.5의 경우 Ag의 99% 이상이 침전되어 잔류 Ag가 1% 미만으로 아주 소량인 것을 알 수 있었다. HCl 투입 을 통해 얻어진 AgCl 분말을 암모니아수에 용해시켜 Ag 함유량을 확인하였으며, 그림 3(b)에서 나타낸 바와 같이 Ag 이외의 불순물들이 다수 함유되어 있는 침출용액과는 달리 AgCl 분말에서의 불순물 함량은 1% 미만임을 확인하 였다. 그림 4는 침전된 분말의 결정상 확인을 위하여 XRD 분석을 실시한 결과이며, AgCl(JCPDS NO. 06-0480) peak를 확인하였다.
- 3.3 Agent 조건에 따른 Ag 나노입자 특성확인
- 앞서 동일한 Ag 이온농도에서의 실험 진행을 위해 모든 나노입자 제조실험에서 LTCC 전극공정부산물로부터 얻 어진 AgCl 분말을 25 ml 암모니아수에 용해하여 Ag 전구 체로 사용하였고, 전체적인 공정은 모두 상온에서 진행하 였다.
- Ag 전구체로부터 나노입자를 제조하기 위한 환원제로 는 NaBH4를 사용하였고, Ag 나노입자가 생성될 때, 입자 들의 높은 표면에너지로 인한 입자간 뭉침을 방지하기 위 하여 구조제어특성이 높은 PVP를 분산안정제로 사용하였 다. 우선, 본 연구에서 원료로부터 Ag를 분리회수한 AgCl 분말과 상용 AgCl 분말을 사용하여 Ag 나노입자 제조결 과를 비교하기 위한 비교실험을 실시하였다. 나노입자 제 조에는 PVP(MW 40,000) 농도가 0.0025%일 때, 환원제인 NaBH4=0.005 M, 0.05 M, 0.5 M인 조건에서 실험을 실시 하였다. Ag 나노입자는 플라즈몬 나노입자로 금속 내부의 자유전자들이 외부 전자기장에 의해 집단적으로 진동하는 LSPR 현상을 띄게 되는데 이 때, Ag 나노입자가 지니는 특정한 파장영역대에서의 흡수 peak를 나타낸다. 이러한 특성을 이용하여 (a) Ag를 분리회수한 AgCl 분말과 (b) 상용 AgCl 분말로부터 제조된 나노입자의 absorbance를 분석한 흡수파장 결과를 그림 5에 나타내었다. Ag 나노입 자가 갖는 흡수영역대에서 peak를 관찰할 수 있었으며, 이 를 통해 모든 조건에서 Ag 나노입자가 제조되었다고 판단 하였다. 또한, Ag를 분리회수한 분말과 상용분말로부터 제조된 Ag 나노입자의 흡수파장은 각각 (a) 416 nm, 409 nm, 396 nm, (b) 400 nm, 399 nm, 398 nm로 환원제의 농도가 0.005 M, 0.05 M, 0.5 M로 증가함에 따라 단파장으 로 이동하였으며, 이는 보다 작은 입자가 형성된다는 것을 확인할 수 있었다. 그리고, 환원제인 NaBH4의 농도가 증 가할수록 반가폭(FWHM; full width at half maximum)이 좁아지고, 흡광도(intensity)가 높아짐을 확인하였다. 일반 적으로 UV-vis 분석결과에서 반가폭은 입자의 균일성을 나타내는데, 이를 통해 NaBH4 농도가 높아짐에 따라 합 성되는 Ag 나노입자의 균일성이 향상되었음을 알 수 있었 다. 또한, 흡광도도 같이 증가함을 나타내었고 농도에 따 른 흡광도의 차이는 환원제에 의해 생성된 나노입자의 생 성 정도가 증가하기 때문이라고 판단하였으며, 환원제 농 도에 따른 입자크기 및 생성되는 정도를 확인하기 위하여 FE-SEM 분석을 이후에 진행하였다. 원료로부터 분리회수 된 AgCl 분말과 상용 AgCl 시약을 사용하여 비교실험을 진행한 결과, 차이가 없음을 확인하여 이후 실험에서는 원 료로부터 분리회수된 AgCl 분말을 사용하여 실험을 진행 하였다.
- 그림 6는 원료로부터 Ag가 분리회수된 AgCl 분말를 사 용하여 제조된 나노입자의 결정상 확인을 위하여 XRD 분 석을 실시한 결과이며, Ag(JCPDS NO. 04-0783) peak를 확인함으로써 Ag 나노입자를 합성했음을 확인하였다.
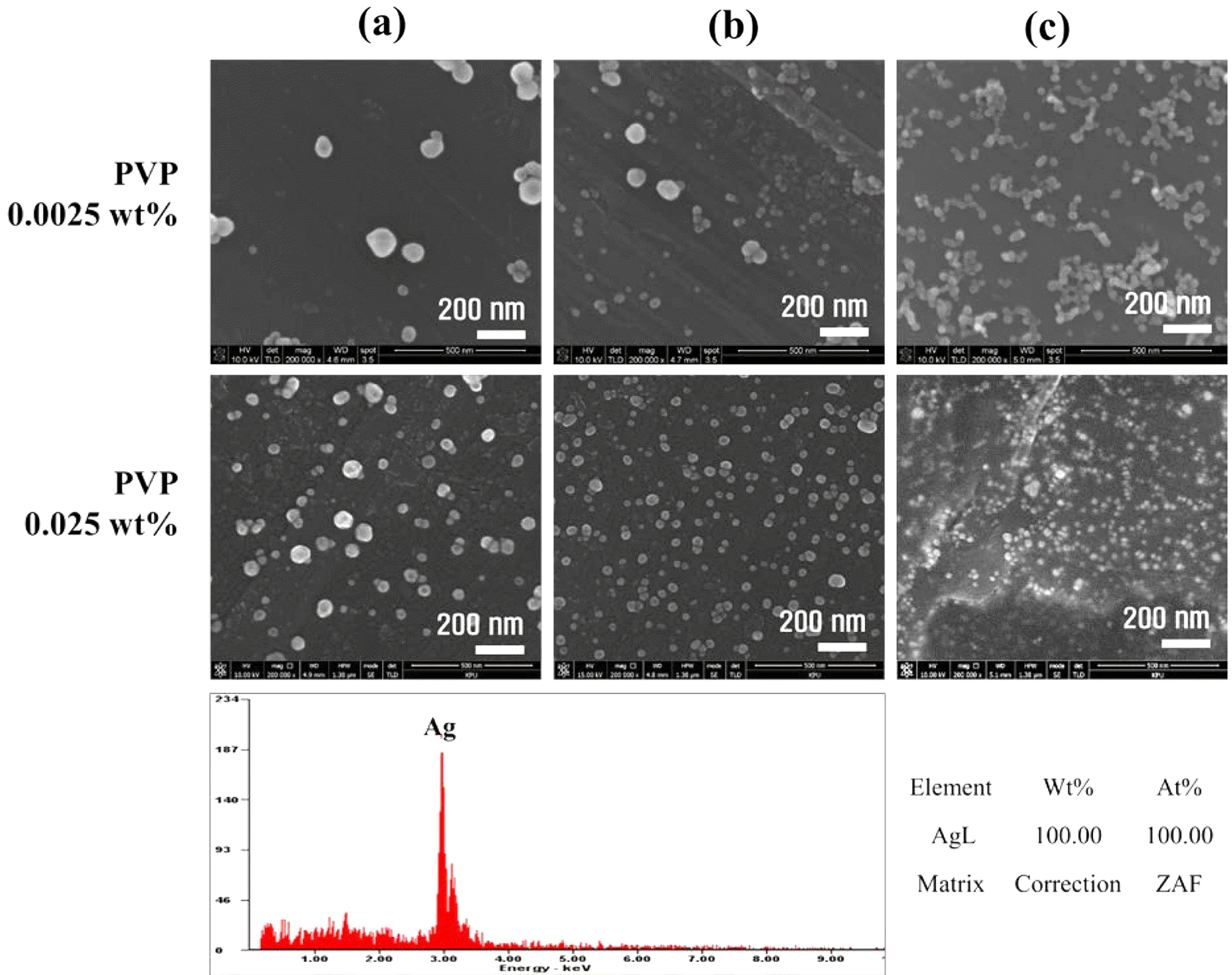
- 그림 7은 환원제와 분산안정제의 농도 조절을 통해 실 시한 나노입자의 분산성과 입자크기 확인을 위해 분석한 결과이다. NaBH4 농도가 (a) 0.005 M, (b) 0.05M, (c) 0.5M 로 증가할수록 Ag 나노입자의 평균 입자크기는 PVP 0.0025 wt%조건에서 (a) 91.68 nm, (b) 75.78 nm, (c) 28.40 nm 로 감소하였다. 이는 일반적으로 입자의 성장은 입자성장속 도에 비례하지만 환원제의 구동력과는 반비례하여 제조되 는 나노입자의 평균 입자크기가 감소하는 경향을 나타냈 다. 또한, 화학환원공정에 의해 제조된 나노입자의 안정화 를 위해 사용한 분산안정제에 따른 나노입자의 특성확인 을 위해 PVP=0.025 wt% 조건에서 추가실험을 진행하였 으며, 환원제 조건은 동일하게 두고 진행하였다. PVP 농 도가 높을수록 분산성이 높으며, 평균 나노입자 크기가 작 음을 알 수 있다. Ag 전구체 내에서 반대 전하를 지닌 고 분자인 PVP로 인해 Ag 이온의 농도에 따라 정해진 표면 에너지를 갖는 특정한 크기의 나노입자 표면에 쌓여져 그 이상의 입자성장이 일어나지 않음에 따라 보다 크기가 작고 균일한 입자크기로 형성됨을 확인하였다. PVP=0.025 wt%일 때의 Ag 나노입자의 평균 입자크기는 (a) 52.10 nm, (b) 45.13 nm, (c) 31.60 nm로 앞서 진행했던 PVP 0.0025wt% 조 건과 같이 환원제 농도 증가에 따라 평균 나노입자 크기는 감소했으며, PVP 농도 증가에 따라서도 전체적인 입자크 기의 감소를 나타냈음을 확인하였다. 또한, EDS를 이용하 여 성분분석을 했으며 제조된 나노입자가 100% Ag 임을 확인하였다.
결과 및 고찰
Fig. 2.
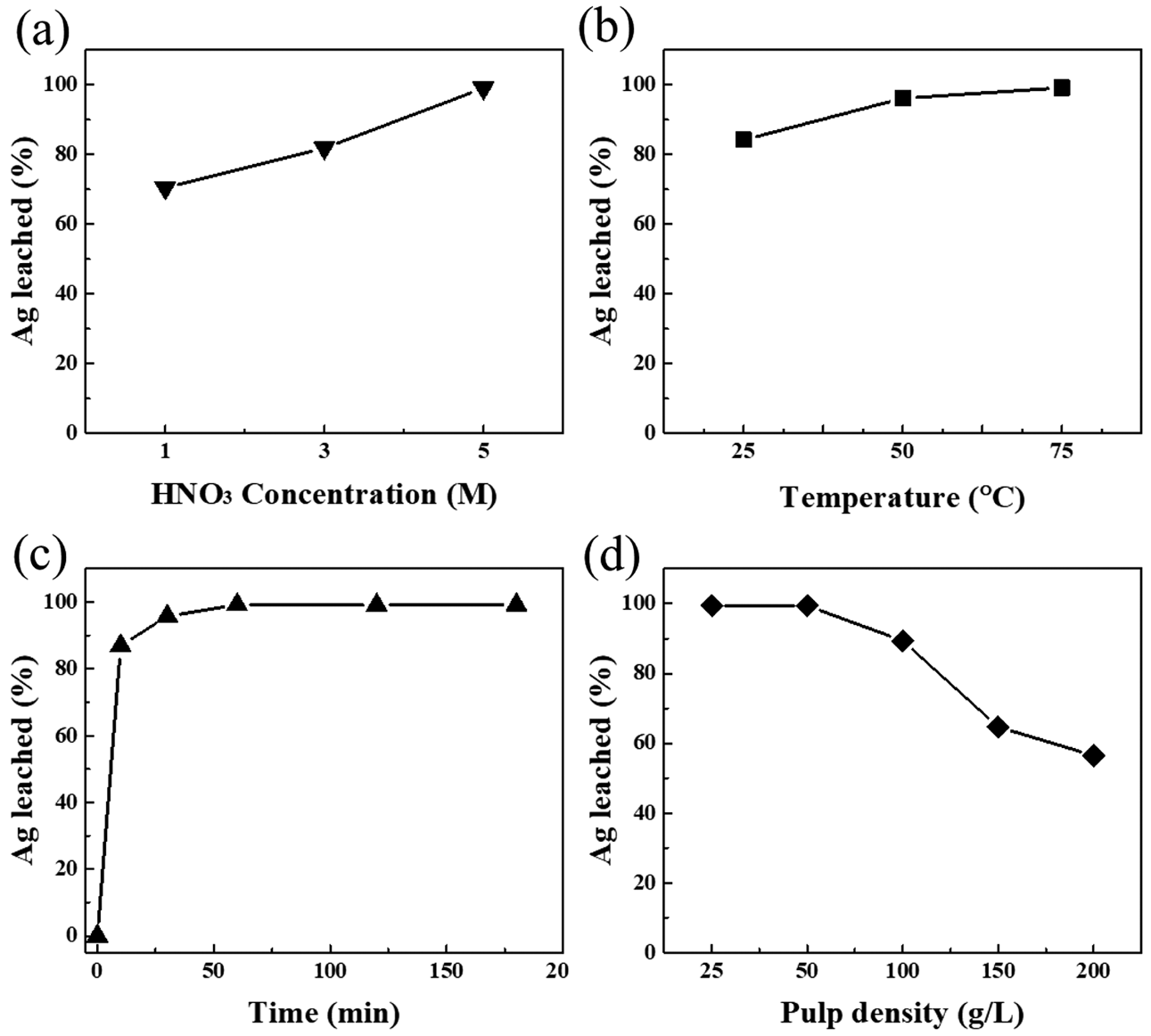
Effect of reaction behavior (a) HNO3 concentration (75°C, 180 min at 25 g/L pulp density), (b) temperature(5 M HNO3, 180 min at 25 g/L pulp density), (c) time(5 M HNO3, 75°C at 25 g/L pulp density) and (d) pulp density(5 M HNO3, 180 min at 75°C) by leaching process from LTCC by-products

Fig. 3.

(a)Effect of [Cl]/[Ag] molar ratio on the reaction behavior of Ag precipitation and (b)elemental concentrations.

Fig. 5.

UV-vis absorption spectra of Ag nanoparticles prepared with various concentrations NaBH4 from AgCl powder; (a) Ag precursor from experimental result and (b) commercial reagent.

Fig. 6.
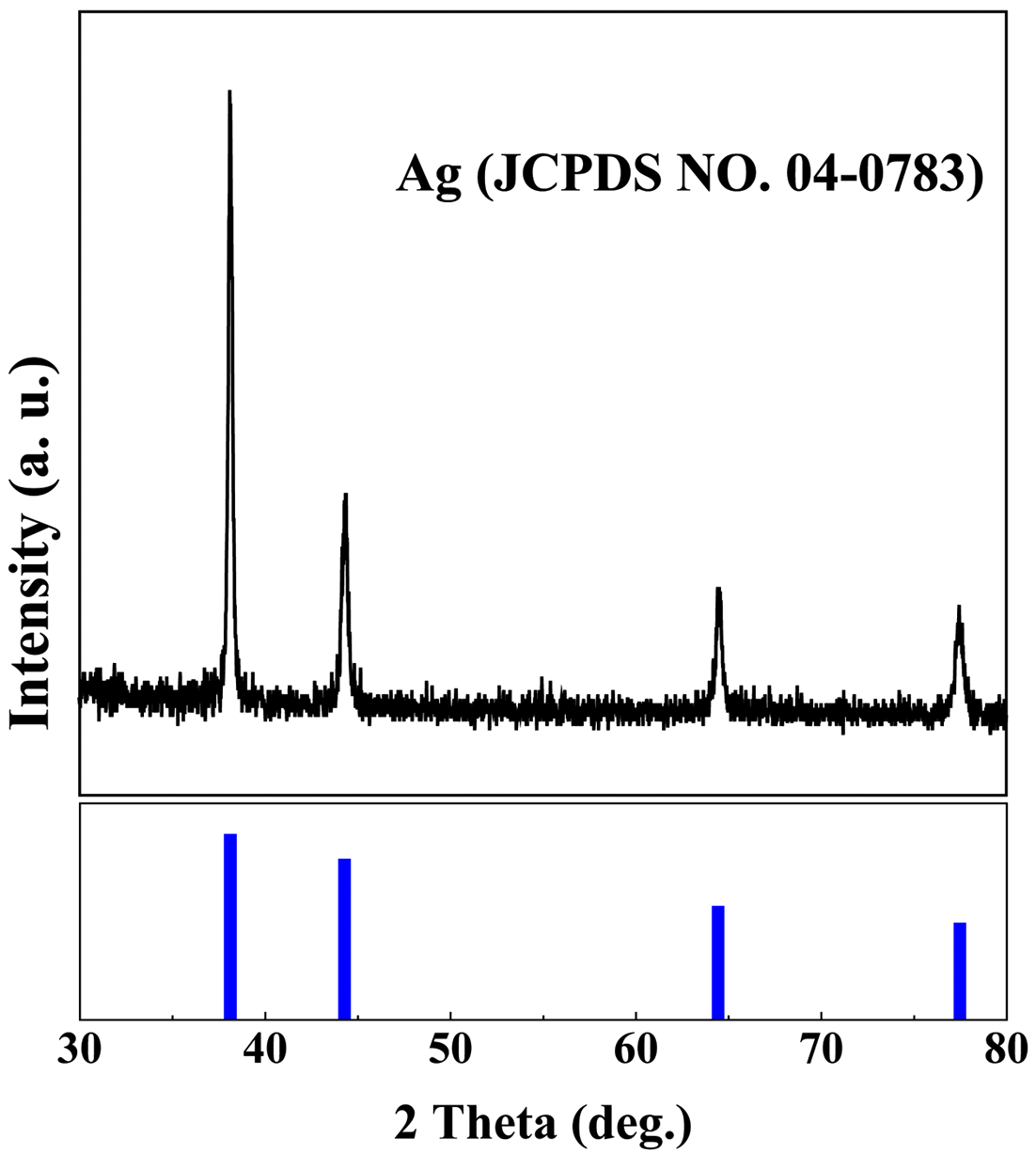
X-ray diffraction patterns of Ag nanoparticle synthesized by wet chemical reduction process.

- 본 연구에서는 LTCC 공정부산물로부터의 선택적인 Ag 의 분리회수 및 나아가 Ag 고순도화를 위해 화학환원공정 을 통해 나노입자를 제조하였다. 최적침출조건 도출을 위해 HNO3 농도, 침출공정의 반응온도, 반응시간 그리고 고액비 에 따른 Ag 침출거동을 확인하였다. HNO3 농도, 침출공정 의 반응온도, 반응시간이 증가함에 따라 Ag 침출률은 전체 적으로 증가하거나 비슷한 효율을 나타내었고, 고액비의 경 우 원료에 비해 상대적으로 용해액인 침출제 농도 저하로 인해 고액비가 증가할수록 Ag 침출률은 감소하였다.
- LTCC 전극공정부산물로부터 얻어진 AgCl 분말을 전구 체로 사용하여 Ag 나노입자를 제조하였으며, 상용시약과 의 비교실험을 통해 차이가 없음을 확인하였다. 원료로부 터의 Ag 전구체를 나노입자 제조에 사용하였으며, 계면활 성제인 PVP 농도가 증가함에 따라 전체적으로 균일한 나 노입자가 합성됨을 알 수 있었고, 환원제로 사용한 NaBH4 농도가 증가함에 따라 나노입자의 평균 입자크기는 감소 하였다. Ag 나노입자 합성을 위해 agent 농도조건에 따른 Ag 나노입자 특성변화를 결정상 분석을 통해 확인하였으 며, EDS 분석결과 제조된 나노입자는 100% Ag 나노입자 를 제조하였음을 확인하였다.
- 최종적으로 LTCC 전극공정부산물로부터의 침출조건 5 M HNO3, 75°C, 60 min, 고액비 50 g/L에서 최적으로 Ag 의 분리회수가 가능하며, Ag가 분리된 침출용액에 [Cl]/ [Ag] 당량비 1.5 이상의 HCl 투입을 통해 AgCl 분말형태 로 Ag를 회수하였고, 99% 이상의 Ag 침전률을 나타내었 다. 계면활성제 PVP를 통해 균일한 입도분포뿐 아니라, 환원제 NaBH4 농도변화를 통한 입도를 제어하였다. 최종 적으로 100% Ag의 고순도 나노입자를 제조하였다.
결 론
-
Acknowledgements
- 본 연구는 산업통상자원비 에너지기술개발사업(과제번 호: 20155020101140)의 지원으로 수행되었습니다.
감사의 글
- 1. E.J. Jang, , Y.H. Kim, , Y.J. Lee, , S.R. Kim and and W.T. Kwon: : J. of Korean Inst. of Resources Recycling.., 19 (2010) 44.
- 2. L.H. Le, , K. Yoo, , J. Jeong and and J. Lee: : J. of Korean Inst. of Resources Recycling., 17 (2008) 48.
- 3. P. Buffat and and J. Borel: : Phys. Rev. A., 13 (1976) 2287.Article
- 4. H.H. Nersisyan, , J.H. Lee, , H.T. Son, , C.W. Won and and D.Y. Maeng: : Mater. Res. Bull.., 38 (2003) 949.
- 5. A. Khaleghi, , S. Ghader and and D. Afzali: : Int. J. Min. Sci. Technol.., 24 (2014) 251.
- 6. Y. Choi: , Korea. KR 10-2007-0039211. (2007.
- 7. K.H. Cho and and S. Park: : J. Korean Ind. Eng. chem.,., 15 (2004) 952.
- 8. P.P. Sun, , H.I. Song, , T.Y. Kim, , B.J. Min and and S.Y. Cho: : Ind. Eng. Chem. Res.., 53 (2014) 20241.Article
- 9. M.S. Alam, , K. Inoue, , K. Yoshizuka, , Y. Dong and and P. Zhang: : Hydrometallurgy., 44 (1997) 245.Article
- 10. J.M.V. Navazo, , G.V. Mendez and and L.T. Peiro: : Int. J. Life Cycle Assess.., 19 (2014) 567.
- 11. Y. Xia, , Y. Xiong, , B. Lim and and S.E. Skrabalak: : Angew. Chem. Int. Ed.., 48 (2009) 60.
- 12. W. Songping and and M. Shuyuan: : Mater. Chem. Phys.., 89 (2005) 423.
- 13. A.A. Ashkarran, , S. Estakhri, , M.R.H. Nezhad and and S. Eshghi: : Phys. Procedia., 40 (2013) 76.
- 14. V.S. Tiwari, , T. Oleg, , G.K. Darbha, , W. Hardy, , J.P. Singh and and P.C. Ray: : Chem. Phys. Lett.., 446 (2007) 77.
- 15. Z. Zhang, , B. Zhao and and L. Hu: : J. Solid State Chem.., 121 (1996) 105.
- 16. K.S. Chou and and C.Y. Ren: : Mater. Chem. Phys.., 64 (2000) 241.
- 17. K.S. Yun, , Y.C. Park, , B.S. Yang, , H.H. Min and and C.W. Won: : J. Korean Powder Metall. Inst.., 12 (2005) 56.
- 18. K. Esumi, , T. Tano, , K. Torigoe and and K. Meguro: : Chem. Mater.., 2 (1990) 564.Article
- 19. Y.Y. Yu, , S.S. Chang, , C.L. Lee and and C.R. Chris Wang: : J. Phys. Chem. B., 101 (1997) 6661.Article
- 20. H. H. Huang, , X. P. Ni, , G. L. Loy, , C. H. Chew, , K. L. Tan, , F. C. Loh and and J. F. Deng: : Langmuir., 12 (1996) 909.Article
- 21. K.S. Yun, , Y.C. Park, , B.S. Yang, , H. Min and and C.W. Won: : J. Korean Powder Metall. Inst.., 12 (2005) 56.
- 22. B. Wiley, , Y. Sun and and Y. Xia: : Acc. Chem. Res.., 40 (2007) 1067.Article
- 23. S. Agnihotri, , S. Mukherji and and S. Mukherji: : RSC Advances., 4 (2014) 3974.
- 24. X. Dong, , X. Ji, , H. Wu, , L. Zhao, , J. Li and and W. Yang: : J. Phys. Chem. C., 113 (2009) 6573.Article
- 25. Z. Zhang and and Y. Wu: : Langmuir., 26 (2010) 9214.Article
- 26. A.P. Simonelli, , S.C. Mehta and and W.I. Higuchi: : J. Pharm. Sci.., 58 (1969) 538.
- 27. G.R. Dey and and K. Kishore: : Radiat. Phys. Chem.., 72 (2005) 565.
- 28. M. Liu, , X. Yan, , H. Liu and and W. Yu: : React. Funct. Polym.., 44 (2000) 55.
- 29. H.S. Wang, , X.L. Qiao, , J. Chena, , X.J. Wang and and S. Ding: : J. Mater. Chem. Phys.., 94 (2005) 449.
- 30. J. S. Bradley: , Clusters and colloids: From theory to applications. (1994.
- 31. D.B. Zhang, , H.M. Cheng and and J.M. Ma: : J. Mater. Sci. Lett.., 20 (2001) 439.
- 32. T.M.D. Dang, , T.T.T. Le, , E. Fribourg-Blanc and and M.C. Dang: : Adv. Nat. Sci. Nanosci. Nanotechnol.., 3 (2012) 035004.Article
Figure & Data
References
Citations
Citations to this article as recorded by 

Study on the Recovery Silver and Nanoparticles Synthesis from LTCC By-products of Lowly Concentrated Silver





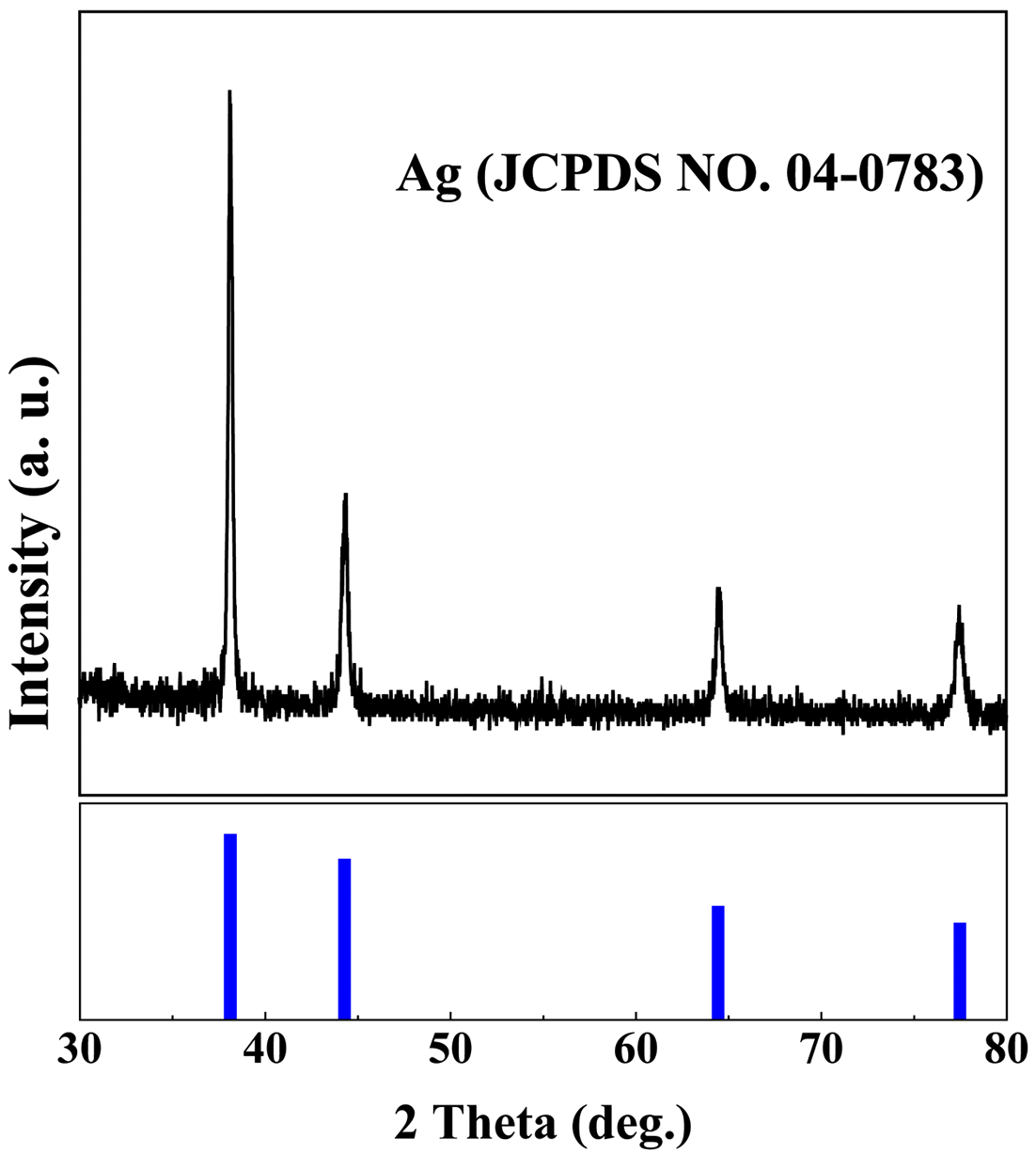
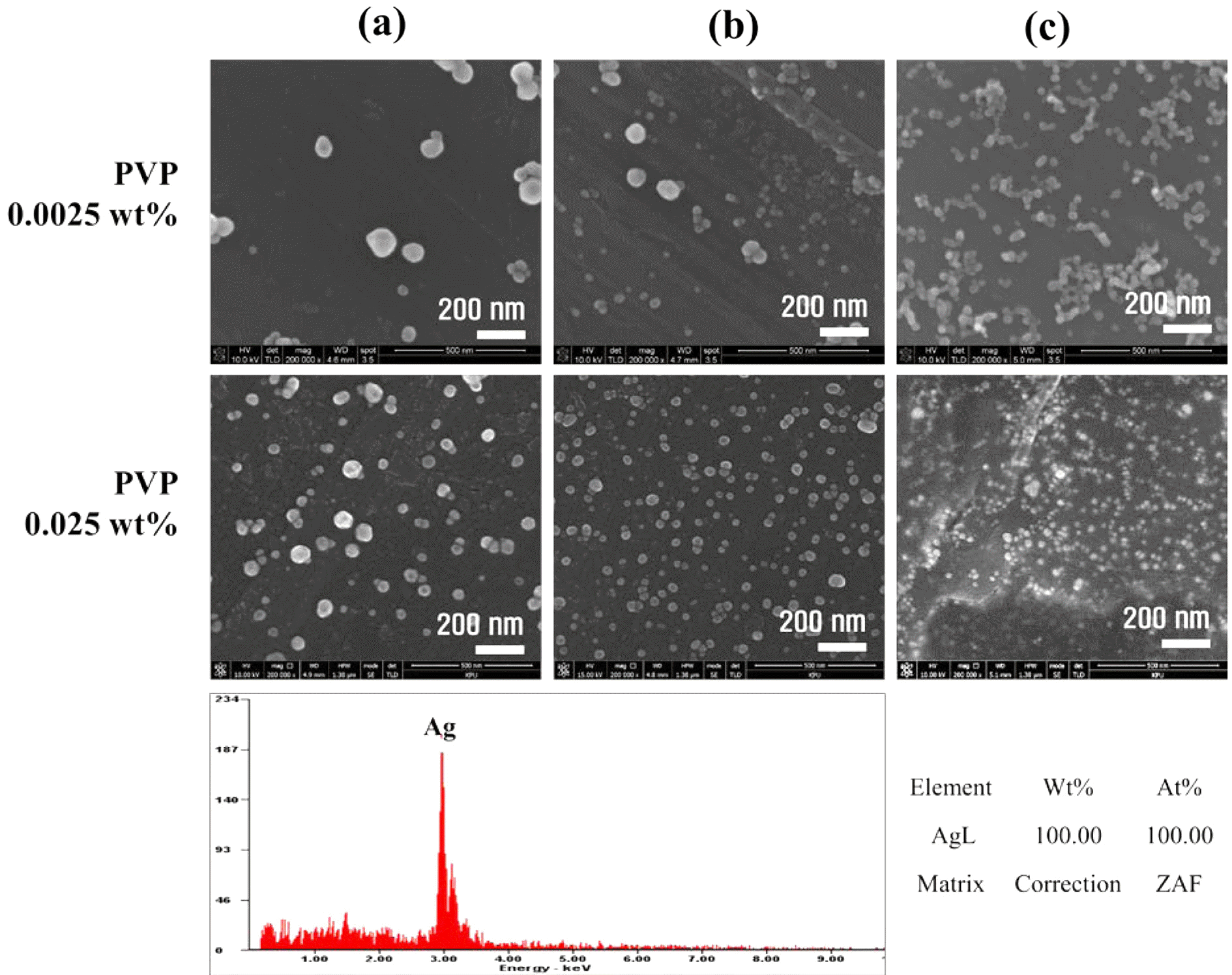
Fig. 1.
Flow chart of Ag recovery and nanoparticles synthesis from LTCC by-product.
Fig. 2.
Effect of reaction behavior (a) HNO3 concentration (75°C, 180 min at 25 g/L pulp density), (b) temperature(5 M HNO3, 180 min at 25 g/L pulp density), (c) time(5 M HNO3, 75°C at 25 g/L pulp density) and (d) pulp density(5 M HNO3, 180 min at 75°C) by leaching process from LTCC by-products
Fig. 3.
(a)Effect of [Cl]/[Ag] molar ratio on the reaction behavior of Ag precipitation and (b)elemental concentrations.
Fig. 4.
X-ray diffraction patterns of AgCl powder synthesized by precipitation process.
Fig. 5.
UV-vis absorption spectra of Ag nanoparticles prepared with various concentrations NaBH4 from AgCl powder; (a) Ag precursor from experimental result and (b) commercial reagent.
Fig. 6.
X-ray diffraction patterns of Ag nanoparticle synthesized by wet chemical reduction process.
Fig. 7.
FE-SEM image of Ag nanoparticles synthesized by wet chemical process with PVP of (a) 0.0025 wt% and (b) 0.025 wt% under various concentrations of NaBH4; (a) 0.005 M, (b) 0.05 M, (3) 0.5 M.
Fig. 1.
Fig. 2.
Fig. 3.
Fig. 4.
Fig. 5.
Fig. 6.
Fig. 7.
Study on the Recovery Silver and Nanoparticles Synthesis from LTCC By-products of Lowly Concentrated Silver
| Metal | Ag | SiO2 | Al2O3 | CaO | SrO | Fe2O3 |
|---|---|---|---|---|---|---|
|
|
||||||
| Content (wt.%) | 1.03 | 48 | 43.3 | 5.12 | 2.44 | 0.06 |
Table 1
Chemical Compositions of LTCC by-product used in the study
Table 1
TOP
 KPMI
KPMI



 Cite this Article
Cite this Article







