Articles
- Page Path
- HOME > J Korean Powder Metall Inst > Volume 28(2); 2021 > Article
-
Review Paper
분말야금을 위한 타이타늄 제련기술 현황 - 손호 상*
- Current Status of Titanium Smelting Technology for Powder Metallurgy
- Ho-Sang Sohn*
-
Journal of Korean Powder Metallurgy Institute 2021;28(2):164-172.
DOI: https://doi.org/10.4150/KPMI.2021.28.2.164
Published online: March 31, 2021
경북대학교 신소재공학부
School of Materials Science and Engineering, Kyungpook National University, Daegu 41566, Republic of Korea
- *Corresponding Author: Ho-Sang Sohn, TEL: +82-53-950-5560, FAX: +82-53-950-6559, E-mail: sohn@knu.ac.kr
- - 손호상: 교수
• Received: April 16, 2021 • Accepted: April 27, 2021
© The Korean Powder Metallurgy Institute. All rights reserved.
- 772 Views
- 8 Download
- 1 Crossref
Abstract
- Titanium is the ninth most abundant element in the Earth’s crust and is the fourth most abundant structural metal after aluminum, iron, and magnesium. It exhibits a higher specific strength than steel along with an excellent corrosion resistance, highlighting the promising potential of titanium as a structural metal. However, titanium is difficult to extract from its ore and is classified as a rare metal, despite its abundance. Therefore, the production of titanium is exceedingly low compared to that of common metals. Titanium is conventionally produced as a sponge by the Kroll process. For powder metallurgy (PM), hydrogenation-dehydrogenation (HDH) of the titanium sponge or gas atomization of the titanium bulk is required. Therefore, numerous studies have been conducted on smelting, which replaces the Kroll process and produces powder that can be used directly for PM. In this review, the Kroll process and new smelting technologies of titanium for PM, such as metallothermic, electrolytic, and hydrogen reduction of TiCl4 and TiO2 are discussed.
- 희소금속인 타이타늄(Ti, titanium)은 1947년에 DuPont 사에서 1톤의 스펀지를 제조하면서 상업 생산이 시작되었 다[1]. Ti의 지각 중 원소 존재도는 9위(0.57%)이지만, 구 조용 금속으로는 Al(8.23%), Fe(5.63%), Mg(2.33%)에 이 어서 네 번째로 풍부한 원소이다[2]. 특히 Ti은 비중이 4.5 g/cm3으로 Fe의 60% 정도이지만 비강도가 높아 고강 도와 경량성을 요구하는 첨단산업의 핵심소재로 사용되고 있을 뿐만 아니라, 생체 적합성이 매우 우수하여 3D 프린 팅 등에 의한 인공관절, 임플란트 등에 널리 사용되고 있 다. 특히 염수 중에서는 매우 우수한 내식성을 가지고 있 어서 해수 담수화 설비나 화학 장치 등에도 널리 사용되 고 있다. 그러나 광석으로부터 금속 Ti을 만드는 제련이 어려워 희소금속(rare metals)으로 분류되고 있으며[3], 일 본, 중국, 러시아 등 몇몇 나라에서만 생산되고 있다.
- Ti 광석 중 경제적인 가치가 있는 것은 루타일(rutile, 95~100% TiO2)과 일메나이트(ilmenite, FeTiO3, 52.7% TiO2)이다. Ti은 산소와의 친화력이 강하여 이러한 Ti 광 석을 선광하여 전처리한 후 TiCl4로 염화시켜 금속 Ti으로 환원하는 제련 방법을 사용하고 있다. 1909년 H unte r가 TiCl4를 Na으로 환원하여 분말 형태의 Ti 제조에 성공하 여 사용되기 시작하였으며[4], 그 이후 1937년에 Kroll이 TiCl4를 Mg으로 환원하여 금속 Ti을 제조하여[5] 오늘에 이르고 있다. 1992년까지 Ti의 공업적 제조 방법은 Hunter 법과 Kroll법이 병존하였으나, 현재 시판되는 Ti은 Kroll법 에 의해서만 제조되고 있다.
- Kroll법은 고순도의 금속 Ti 제조 프로세스로 정착되었 지만, Mg에 의한 TiCl4의 환원과 MgCl2의 분리를 위한 비 용이 많이 들고, 특히 10 톤의 스펀지 Ti 생산에 약 4일이 소요되어 제조비용이 높은 문제점을 가지고 있다. 특히 분말 을 제조하기 위해서는 Ti 스펀지를 HDH(hydride-dehydride) 나 gas atomization 등[6, 7]으로 처리하여야 한다. 따라서 직접 Ti 분말을 만들어 이러한 문제점을 해결할 수 있는 신제련법에 대해 다양한 연구 결과가 발표되어 있다. 본 논문에서는 Hunter법과 Kroll법에 의한 Ti 제련부터 최근 까지 제안되어있는 직접 분말 Ti을 만드는 제련 방법에 대 해서 고찰하였다.
1. 서 론
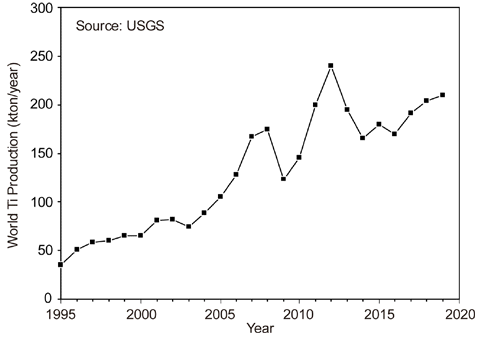
- Fig. 1에는 1995년부터 스펀지 Ti의 생산량 변화를 나타 내었다[3]. 1990년대 초반까지의 생산량은 5만 톤을 넘지 못하였으나, 2000년대에 들어 중국의 가세로 스펀지 Ti의 생산량은 비약적으로 증가하기 시작하여, 2019년에는 약 21만 톤의 스펀지 Ti이 생산되었다. 그러나 전 세계의 Ti 스펀지 생산능력은 약 29.4만 톤이다. 그리고 전 세계 스 펀지 Ti의 약 37%는 중국에서 생산되고 있으며, 일본이 전 세계 생산량의 약 25%를 차지하며, 나머지는 러시아, 카자흐스탄, 우크라이나 등에서 생산되고 있지만, 생산량 의 큰 변동은 없는 편이며[8], 우리나라는 세계 7 위의 Ti 소비국이다.
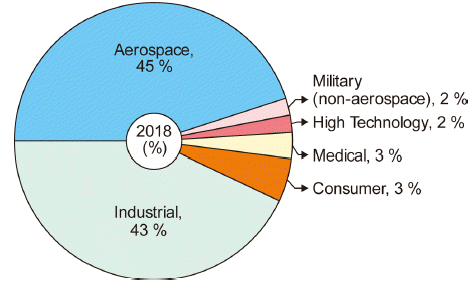
- Fig. 2에는 2018년 기준의 추정 Ti 용도를 나타내었다[7- 9]. Ti의 물리적, 화학적 특성에 따라 전 세계 Ti 생산량의 45%는 항공우주 산업에, 43%는 열교환기, 터빈, 전극, 전 해조 등의 일반 산업용으로 사용되고 있다. 특히 항공 우 주 산업에서는 원소재의 약 10~20%만 제품이 되며 나머 지는 공정 스크랩으로 발생되어[10] Ti의 가격 상승 요인 으로 작용하고 있다. 향후 Ti이 가격 경쟁력을 가진다면 민수용의 수요도 증가할 것으로 예상하고 있다.
2. 타이타늄의 생산량과 용도
- Ti은 산소와의 친화력이 매우 강하고, 또 금속 타이타늄 중으로의 산소 용해도가 매우 크서 산화 타이타늄을 원료 로 한 직접 제련에 의한 고순도 타이타늄의 제조가 곤란 하므로 Hunte r법이나 Kroll법과 같이 TiCl4를 경유하여 금 속 타이타늄을 제조하여 왔다.
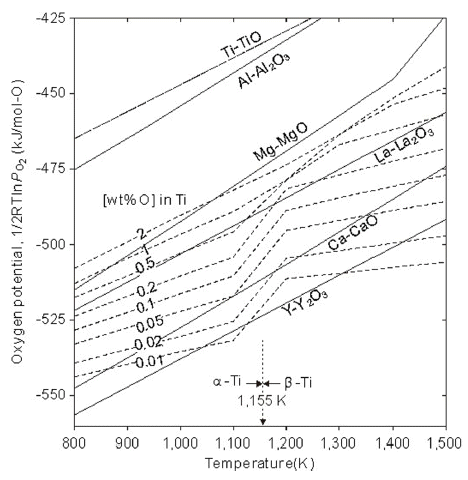
- Ti-O계 상태도를 보면 1,300 K(1,027°C)에서 β-Ti 중 산 소 용해도는 약 1 wt%이며, α-Ti 중 산소 용해도는 약 14 wt%로 금속 Ti 중 산소 용해도가 매우 크다. 이러한 산소 는 Ti의 hcp 구조의 팔면체 격자간에 위치하여 침입형 합 금을 만들어 경하고 취성을 가지게 된다.
- Fig. 3에 Ti-O와 주요한 활성 금속-산화물의 평형 산소 퍼텐샬을 계산하여 나타내었다. 그림으로부터 Ti 산화물 은 Ti-TiO 선보다 아래에 있는 Al이나 Mg, La, Ca, Y 등 으로 환원할 수 있다. 그러나 1 wt% 이하의 저산소 농도 의 금속 Ti은 Ca, La, Y 등의 활성 금속으로만 환원할 수 있다. 특히 희토류 금속의 생산량이 증가하면서 용도가 많 지 않은 La, Y 등을 환원제로 사용하는 연구도 이루어지 고 있다. Ca은 반응 생성물인 CaO의 제거가 곤란한 문제 점이 있으나 많은 연구들이 수행되어 왔다[11, 12]. 그리고 Al이나 C은 Ti과 쉽게 반응하므로 순수한 Ti을 얻을 수는 없으나, TiO2를 Al으로 환원하여 Ti-Al계 화합물을 직접 제조하는 연구들도 이루어지고 있다[13, 14].
3. 타이타늄 제련의 열역학
- 4.1. TiCl4의 제조
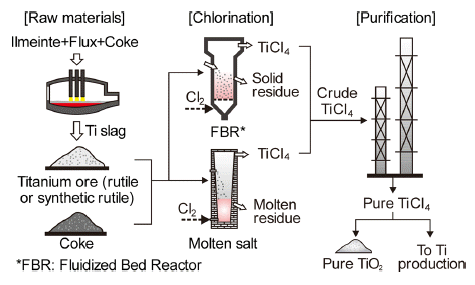
- 기존의 금속 Ti은 Ti원(천연 루타일, 합성 루타일, 고Ti 슬래그 등)과 코크스, 염소가스를 이용하여 TiCl4를 유동 층 염화법이나 용융염 염화법으로 만들고 있으며, Fig. 4 에 이러한 TiCl4 제조공정을 모식적으로 나타내었다. 식(1) 과 같이 TiO2 중의 산소를 제거하기 위해 탄소와 함께 반 응시키면 ΔG0 가 항상 음의 값이므로 TiCl4가 만들어 진다.
- 염화 공정에서 생성된 TiCl4(약 98%)는 불순물을 함유 하므로 끓는점(136°C)이 낮은 특징을 이용하여 염화로 후 단에서 다단 증류탑 등으로 정제하면 99.98% 이상의 순도 를 갖는 TiCl4가 얻어지며, 이것을 TiO2나 금속 Ti 제련의 원료로 사용한다.
- 4.2 Hunter법
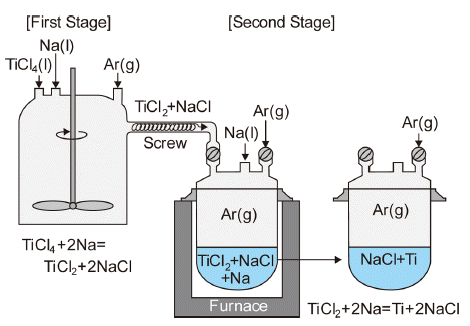
- Hunter법에는 식(2)와 같이 TiCl4와 당량비의 Na을 반응 시켜 Ti을 제조하는 1단법과, TiCl4를 당량보다 적은 Na과 반응시켜 저급 염화물(TiCl2)을 만든 후에 다시 Na과 반응 시켜 환원시키는 2단법이 있다.
- Fig. 5에는 2단법의 공정도를 모식적으로 나타내었다. 2 단법은 식(3)과 같이 TiCl4를 Na과 반응시켜 TiCl2로 환원 한 후, 식(4)와 같이 TiCl2를 금속 Ti으로 환원한다.
- 반응 생성물인 NaCl을 주기적으로 배출하고, 잔류하는 NaCl과 Ti 혼합물은 분쇄한 후에 순수나 0.5%HCl로 침출 하며, 이어서 원심분리와 진공건조를 거쳐 수분이 0.02% 이하인 금속 Ti을 얻는다. 현재는 미국의 HEM(Honeywell Electronic Materials)에서 자체 소비를 위해 소량의 전자 재료용 Ti만 1단법으로 생산하고 있다[15].
- 4.3. Kroll법
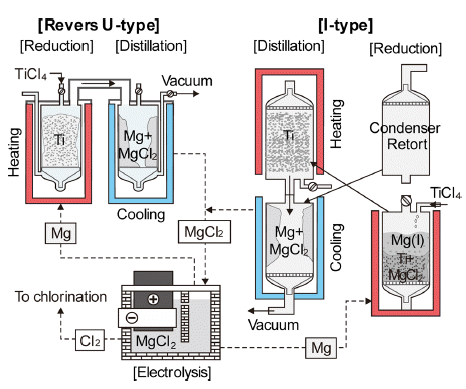
- Kroll법은 TiCl4의 환원제를 Na에서 Mg으로 대체한 것 이며, 환원조와 응축조의 배치에 따라 역U-type과 I-type이 있으며, 반응식은 다음과 같다.
- 식(5)의 반응에서 생성된 부산물인 MgCl2와 미반응한 Mg은 증류시켜 제거한다. Fig. 6에 각각의 공정도를 비교 하여 모식적으로 나타내었다. 역U-type은 일본 등에서 사 용하고 있으며, I-type은 러시아 등에서 사용하고 있고, 중 국은 회사에 따라 두 방법을 모두 사용하고 있다.
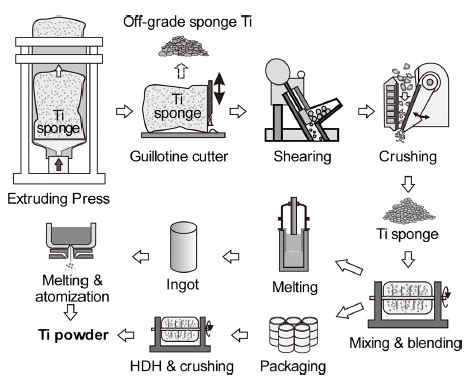
- Fig. 7에는 환원·분리 공정을 거친 스펀지 Ti괴로부터 Ti 분말을 제조하는 공정도를 모식적으로 나타내었다. 환원 조 중의 스펀지 Ti을 프레스로 압출하여 기요틴(guillotine) 으로 F e 등 불순물이 많은 외각부를 제거하여 페로타이타 늄(Fe-Ti) 제조공정으로 보내기도 한다. 그 후 전단 파쇄기 와 크러셔 등으로 적당한 입도까지 분쇄하고 혼합하여 포 장하거나, 압축하여 잉곳을 제조하기 위한 전극을 만든다.
- Ar 분위기 중에서 용접한 전극을 진공 아크로(VAR, vacuum arc remelting)에서 용해하고, 수냉 구리 도가니 중에서 응 고시켜 2차 전극을 만든다. 1차 용해에서는 잉곳 표면이 나 내부에 결함이 존재하므로, 2차 용해를 하거나, 보다 균일한 잉곳을 얻기 위해 3차 용해를 하기도 한다. Ti 잉 곳은 재용해하여 atomizing 등의 방법으로 구형 분말을 만 든다. 한편 분말상의 Ti 스펀지를 HDH 공정을 통해 필요 한 크기의 각형 분말로 만들어 사용한다.
4. Hunter법과 Kroll법 프로세스
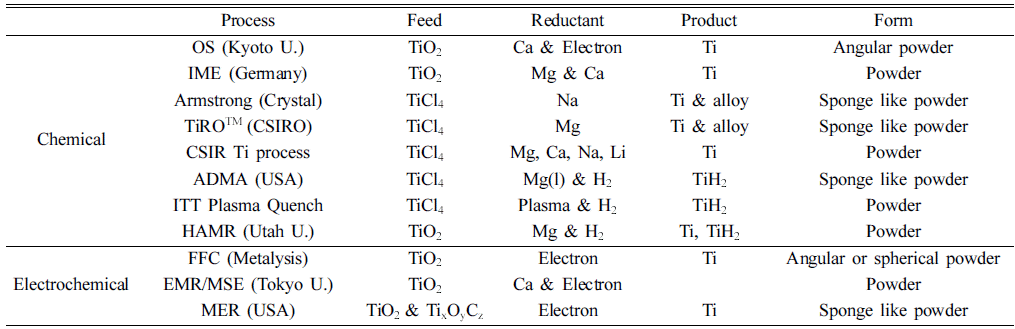
- 현재까지 제안된 주요한 타이타늄 제련법을 종합하여 Table 1에 나타내었다. 타이타늄의 신제련법은 환원방법으 로 보면 금속 열환원법을 포함한 화학적인 방법과 전해 채취법으로 구분할 수 있으며, 화학적인 방법 중에서는 수 소를 이용하는 방법도 포함하였다. 그러나 아직 상업화된 방법은 없으며, 이하에 직접 분말을 제조하는 이러한 Ti의 신제련 프로세스에 대해 고찰하였다.
- 5.1. 금속 열환원법
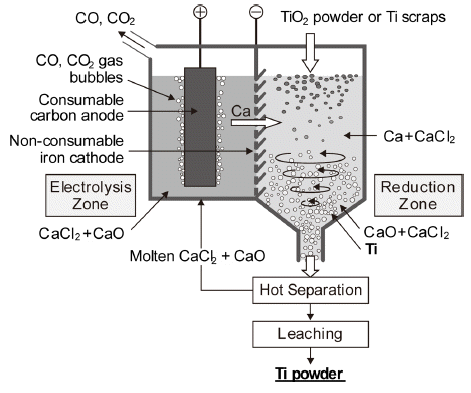
- OS 프로세스는 용융 CaCl2 중에 CaO가 약 20 mol%까 지 용해하는 성질을 이용한 것이며, Fig. 8에 제조 원리를 나타내었다. CaO를 용융염 전해하여 환원제인 Ca을 제조 하고, 금속 Ca을 함유하는 용융염 중에 분말상의 TiO2를 투입하여 Ti 분말을 열환원법으로 제조하는 방법이다[16]. 환원조에서는 다음식과 같이 Ca에 의해 금속 Ti으로 환원 된다.
- 전해조의 anode와 cathode에서의 반응식은 각각 다음과 같다.
- 다만 환원제를 함유하는 다량의 용융염과 생성물인 타이 타늄 분말의 분리 문제, 그리고 에너지 효율이나 오염 등 의 기술적으로 해결하여야 할 과제가 많이 남아 있는 것으 로 보고되고 있다[17]. Suzuki 등은 최근에 FeTiO3나 TiO2 를 TiN으로 만든 후, 다시 Ti 황화물로 바꾸어 소량의 CaS 를 첨가한 용융 CaCl2 중에서 OS 프로세스로 α-Ti을 만들 었으며, 생성된 α-Ti 중의 산소, 질소, 유황의 농도는 각각 0.15, 0.003, 0.002 wt% 이하인 것으로 보고되었다[18].
- 독일의 IME(Institute of Process Metallurgy and Metal Recycling)에서 제안한 방법으로 Fig. 9에 공정도를 나타 내었다[19]. TiO2를 Mg으로 환원한 후에 다시 Ca으로 탈 산하여 산소농도가 0.2 wt% 이하의 Ti 분말을 얻는 방법 이다. Fig. 3에 나타낸 바와같이 TiO2를 Mg으로 환원하면 산소를 약 2 wt% 이하까지 낮출 수 없다. 따라서 1차 환 원한 후에 Ca으로 탈산하는 방법을 제안한 것이다. 탈산 부분에 대해서는 보고되지 않았으나, Ti의 탈산에 대해서 는 비교적 많은 연구들이 수행되어 있고, TiO2를 원료로 사용할 수 있으므로 향후 많은 발전이 기대되고 있다.
- 미국의 International Titanium Powder사에 제안한 것으 로, Fig. 10에 프로세스의 개념도를 재구성하여 나타내었 다[20]. 반응기 중앙에 설치한 노즐을 통하여 TiCl4 가스를 분출시켜 액상의 Na과 반응시키고, 생성된 Ti 분말과 Na 및 NaCl을 여과, 증류, 수세에 의해 분리하여 Ti 분말을 얻는 방법이며, 기본적인 반응식은 H unte r법과 마찬가지 로 다음과 같다.
- 생성된 Ti 분말은 CP Ti Grade 1 정도의 순도를 가지며 Cl도 50 ppm 이하인 것으로 알려져 있다. 그리고 TiCl4와 함께 VCl4, AlCl3를 동시에 공급하여 Ti-6Al-4V 합금 분말 을 직접 제조하는 프로세스도 제안하고 있으나 아직 상업 화되지는 못하고 있다.
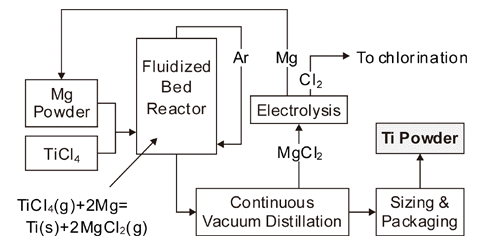
- TIRO법은 호주의 국립연구소인 CSIRO(Commonwealth Scientific and Industrial Research Organization)에서 제안 한 프로세스로서, Fig. 11에 공정도를 나타내었다. Mg 분 말과 TiCl4 가스를 반응기의 아래쪽에서 공급하여 유동층 을 형성시켜서 반응시키는 방법이다[21]. 약 660~690°C 정도에서 액상의 Mg과 기상의 TiCl4가 반응하여 MgCl2상 중에 Ti 입자가 분산된 상태로 회수된다. 반응 생성물은 750~850°C에서 연속적으로 증류하여 MgCl2와 Mg을 제거 한다. TIRO법은 Kroll법과 달리 TiCl4에서 직접 Ti 분말을 연속적으로 얻을 수 있는 장점이 있으며, Armstrong법과 마찬가지로 Ti-6Al-4V 분말을 얻을 수도 있다. 다만 실험 실 규모에서는 산소농도가 0.25 wt% 이상이며, 50 kg/day 정도의 파일럿 규모에서는 산소농도가 감소할 가능성은 있으나 아직 연구 단계에 있다.
- 남아공의 CISIR-Ti 프로세스는 TiCl4를 알칼리 금속이 나 알칼리 토금속으로 환원하여 연속적으로 Ti 분말을 제 조하는 것이며, Fig. 12에 공정도를 나타내었다[22]. 우선 TiCl4를 Ti이나 금속 환원제(Mg, Ca, Na, Li 등)으로 TiCl2 까지 부분 환원한 후, 2단계에서 TiCl2를 다시 금속 환원 제로 Ti까지 환원하며 각각의 반응식은 다음과 같다.
- 시간당 2 kg의 Ti 분말을 제조하는 파일럿 공장에서 성 공적인 실증을 마쳤으며, 현재 년간 500 톤 및 10,000 톤 을 생산할 수 있는 프로세스를 개발 중인 것으로 알려져 있다[23].
- 5.2. 수소를 이용한 환원법
- ADMA법은 TiCl4를 Mg으로 환원하는 Kroll법에서 Mg 의 일부를 H2로 대체하여 Ti 스펀지 대신에 TiH2를 직접 만드는 방법이다. 즉, TiCl4와 H2를 동시에 Mg 중으로 취 입하고, 환원, 증류하여 TiH2를 만든다. H2에 의해 환원 시 간의 단축과 Mg 이용율을 높일 수 있는 장점이 있다. 특 히 MgCl2의 진공증류 시간을 80% 정도 단축시킬 수 있고, 생성된 TiH2는 환원조에서 곧바로 파쇄하여 분말로 만들 수 있는 것으로 알려져 있다[24, 25].
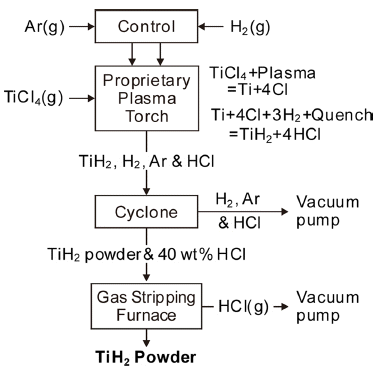
- ITT법은 진공 분위기에서 4,000 K이 넘는 플라즈마 열 원으로 TiCl4를 열분해하고 H2로 급냉하여 TiH2 분말을 만드는 것으로, Fig. 13에 공정도를 재구성하여 나타내었 다[26]. 기본적인 반응식은 다음과 같다.
- 특히 수소는 de-laval 노즐을 통해 분사되어 가스의 확 장과 냉각이 일어나며, 응축된 Ti 입자와 반응하여 TiH2를 생성하고, 염소와 반응하여 HCl(g)가 생성된다. 이러한 수 소의 급냉 및 환원 효과에 의해 Ti과 염소의 역반응을 방 지할 수 있다. 생성된 분말은 구형이지만 크기가 1~10 μm 수준이어서 일반적인 분말야금에 사용할 수 있는 50~300 μm 정도가 되도록 연구를 수행하고 있는 것으로 알려져 있다.
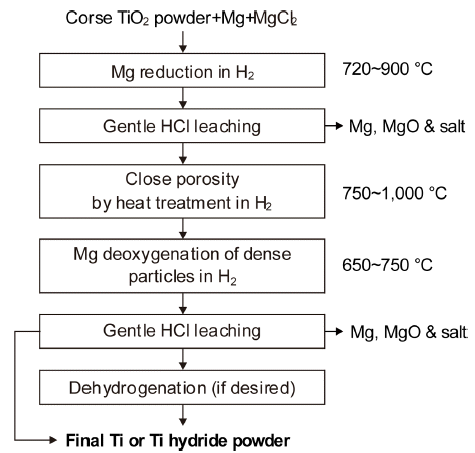
- HAMR법은 미국의 Utah대에서 제안한 것으로, ADMA 나 ITT법과 달리 출발 원료로 TiO2를 사용한다. H2 분위 기 중에서 MgCl2 중의 Mg으로 TiO2를 환원하여 약 1~2 wt%O의 Ti 분말을 만들고 다시 Mg으로 탈산하여 0.15 wt%O 이하의 Ti이나 TiH2 분말을 만드는 것이며, Fig. 14 에 공정도[27, 28]를 재구성하여 나타내었다. 수소 분위기 중에서 Mg으로 환원한 Ti-O-H 분말 중의 MgO와 잔류하 는 Mg 및 수용성 염을 묽은 염산으로 제거하고 비표면적 을 줄이기 위해 열처리를 한다. 그후 다시 수소 분위기 중 에서 Mg으로 탈산하고 반응 생성물 등은 묽은 염산으로 제거하여 TiH2 분말을 얻거나 필요에 따라 탈수소하여 Ti 분말을 얻는다.
- 이 방법은 한 배치당 2~3일 소요되는 반 회분식이지만, 상용화되면 년간 1,000~10,000톤 정도의 Ti 분말을 생산 할 수 있는 것으로 알려져 있다. 현재 Utah 대학에서는 HAMR법에서 수백 kg의 CP Ti 분말을 얻을 수 있는 스 케일 업에 대해 연구 중에 있다.
- 5.3 전해 채취법
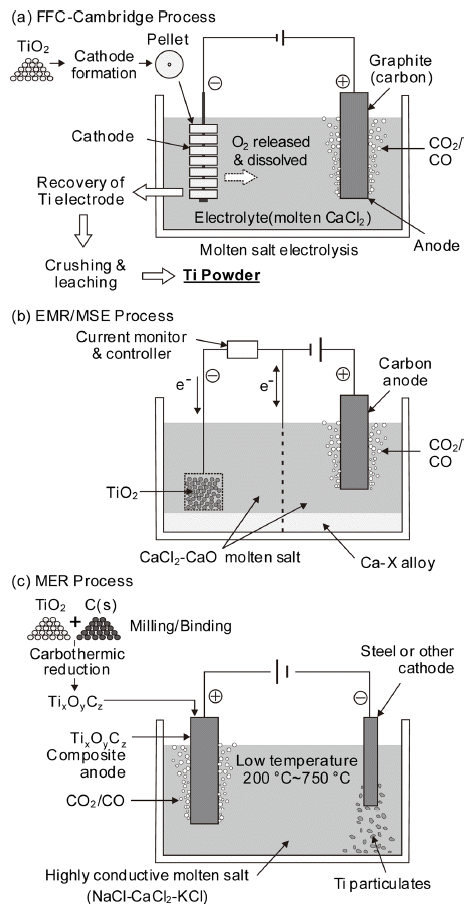
- FFC-Cambridge process(Fray-Farthing-Chen)는 TiO2를 원료로 사용하는 직접 전해법으로 Fig. 15(a)에 프로세스 의 원리를 나타내었다[29]. TiO2 분말을 소결하여 성형한 것을 음극(cathode), 탄소를 양극(anode)으로 하여 용융 CaCl2 중에 침지시켜 다음의 반응식과 같이 전해 환원으 로 금속 Ti을 얻는 방법이다.
- Anode에서는 산화반응이 일어나며 반응식은 다음과 같다.
- 특히 이 방법은 원료가 산화물이므로 Kroll법 등과 달리 염화공정이 필요없고 연속화가 가능하여 주목받았다. 영 국의 Metalysis사가 Ti는 물론 Ta도 전해법으로 제조하는 상업화를 시도하고 있으나 생산성 문제 등이 남아 있다.
- EMR(Electronically Mediated Reaction)/MSE(Molten Salt Electrolysis)법도 전기화학적인 방법으로, Fig. 15(b) 에 전해조를 모식적으로 나타내었다[30]. 금속 열환원반응 을 전기화학적인 산화환원반응으로 만들어 EMR에 의한 타이타늄의 환원과 MSE에 의한 환원제의 용융염 전해로 구성되어 있으며, FFC법과 OS법을 결합한 방법이다. 특 히 이 방법은 불순물에 의해 오염된 환원제를 이용하여도 고순도의 금속을 제조하는 것이 가능하게 된다는 원리를 이용하였다. 그러나 장치 설계상의 제약이 많은 결점 등이 있는 것으로 보고되어 있다.
- 최근 Okabe 등은 EMR/MSE법을 응용하여 TiO2로부터 희토류 금속을 환원제로 이용한 Ti 분말 제조나 저급 Ti의 탈산에 대해 많은 연구를 수행하고 있다[31-33]. 특히 Fig. 3에 나타낸 바와 같이 Y 등을 환원제로 사용하면 Ti 중 산 소를 저농도까지 낮출 수 있는 장점이 있으며, 희토류 금 속의 생산량이 증가하면서 큰 용도가 없는 희토류 금속이 부수적으로 생산되어 경제성도 확보할 수 있는 것으로 알 려져 있다.
- MER(Materials & Electrochemical Research Corporation) 법도 전기화학적인 반응을 이용하는 방법이지만, TiO2를 원료로 사용하는 FFC법 등과는 달리 oxycarbide(TixOyCz) 를 원료로 사용하며, Fig. 15(c)에 개요를 나타내었다[34]. 우선 anode는 식(11)과 같이 TiO2를 진공이나 불활성 분 위기에서 탄소로 열환원(1,200~2,100°C)하여 oxycarbide (TixOyCz) 상태로 만든다.
- Anode와 cathode에서 일어나는 전해 반응은 각각 다음 과 같다.
- FFC법에서는 cathode 자체가 환원되어 금속 Ti이 만들 어지지만, MER법에서는 구리의 전해 정제와 유사하게 anode에서 용해되어 나온 Ti 이온이 cathode에 석출되어 전해조 바닥으로 침강된다.
5. Ti의 신제련법
(1) OS 프로세스
(2) TiO2의 Mg/Ca 환원
Fig. 9
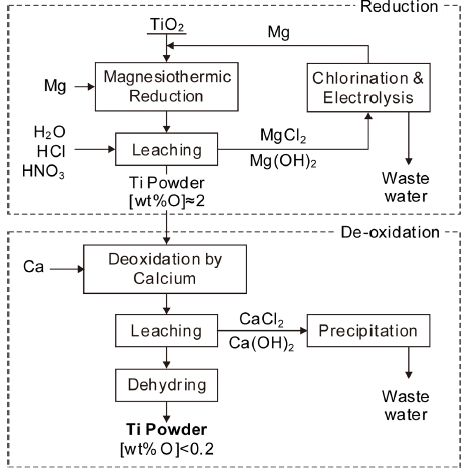
Proposed process to produce titanium powder by magnesiothermic reduction from Rutile and deoxidation by Ca.

(3) Armstrong법
(4) TIRO법
(5) CSIR-Ti 프로세스
(1) ADMA Process
(2) ITT(Idaho Titanium Technologies)법
(3) HAMR(Hydrogen-Assisted Magnesiothermic Reduction) 프로세스
(1) FFC-Cambridge process
(2) EMR/MSE법
(3) MER법
- Kroll법을 대체하여 TiCl4나 TiO2로부터 직접 분말을 제 조할 수 있는 Ti의 신제련법에 대해 고찰하였다. Kroll법 은 저산소 농도의 순수한 Ti을 제조할 수 있는 제련법이 지만, 제련에 장시간이 소요될 뿐만 아니라 생성된 Ti 스 펀지를 분말화하기 위해 별도의 공정이 필요하다. 원료적 인 측면에서의 신제련법은 TiCl4를 이용하는 방법과 TiO2 를 이용하는 방법으로 구분할 수 있으며, 환원방법 측면에 서는 금속 열환원법, 전해채취법, 그리고 수소를 활용하여 Ti 하이드라이드를 만드는 방법으로 구분할 수 있다. 다만 이러한 신제련법은 경제성과 생산성 측면에서 입증되지 못하여 상용화되지 못하고 있는 실정이다. 한편 신제련법 은 분말을 직접 만들 수 있고, 특히 TiO2를 원료로 사용한 다면 설비비 측면에서 매우 유리한 제련법이 되어 Ti의 분 말야금에 큰 기여를 할 수 있을 것으로 기대되고 있다.
5. 결 론
-
Acknowledgements
- 본 논문은 산업통상자원부의 산업기술혁신사업 중 산업 핵심기술개발사업의 지원에 의해 연구되었으며, 이에 감 사드립니다(과제번호: 10063143).
감사의 글
- 1. W. Kroll: J. of The Franklin Institue, 260 (1955) 169..Article
- 2. H. S. Sohn: Recycling of Common Metals, KNU Press, Daegu, (2020) 17..
- 3. H. S. Sohn: J. of Korean Inst. of Resources Recycling, 29 (2020) 3..
- 4. M. A. Hunter: J. Am. Chem. Soc., 32 (1910) 330..Article
- 5. W. Kroll: Trans. Electrochem. Soc., 78 (1940) 35..Article
- 6. P. Sun, Z. Z. Fang, Y. Zhang and Y. Xia: JOM, 69 (2017) 1853..Article
- 7. Z. Z. Fang, J. D. Paramore, P. Sun, K. S. Ravi Chandran, Y. Zhanga, Y. Xia, F. Cao, M. Koopman and M. Free: Int. Mater. Rev., 63 (2018) 407..Article
- 8. H. S. Sohn: Resources Recycling, 30 (2021) 26..
- 9. A. Coggins: Titanium Metal-global Supply and Demand Trends Overview, Procd. of TITANIUM USA 2019, Mobile, AL, 25 Sept. 2019..
- 10. O. Takeda and T. H. Okabe: JOM, 71 (2019) 1981..Article
- 11. M. W. Yoon and H. S. Sohn: J. of Korean Inst. Of Resources Recycling, 22 (2013) 1..Article
- 12. T. Oishi, T. H. Okabe and K. Ono: Kekinzoku, 43 (1993) 392..Article
- 13. M. Maeda, T. Yahata, K. Mitugi and T. Ikeda: JIM, 34 (1993) 599..Article
- 14. S. Hassan-Pour, C. Vonderstein1, M. Achimovičová, V. Vogt, E. Gock and B. Friedrich: Metall. Mater. Eng., 21 (2015) 101..Article
- 15. G. M. Bedinger: Titanium, USGS 2016 Minerals Yearbook (2016) 79..
- 16. R. O. Suzuki, K. Teranuma and K. Ono: Metall. Mater. Trans. B, 34B (2003) 287..Article
- 17. T. H. Okabe: Keikinzoku, 55 (2005) 537..
- 18. E. Ahmadi and R. O. Suzuki: Metall. Mater. Trans. B, 51B (2020) 140..Article
- 19. R. Bolívar and B. A. Ramon: IJMET, 10 (2019) 272..
- 20. G. Crowley: Adv. Mater. Processes, 161 (2003) 25..
- 21. A. Kracke: Titanium Alloy Powder-Accelerating Demand for Years to Come, Procd. of Titanium USA 2018, ITA, Las Vegas, NV, 2018..
- 22. David S. van Vuuren: Titanium Powder Metallurgy, Ma Qian and Francis H. (Sam) Froes (Ed.), Elsevier, (2015) 69..Article
- 23. S. J. Oosthuizen and J. J. Swanepoel: Conference of the South African Advanced Materials Initiative (CoSAAMI- 2018), Materials Science and Engineering, 430 (2018) 1..Article
- 24. V. Duz, V. S. Moxon, A. G. Klevtosv and V. Sukhoplyuyev: ADMA Process for Hydrogenated Titanium Powder Production, Procd. of Titanium 2013, Las Vegas NV, Oct.6-9 (2013)..
- 25. V. S. Moxson, V. A. Duz, A. G. Klevtsov, V. D. Sukhoplyuyev, M. D. Sopka, Y. V. Shuvalov and M. Matviychuk: USA, US 9,067.264 B2 (2015)..
- 26. R. A. Cordes and A. Donaldson: Titanium Metal Powder Production by the Plasma Quenching Process, Final Technical Report DE-FC07-97ID13511, USA, (2000) 16..Article
- 27. Y. Zhang, Z. Z. Fang, Y. Xia, P. Sun, B. V. Devener, M. Free, H. Lefler and S. Zheng: Chem. Eng. J., 308 (2017) 299..Article
- 28. H. Lefler, Z. Z. Fang, Y. Zhang, P. Sun and Y. Xia: Metall. Mater. Trans. B, 49B (2018) 2998..Article
- 29. G. Z. Chen, D. J. Fray and T. W. Farthing: Nature, 407 (2000) 361..ArticlePubMed
- 30. T. H. Okabe: Keikinzoku, 55 (2005) 537..
- 31. T. H. Okabe, C. Zheng and Y. Taninouchi: Metall. Mater. Trans. B, 49B (2018) 1056..Article
- 32. C. Zheng, T. Ouchi, L. Kong, Y. Taninouchi and T. H. Okabe: Metall. Mater. Trans. B, 50B (2019) 1652..Article
- 33. L. Kong, T. Ouchi, C. Zheng and T. H. Okabe: J. Electrochem. Soc., 166 (2019) E429..Article
- 34. W. V. Tonder: M.S. Thesis, SOUTH AFRICAN TITANIUM: Techno-Economic Evaluation of Alternatives to the Kroll Process, Stellenbosch Univ. South Africa, (2010) 108..
Figure & Data
References
Citations
Citations to this article as recorded by 

- Enhancing corrosion resistance of Ti-based amorphous alloy powders via misch metal addition
Yeon Joo Lee, Hyokyung Sung, Jae Bok Seol, Kisub Cho, Hwi Jun Kim, Hyunjoo Choi
Powder Metallurgy.2025; 68(3): 230. CrossRef
Current Status of Titanium Smelting Technology for Powder Metallurgy
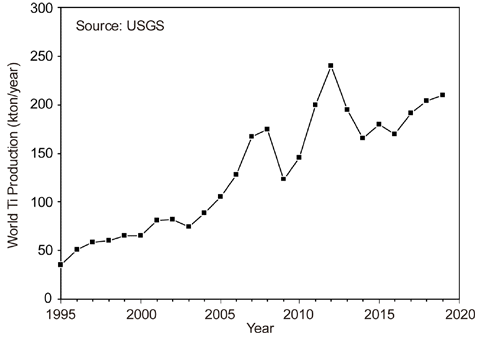


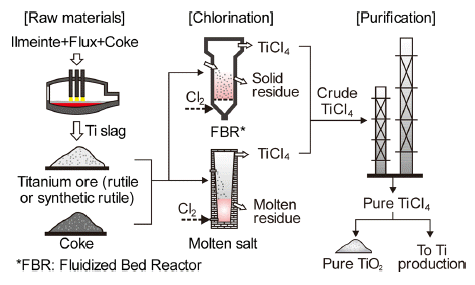

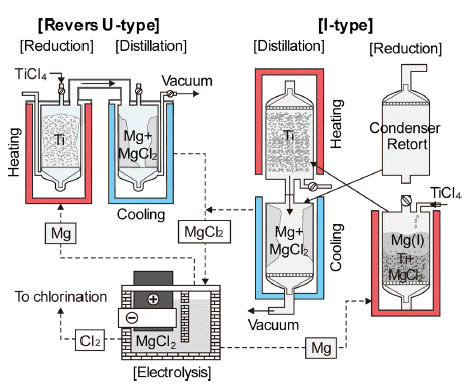

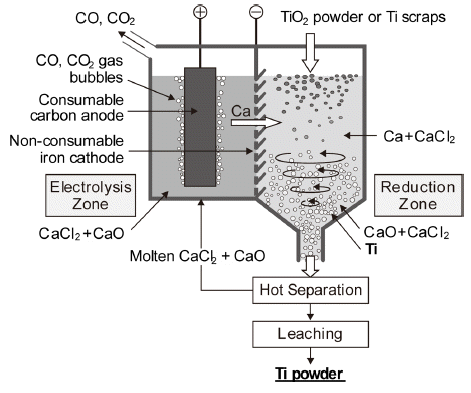
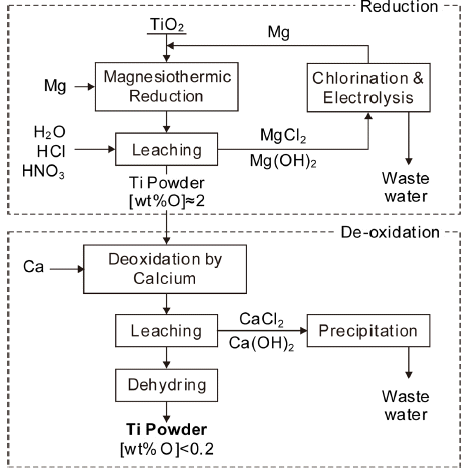
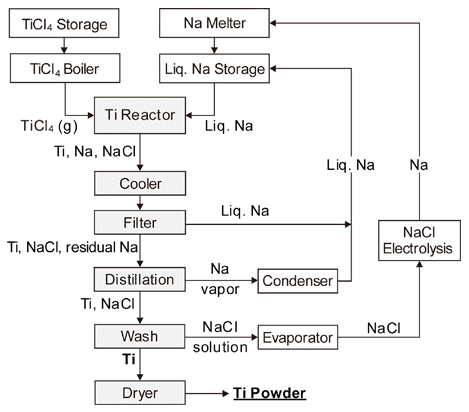
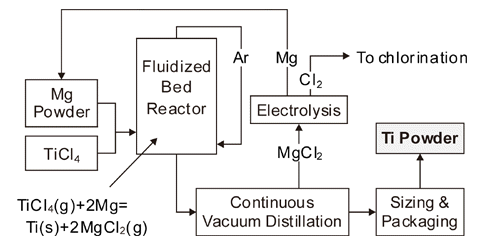
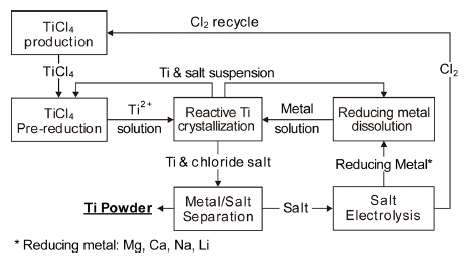
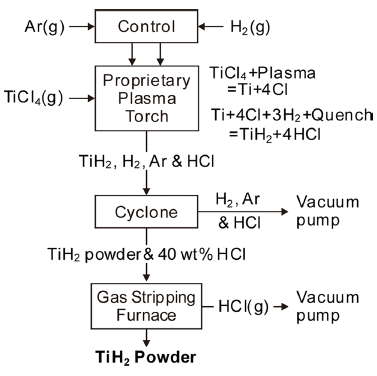
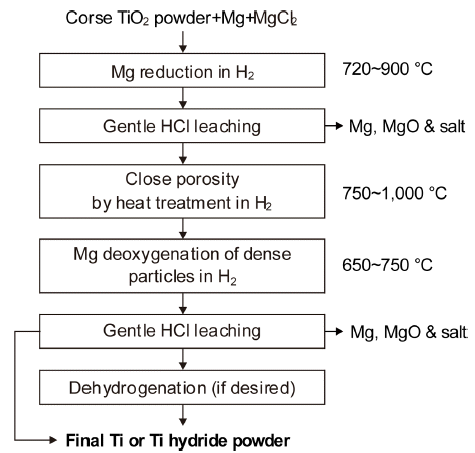

Fig. 1
Changes in worldwide Ti sponge production.
Fig. 2
Estimated mill products demand in 2018.
Fig. 3
Ellingham diagrams of some selected oxides and the solid solution of Ti-O.
Fig. 4
Schematic diagram of TiCl4 production process.
Fig. 5
Ti sponge production by two stage sodium reduction process.
Fig. 6
Process flow of Kroll process.
Fig. 7
Schematic diagram of Ti sponge treatment and Ti powder production.
Fig. 8
Schematic diagram of OS process(single model).
Fig. 9
Proposed process to produce titanium powder by magnesiothermic reduction from Rutile and deoxidation by Ca.
Fig. 10
Process flow diagram of the Armstrong/ITP process.
Fig. 11
Schematic diagram of CSIRO’s TiRO™ continuous process for CP titanium powder production.
Fig. 12
Flow chart of CSIR-Ti process.
Fig. 13
Basic process flow diagram of the plasma quench reactor system.
Fig. 14
Flowchart of the HAMR process.
Fig. 15
Comparison of electrochemical reduction processes.
Fig. 1
Fig. 2
Fig. 3
Fig. 4
Fig. 5
Fig. 6
Fig. 7
Fig. 8
Fig. 9
Fig. 10
Fig. 11
Fig. 12
Fig. 13
Fig. 14
Fig. 15
Current Status of Titanium Smelting Technology for Powder Metallurgy
Table 1
Summary of Titanium reduction technologies
Table 1
TOP
 KPMI
KPMI



 ePub Link
ePub Link Cite this Article
Cite this Article















