Articles
- Page Path
- HOME > J Powder Mater > Volume 30(1); 2023 > Article
-
Article
리튬이온의 선택적 투과를 위한 Lithium Lanthanum Titanate계 분리막 제조 공정 개발 - 김영일a,†, 박상철a,b,†, 신광호c, 김인영a, 이기안b, 정성균c,*, 이빈a,d,*
- Development of Lithium Lanthanum Titanate (LLTO) Membrane Manufacturing Process for Selective Separation of Lithium Ion
- Young Il Kima,†, Sang Cheol Parka,b,†, Kwang Ho Shinc, InYeong Kima, Kee-Ahn Leeb, Sung-Kyun Jungc,*, Bin Leea,d,*
-
Journal of Korean Powder Metallurgy Institute 2023;30(1):22-28.
DOI: https://doi.org/10.4150/KPMI.2023.30.1.22
Published online: January 31, 2023
a 한국생산기술연구원 한국희소금속산업기술센터
b 인하대학교 신소재공학과
c 울산과학기술원 에너지화학공학과
d 과학기술연합대학원대학교 융합제조시스템공학과
a Korea Institute for Rare Metals, Korea Institute of Industrial Technology, Incheon 21655, Republic of Korea
b Department of Materials Science and Engineering, Inha University, Incheon 22121, Republic of Korea
c School of Energy and Chemical Engineering, Ulsan National Institute of Science and Technology (UNIST), Ulsan 44919, Republic of Korea
d Convergence Manufacturing System Engineering, University of Science & Technology, Daejeon 22792, Republic of Korea
-
* Corresponding Authors: Bin Lee, TEL: +82-32-226-1355, FAX: +82-32-226-1373, E-mail: lbin@kitech.re.kr
Sung-Kyun Jung, TEL: +82-52-527-3030, FAX: +82-52-217-0113, E-mail: skjung@unist.ac.kr -
- 김영일: 연구원, 박상철, 신광호, 김인영: 학생연구원, 이기안·정성균: 교수, 이 빈: 수석연구원
†These authors contributed equally to this work.
© The Korean Powder Metallurgy Institute. All rights reserved.
- 2,495 Views
- 40 Download
- 1 Crossref
Abstract
- The global demand for raw lithium materials is rapidly increasing, accompanied by the demand for lithiumion batteries for next-generation mobility. The batch-type method, which selectively separates and concentrates lithium from seawater rich in reserves, could be an alternative to mining, which is limited owing to low extraction rates. Therefore, research on selectively separating and concentrating lithium using an electrodialysis technique, which is reported to have a recovery rate 100 times faster than the conventional methods, is actively being conducted. In this study, a lithium ion selective membrane is prepared using lithium lanthanum titanate, an oxide-based solid electrolyte material, to extract lithium from seawater, and a large-area membrane manufacturing process is conducted to extract a large amount of lithium per unit time. Through the developed manufacturing process, a large-area membrane with a diameter of approximately 20 mm and relative density of 96% or more is manufactured. The lithium extraction behavior from seawater is predicted by measuring the ionic conductivity of the membrane through electrochemical analysis.
- 리튬 및 리튬 화합물은 배터리 산업을 포함한 세라믹, 유리, 제약, 항공 우주 및 원자력 산업 등 많은 분야에서 널리 사용되고 있다[1-4]. 특히 리튬은 이론적 비용량이 높고 낮은 전기화학적 전위로 인해 기존 전자기기용 리튬 이온 배터리(LIB)에 사용되어 왔지만, 최근 차세대 모빌리 티(전기 자동차, 드론 등)의 급속한 발전에 따라 수요가 기 하급수적으로 증가하고 있다[5-7]. 실제로 리튬의 사용량 은 2010년에는 23,500 톤이 사용된 것에 비해, 2021년에 는 283% 증가한 93,000 톤이 사용되었다[8]. 그에 따라, 육지에 존재하는 매장량에 1/3에 해당하는 양이 향후 30 년 내에 소비될 것으로 예상된다[9].
- 현재 대부분의 상업용 리튬은 육지의 광석 혹은 염수에 서 공급되고 있으며, 총 매장량의 98% 이상이 칠레, 아르 헨티나, 중국 및 호주에 집중되어 있다[10]. 이에 비하면, 해수에는 육지의 리튬 매장량보다 약 2,000배 많은 2,300 억 톤의 리튬이 매장되어 있다[11]. 즉, 어디서든 고르게 존재하는 해수는 거의 무한한 리튬 자원으로서 미래의 리 튬 공급원으로 유망하다. 하지만, 해수용존 리튬 양은 매 우 적은 양(0.1~0.2 ppm), 나트륨, 칼륨 및 마그네슘 이온 과 같이 화학적으로 유사한 이온의 존재로 인해 선택적으 로 리튬을 추출하는 것은 매우 어려운 과제이다[12-14].
- 최근 해수에서 리튬을 추출하기 위해 흡착[15, 16], 전기 분해[17, 18] 및 전기투석[7, 19-21]을 기반으로 하는 연구 가 진행되었다. C. Lui 등은 L iFe PO4 전극의 Li/Na 선택 도를 개선하기 위해 TiO2 코팅을 사용한 펄스 전기화학적 흡착 공정 연구를 보고하였다. 우수한 리튬이온 선택적 추 출률을 보였으나 공정이 상대적으로 복잡하고 느리다는 단점이 있다[15]. S. Yang 등은 해수에서 농축된 LiClO4 기반 유기 전해질을 이용하여 금속 리튬을 생산하는 전기 분해 공정을 개발하였다. 해당 공정은 다른 공정보다 빠르 다는 장점이 있지만 고전압(4.5V 이상)이 필요하며 밀폐 된 공간에서 산화성이 높은 과염소산염에 환원성 금속 리 튬 및 가연성 유기 전해질이 혼합될 경우 안전 문제가 발 생할 수 있다는 단점이 있다[17].
- 이에 반해, 리튬이온 선택적 분리막을 통한 전기투석 공 법으로 리튬을 추출하는 공정은 흡착 및 전기분해 공정에 비해 안정성이 높고, 공정이 빠르며 효율적이다[7]. 그러 나, T. Hoshino 등은 Li/Na 분리를 하기 위해 리튬 이온 전도성 유리-세라믹(Lithium ion conduction glass-ceramic (LICGC)) 선택적 분리막을 사용한 전기투석법을 개발하 였지만 회수율을 높이기 위해 큰 전압을 가했을 때 LICGC에 균열이 가해져 보다 안정적인 소재를 선택하고 이를 제조해야 하는 기술적 해결사항이 존재한다[19-21].
- 전기투석법을 이용한 리튬 추출을 위한 이온 선택적 분 리막 소재로, 고상(solid state)으로 리튬이온을 투과 또는 전도시킬 수 있는 고체 전해질과 유사한 소재가 주로 활 용되며, 대표적으로 나트륨 초이온 전도체(Sodium super ionic conductor(NASICON) 등), 황화물계, 가넷 구조(Lithium lanthanum zirconium oxide(LLZO) 등) 및 페로브스 카이트(perovskite) 구조(Lithium lanthanum titanium oxide (LLTO) 등) 등이 있다[22-25]. 해수에서 리튬을 추출하기 위한 분리막 소재로 활용하기에는 NASICON 계열의 재료 는 제한된 전기 전도성 문제로, 황화물계 재료는 일반적으 로 높은 이온 전도성을 나타내지만 수분에 민감하고 불안 정한 문제로 인해 응용이 제한된다[26-28]. 또한, 가넷 구 조의 LLZO 재료는 높은 이온전도도와 리튬 금속에 대한 안정성이 우수하지만, 공기 중의 물 또는 이산화탄소에 불 안정하여 해수에서의 사용이 제한된다[29, 30]. 따라서, 본 연구에는 상대적으로 이온전도도가 높으며 수분과 접촉하 는 환경에서도 우수한 화학적/구조적 안정성을 가지는 페 로브스카이트 구조의 LLTO 소재를 활용하였다[32-34].
- 전기투석 공정용 LLTO 리튬이온 선택적 분리막을 제작 하여 리튬을 추출하고자 할 때 고려해야 할 요소로는 면 적, 밀도, 상 정밀도가 있으며, 높은 이온전도도로 단위시 간당 많은 양의 리튬을 추출하는 시스템 제조를 위해서는 직경 20 mm 이상의 면적, 고밀도 및 고순도의 분리막 제 작이 필요하다[35-38]. LLTO 분리막 제작을 위한 합성과 소결과정에서 불순물 첨가 및 리튬의 증발로 인하여 LLTO의 결정 구조가 변할 수 있으며, 그에 따라, 이온전 도도가 낮아지는 문제가 생겨 고밀도의 우수한 상 정밀도 를 얻기 위한 최적화 공정을 진행하였다[39].
- 본 연구에서는 구조적 불안정성으로 인해 고체전해질 용도로는 주로 활용되지 않아 소재 합성 및 분리막 형태 로의 제작에 대해 연구가 활발히 진행되고 있지 않은 LLTO 소재를 활용하여 해수에서 리튬의 분리 및 추출을 위해 고밀도 고순도의 대면적 리튬이온 선택적 분리막을 제작하고자 하였다. 건식 공정을 활용하여 LLTO 소재 합 성 및 소결을 진행하였고, XRD 분석을 통해 분말의 합성 및 소결 공정을 최적화하였다. 또한, 최적 공정을 통해 제 작된 LLTO 분리막의 전기화학적 특성 평가를 통한 이온 전도도를 측정하여 해수에서의 리튬 추출 거동을 예측하 였다.
1. 서 론
- 2.1. 분리막 소재 합성 및 소결체 제조
- 본 연구에서 리튬이온 선택적 분리막 소재는 페로브스 카이트 구조의 Li3xLa(2/3-x)TiO3 화합물 중 이온전도도가 가 장 높다고 알려져 있는 Li0.33La0.56TiO3(x=0.11, LLTO)을 활용하였다[40]. LLTO 소재의 합성은 solid-state reaction 공정을 사용하였으며, 전구체로는 Li2CO3(99.0%, Sigma- Aldrich), La2O3(99.9%, Sigma-Aldrich), TiO2(99.8%, Sigma- Aldrich)을 사용하였다. 각 전구체들을 제조하고자 하는 LLTO의 화학양론에 맞춰 용기 내에 장입한 후, 혼합을 위 해 분말과 볼의 무게 비율을 1:10으로 설정하여 ZrO2 볼 을 장입하였다. 전구체 분말 및 볼이 장입되어 있는 용기 를 turbula mixer(DTB-2, DAEHWA TECH)을 사용하여 50 rpm에서 6시간 동안 혼합하였다.
- 혼합이 완료된 분말과 볼을 분리한 후, 혼합공정 간 응 집된 분말을 분쇄하였다. 분쇄를 거친 분말의 하소공정은 도가니 성분과 소재와의 반응을 방지하기 위해 백금 도가 니를 활용하여 전기 열처리로(R-1400, Hantech Co.,) 내에 서 여러 온도범위(600~1300°C)에서 대기 분위기 하에 분 당 2°C씩 승온 후 12시간 동안 유지하여 수행하였다. 하 소공정을 거친 분말 역시 공정 간 발생한 응집된 분말을 분쇄하였다. 분쇄가 완료된 분말을 펠렛 모양으로 성형하 기 위해 SKD11 몰드 내에 분말을 장입하여 일축 성형장 치를 사용, 10 MPa 압력하에서 5분간 가압하여 가성형하 였다. 가성형이 완료된 펠렛 형태의 LLTO를 진공포장하 여 냉간정수압성형장치(CIP; Loomis Wet Bag Isostatic Press, LOOMIS PRODUCTS COMPANY)을 사용하여 여 러 압력범위(300~500 MPa)에서 5분간 가압하였다.
- CIP 공정을 마친 펠렛 형태의 LLTO를 백금도가니를 활 용하여 소결공정을 수행하였다. 이때, 공정 간 리튬의 휘 발을 방지하기 위해 하소공정을 거친 분말을 사용하여 LLTO 펠렛을 감싼 후 도가니에 장입하여 여러 온도구간 (1100~1300°C)까지 분당 5°C씩 승온 후 12시간 동안 유지 하였다. 소결공정을 거친 최종 LLTO 분리막의 두께 제어 는 diamond pad를 활용한 연마공정을 통해 수행되었다.
- 2.2. 전구체 및 제조된 분리막 특성평가
- 본 연구에서 분리막 제작에 활용된 전구체 혼합 분말의 하소공정 최적화를 위해, 리튬 전구체로 사용된 Li2CO3 분말을 시차열분석-열중량 분석기(TG-DTA; STA 409 PC, Netzsch-Gerätebau GmbH)을 사용하여 0~1000°C 구간에 서 온도에 따른 중량변화 및 화학적 변화를 확인하였다. 전구체 혼합 분말의 온도에 따른 상 변화 및 리튬 첨가량 에 따른 상 정밀도를 확인하기 위해 X-선 회절 분석기 (XRD; D8 Advance, Bruker AXS)을 사용하였다. 하소 및 소결공정을 거쳐 제조된 LLTO 분리막의 밀도 분석을 위 해 아르키메데스법을 기반으로 한 밀도측정기(Density meter; ML-204T, METTLER TOLEDO)을 사용하여 측정 하였다.
- 제조된 LLTO 분리막의 전기화학적 특성평가를 위해 전 기화학 임피던스 분광법(EIS; VSP-300 Potentiostat, Bio Logic Sciences Instruments)을 활용하였다. 분리막 표면을 #2000 grid의 연마지로 연마 후 측정 면적의 활성화를 위 해 금을 증착 시켜 측정을 수행하였다. Frequency를 7MHz ~ 100 mHz 범위에서 변화시키며 임피던스 측정을 통해 얻 어진 저항값을 활용하여 아래 식 1및 2에 대입하여 소재 의 이온전도도를 측정하였다. 이때, R은 저항, ρ는 분리막 의 비저항, L은 분리막의 두께, A는 분리막의 면적이다. 식 1을 통해 얻어진 비저항 값의 역수를 취해 이온전도도 값 인 σ을 구하였다.
2. 실험 방법
- 3.1. 분리막 합성 및 소결 공정 최적화
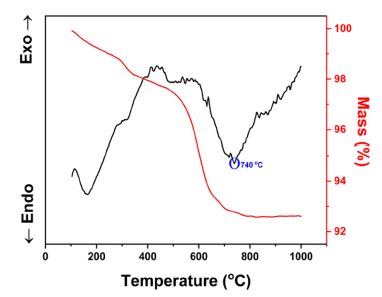
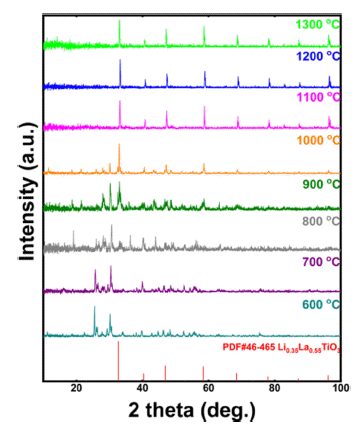
- Figure 1은 본 연구에서 사용한 리튬 전구체인 Li2CO3의 TG-DTA 분석결과이다. 분석 결과, 약 740°C 부근에서 화 학적 변화가 일어났으며, 총 6% 정도의 무게 감소가 일어 났으므로 700~800°C 사이에서 리튬 전구체에 포함된 유 기물인 탄소가 분해되었다. 이에 따라 합성하고자 하는 소 재의 불순물(최종 화합물에 참여하지 않는 모든 원소) 제 거 및 최종 상 형성여부를 확인하기 위해 전구체 혼합 분 말의 600~1300°C 온도구간에서의 상 분석 결과를 Fig. 2 에 나타내었다. 약 800°C부터 LLTO 구조를 가지는 상이 형성됨을 확인할 수 있었으며, 1100°C 이상에서는 LLTO 형태로만 나타내는 것을 확인하였다. 따라서, 상의 형성을 위해 하소온도는 1100°C 이상에서 수행하여야 하지만, 1100°C로 열처리 시 일부 분말이 응집되고, 소결되는 현 상이 발생하여, 이후 압분체 및 소결체 제작공정에서 고밀 도의 소결체를 얻기 어렵다는 문제가 존재한다. 따라서, 본 연구에서는 1000°C에서 12시간 동안 하소공정을 진행 하였을 때, 불순물 제거 및 대부분의 전구체들이 LLTO 화 합물로 합성되는 최적 온도로 판단하였으며 이후 공정에 동일하게 적용하였다.
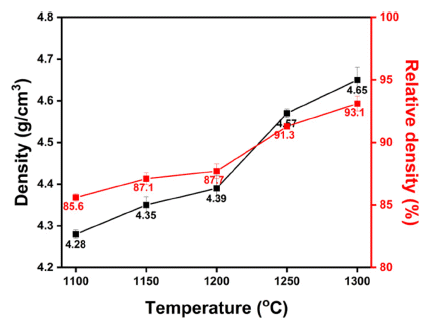
- 최적 하소 공정을 거친 분말을 활용하여 성형공정 및 소 결공정 최적화를 위해 다음 두가지 실험을 수행하였다. 첫 번째로, 소결 온도에 따른 소결체의 밀도 분석을 위해 냉 간정수압성형 공정의 조건을 300 MPa, 1분으로 고정한 후, LLTO 상을 가지는 1100°C부터 1300°C까지의 온도구 간에서 50°C 간격으로 소결온도를 다르게 하여 소결체를 제작 후 밀도분석을 수행하였으며 그 결과를 Fig. 3에 나 타내었다. 밀도 분석 결과 1300°C에서 약 93.03%의 상대 밀도를 가지는 것으로 확인되었으며(Li0.33La0.56TiO3의 이 론밀도 = 5.0 g/cm3[41]) 온도가 증가할수록 소결체의 밀도 가 증가함을 확인하였다.
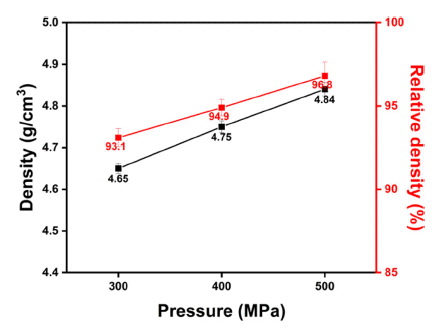
- 두번째로는 가장 높은 밀도를 가지는 소결공정인 1300 °C, 12시간 유지로 소결 온도와 시간을 고정시키고, 냉간 정수압성형 공정의 압력 범위를 300~500 MPa 구간에서 100 MPa 간격으로 변화시켜 소결체를 제작 후 밀도분석 을 수행하였으며 그 결과를 Fig. 4에 나타내었다. 성형 공 정에서 가해주는 압력이 커질수록 고밀도의 소결체가 제 작됨을 확인하였으며, Fig. 3과 Fig. 4를 통해 본 연구에서 제작하고자 하는 리튬이온 선택적 분리막 소재인 LLTO 제조 시 최적 제조공정은 하소온도 1000°C 12시간 유지, 냉간정수압성형 공정의 압력 500 MPa 및 소결온도 1300 °C 12시간 유지하였을 때 상대밀도 약 96% 이상의 고밀 도의 분리막을 제조할 수 있음을 확인하였다.
- 3.2. 제조된 분리막 특성평가
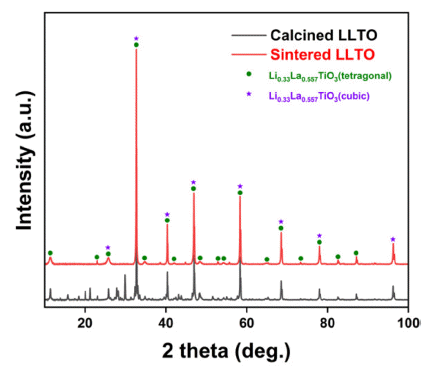
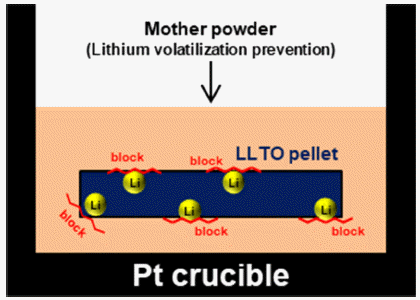
- LLTO 소재의 최적 공정을 통해 제조된 하소 후 분말 및 소결체의 상 분석 결과를 Fig. 5에 나타내었다. 하소 분말 의 경우 Fig. 2의 1000°C의 상 분석 결과와 같이 일부 전 구체가 산화물형태로 존재하는 것을 확인할 수 있지만(2 theta = 15~30°), 소결체의 경우 LLTO의 형태로만 존재하 는 것으로 확인하였다. 리튬은 끓는점이 약 1340°C으로 매우 낮으므로[42], 하소 및 소결공정에서 쉽게 휘발되는 성질을 가지고 있다. 따라서, 공정 시 Fig. 6과 같이 소결 체 주변을 하소 후 분말(mother powder)로 감싸서 리튬의 휘발을 방지한 상태로 도가니에 장입하여 소결공정을 수 행하였다.
- 휘발 방지를 위해 mother powder를 공정에 투입시켜도, 고온에서 장시간의 소결공정 수행 시 불가피한 리튬 휘발 이 발생하게 된다. 휘발되는 리튬 양을 보완하기 위해 LLTO를 합성하기 위한 여러 선행연구결과들은 초기 전구 체 혼합 시 리튬 전구체의 장입량을 약 10 wt.% 추가로 넣 어준다[43]. 본 연구에서는 리튬 전구체의 추가 장입량에 의한 소결체의 물성평가를 위해 5~15 wt.% 구간에서 5 wt.% 간격으로 리튬 추가 장입량을 변화하여 소결체를 제 작 후 상 분석을 수행하였으며 Fig. 7에 그 결과를 나타내 었다. XRD를 통한 상 분석 결과 리튬 추가 첨가량에 의 한 상 변화는 없으며, 우수한 상 정밀도를 가지는 것으로 확인되었다. 리튬 첨가량에 의한 정확한 상 분석 및 이에 따른 해수에서 리튬 추출 시 리튬 이온의 거동 예측은 중 성자 회절 분석을 통해 얻어진 결정 구조에 대한 정보를 Rietveld refinement 분석을 활용하여 수행할 수 있다[44, 45]. 중성자 회절 및 Rietveld refinement 분석을 통해 최적 리튬 첨가량 및 이에 따른 결정 구조 거동을 파악할 수 있다.
- 3.3. 제조된 분리막 전기화학적 분석 및 대면적화
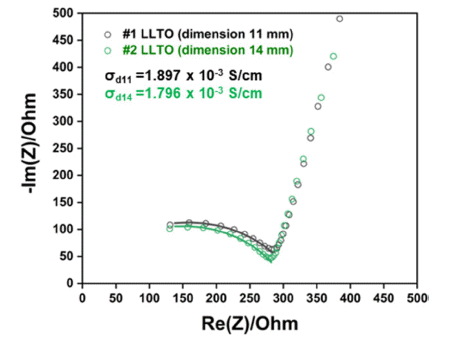
- 최적 하소 및 소결공정을 거치고, 높은 조성정밀도를 가 지는 조건으로 제작된 LLTO 소결체의 이온전도도 측정을 위해 EIS 분석을 수행하였다. 서로 다른 크기의 2가지 종 류의 소결체를 제작하여(직경 11 mm, 14 mm, 두께 1 mm) EIS 측정을 수행하였으며, 시료의 nyquist plot 분석 결과 를 Fig. 8에, 본 연구에서 제작한 LLTO 분리막의 이온전 도도 측정값 및 여러 고체전해질 소재의 이온전도도를 비 교한 값을 Table 1에 나타내었다. 직경 11 mm의 소결체의 이온전도도는 1.897 × 10-3 S/cm, 직경 14 mm 소결체의 이 온전도도는 1.796 × 10-3 S/cm으로 소결체 직경에 의한 이 온전도도 차이는 크게 나타나지 않는 것을 알 수 있다. 최 적 공정으로 제작된 LLTO 분리막의 평균 이온전도도는 1.85 × 10-3 S/cm으로 Table 1과 같이 선행 연구결과들을 통해 알려져 있는 LLTO 소재의 이온전도도와 비슷한 수 준인 것으로 측정되었다.
- 이와 같이 본 연구를 통해 도출한 최적 제조공정을 통 해 제조된 리튬이온 선택적 분리막 소재의 경우 고밀도, 우수한 상 정밀도 및 이온전도도를 가지므로 대면적화 및 두께 제어를 통해 해수에서의 리튬이온 추출 시 단위시간 당 추출되는 리튬 이온의 양을 증가시킬 수 있을 것으로 예상된다. 따라서, 기존 최적 공정에서 활용되던 단축 성 형용 SKD11 소재 몰드의 내경을 약 1.5배 증가시켜서 분 리막의 대면적화를 수행하였으며, diamond pad 연마 공정 세밀화를 통해 분리막 두께 제어 공정 최적화를 수행하였 다. 최종적으로, 직경 약 20 mm, 두께 약 200 um 수준의 리튬이온 선택적 분리막을 제작할 수 있었으며 이를 Fig. 9에 나타내었다.
3. 결과 및 고찰
Thermo Gravimetric-Differential Thermal Analysis (TG-DTA) results of Lithium carbonate (Li2CO3).
Density changes of sintered LLTO according to the pressure change during the cold isostactic pressing (CIP) process.
Electrochemical Impedance Spectroscopy (EIS) measurement results of the sintered LLTO manufactured by the optimized process.
- 차세대 모빌리티 소재의 급격한 발전으로 인한 리튬 및 리튬 원료소재의 수요는 기하급수적으로 증가하고 있으므 로 리튬 자원 확보는 경제적으로나 과학적으로나 매우 중 요한 현안이다. 본 연구에서는 육지 매장량에 약 2,000 배 에 달하는 해수 내 리튬 추출을 위한 전기투석 단위공정 용 분리막 제조 기술을 개발하였다. 전구체 합성, 하소, 성 형, 소결 공정을 거쳐 페로브스카이트 구조를 가지는 산화 물계 리튬이온 선택적 분리막인 LLTO를 제조하였다.
- 전구체 혼합 분말의 하소 공정 최적화를 위해 TG-DTA 분석을 통한 화학적 분해 온도를 확인하였으며, 온도 변화 에 따른 혼합 분말의 상 분석을 통해 약 800°C에서 LLTO 상이 형성되기 시작하며, 1100°C 이상에서는 LLTO 형태 로 존재하는 것을 확인했다. 따라서, 1000°C에서 12시간 동안 하소를 수행하는 것이 최적 조건이라고 판단된다. 이 후 열처리로 인한 분말의 응집된 부분을 분쇄를 통해 미 세하게 만들었으며, 분쇄된 분말을 활용하여 단축 프레스, 냉간정수압성형 공정을 통해 고밀도의 성형체를 얻을 수 있었다.
- 성형체 제작 시 설정하는 압력의 변화에 따라, 소결공정 설정 온도에 따른 여러 조건에서 소결체 제작 후 밀도분 석을 통해 500 MPa, 1분 동안 냉간정수압성형을 수행하 고, 1300°C에서 12시간 동안 소결공정을 수행함에 따라 최종적으로 약 96% 이상의 상대밀도를 가지는 소결체를 제작할 수 있었다. 소결공정 시 발생하는 리튬 휘발에 의 한 LLTO 구조변화를 최소화하기 위해 리튬 전구체 첨가 량에 따른 상 분석을 수행하였으며, 리튬 전구체 첨가량에 의한 상 변화는 없는 것으로 확인되며, 우수한 상 정밀도 를 가지는 것으로 확인하였다.
- 또한, 최적 공정을 적용하여 제조한 LLTO 소결체의 전 기화학적 분석 결과 기존 여러 형태의 고체전해질의 이온 전도도와 비슷하거나 높은 수준의 소결체가 제작된 것을 확인하였으며, 단위 시간당 리튬 추출 양을 늘리기 위해 분리막의 대면적화 및 두께 제어 공정 최적화를 수행하였 다. 최종적으로, 직경 약 20 mm, 두께 약 200 um 수준의 해수에서의 리튬 추출을 위한 리튬이온 선택적 분리막을 제작하였다.
4. 결 론
-
Acknowledgements
- 본 연구는 2022년도 정부(과학기술정보통신부)의 재원 으로 국가과학기술연구회 선행 융합연구사업(No. CPS 22061-100)의 지원을 받아 수행되었습니다.
Acknowledgement
- 1. W. A. Hart, O. F. Beumel and T.P . Whaley: The Chemistry of Lithium Sodium Potassium Cesium and Francium, Pergmum Press, New York (1973) 1..
- 2. P. K. Choubey, M. S. Kim, R. R. Srivastava, J. C. Lee and J. Y. Lee: Miner. Eng., 89 (2016) 119..Article
- 3. J. W. Choi and D. Aurbach: Nat. Rev. Mater., 1 (2016) 16013..Article
- 4. Y. M. Lin, K. C. Klavetter, P. R. Abel, N. C. Davy, J. L. Snider, A. Heller and C. Buddie Mullins: Chem. Commun., 48 (2012) 7268..ArticlePubMed
- 5. X. Liang, Q. Pang, I. R. Kochetkov, M. S. Sempere, H. Huang, X. Sun and L. F. Nazar: Nat. Energy, 2 (2017) 17119..Article
- 6. Y. Huang, X. Wu, L. Nie, S. Chen, Z. Sun, Y. He and W. Liu: Solid State Ion., 345 (2020) 115171..Article
- 7. K. Sasaki, R. Hiraka, H. Takahashi and K. Shin-mura: Fusion Eng. Des., 170 (2021) 112500..Article
- 8. U. S. Geological Survey: Mineral Commodity Summaries (2022), Minerals Yearbook (2010)..
- 9. P. K. Choubey, K.-S. Chung, M.-S. Kim, J.-C. Lee and R. R. Srivastava: Miner. Eng., 110 (2017) 104..Article
- 10. U. S. Geological Survey: Mineral Commodity Summaries (2017)..
- 11. K. Yoshizuka, A. Kitajou and M. Holba: Ars. Separatoria. Acta, 4 (2006) 78..
- 12. A. Siekierka, B. Tomaszewska and M. Bryjak: Desalination, 436 (2018) 8..Article
- 13. J. F. Song, L. D. Nghiem, X. M. Li and T. He: Water Res. Technol., 3 (2017) 593..Article
- 14. P. K. Choubey, K. S. Chung, M. S. Kim, J. C. Lee and R. R. Srivastava: Miner. Eng., 110 (2017) 104..Article
- 15. C. Liu, Y. Li, D. Lin, P. C. Hsu, B. Liu, G. Yan, T. Wu, Y. Cui and S. Chu: Joule, 4 (2020) 1459..Article
- 16. H. J. Hong, T. Ryu, I. S. Park, M. Kim, J. Shin, B. G. Kim and K.-S. Chung: Chem. Eng. J., 337 (2018) 455..Article
- 17. S. Yang, F. Zhang, H. Ding, P. He and H. Zhou: Joule, 2 (2018) 1648..Article
- 18. B. S. Oh, S. G. Oh, Y. J. Jung, Y. Y. Hwang, J. W. Kang and I. S. Kim: Desalin. Water Treat., 18 (2012) 245..Article
- 19. T. Hoshino: Desalination, 359 (2015) 59..Article
- 20. T. Hoshino: Desalination, 317 (2013) 11..Article
- 21. T. Hoshino: Fusion Eng. Des., 88 (2013) 2956..Article
- 22. T. Xu, M. Zhao, Z. Su, W. Duan, Y. Shi, Z. Li, V. G. Pol and X. Song: J. Power Sources, 481 (2021) 229110..Article
- 23. K. Hayamizu, S. Seki and T. Haishi: Solid State Ion., 326 (2018) 37..Article
- 24. J. E. O. Bohnkea, A. Veronb, J. L. Fourqueta, J. Y. Buzareb, P. Florianc and D. Massiotc: Solid State Ion., 109 (1992) 25..Article
- 25. W. Arnold, D. A. Buchberger, Y. Li, M. Sunkara, T. Druffel and H. Wang: J. Power Sources, 464 (2020) 228158..Article
- 26. Z. Gao, H. Sun, L. Fu, F. Ye, Y. Zhang, W. Luo and Y. Huang: Adv. Mater., 30 (2018) 1705702..ArticlePubMed
- 27. R. Chen, Q. Li, X. Yu, L. Chen and H. Li: Chem. Rev., 120 (2020) 6820..ArticlePubMed
- 28. A. Banerjee, X. Wang, C. Fang, E. A. Wu and Y. S. Meng: Chem. Rev., 120 (2020) 6878..ArticlePubMed
- 29. R. Chen, A. M. Nolan, J. Lu, J. Wang, X. Yu, Y. Mo, L. Chen, X. Huang and H. Li: Joule, 4 (2020) 812..Article
- 30. H. Chung and B. Kang: Chem. Mater., 29 (2017) 8611. .Article
- 31. W. Xia, B. Xu, H. Duan, X. Tang, Y. Guo, H. Kang, H. Li and H. Liu: J. Am. Ceram. Soc., 100 (2017) 2832..Article
- 32. Y. Inaguma, C. Liquan, M. Itoh, T. Nakamura, T. Uchida, H. Ikuta and M. Wakihara: Solid State Commun., 86 (1993) 689..Article
- 33. C. H. Chen and K. AmineK: Solid State Ion., 144 (2001) 51..Article
- 34. A. I. Ruiz, M. L. López, M. L. Veiga and C. Pico: Solid State Ion., 112 (1998) 291..Article
- 35. K. Hayamizu, S. Seki and T. Haishi: Solid State Ion., 326 (2018) 37..Article
- 36. Z. Yao, K. Zhu, J. Zhang, J. Li, X. Li, J. Wang, K. Yan and J. Liu: J. Electron. Mater., 51 (2022) 736..Article
- 37. Z. Ji, Q. Chen, J. Yuan, J. Liu, Y. Zhao and W. Feng: Sep. Purif. Technol., 172 (2017) 168..Article
- 38. Z. Li, C. Li, X. Liu, L. Cao, P. Li, R. Wei, X. Li, D. Guo, K. Huang and Z. Lai: Energy Environ. Sci., 14 (2021) 3152..Article
- 39. Y. Sun, P. Guan, Y. Liu, H. Xu, S. Li and D. Chu: Crit. Rev. Solid State Mater. Sci., 44 (2019) 265..Article
- 40. H. Kawai and J. Kuwano: J. Electrochem. Soc., 141 (1994) L78..Article
- 41. C. Cooper, A. C. Sutorik, J. Wright, E. A. Luoto III, G. Gilde and J. Wolfenstine: Adv. Eng. Mater., 16 (2014) 755..Article
- 42. National Center for Biotechnology Information: Pub- Chem Element Summary for AtomicNumber 3, Lithium (2021)..
- 43. L. Xu, L. Zhang, Y. Hu and L. Luo: Nano Energy, 92 (2022) 106758..Article
- 44. Y. Q. Cheng, Z. H. Bi, A. Huq, M. Feygenson, C. A. Bridges, M. P. Paranthaman and B. G. Sumpter: J. Mater. Chem., 2 (2014) 2418..Article
- 45. K. Ohara, Y. Kawakita, L. Temleitner, L. Pusztai, S. Kohara, A. Jono, H. Shimakura, N. Inoue and S. Takeda: Phys. Status Solidi C, 6 (2009) 1004..Article
- 46. Y. Harada, T. Ishigaki, H. Kawai and J. Kuwano: Solid State Ion., 108 (1998) 407..Article
- 47. T. Teranishi, M. Yamamoto, H. Hayashi and A. Kishimoto: Solid State Ion., 243 (2013) 18..Article
- 48. H. T. Chung, J. G. Kim and H. G. Kim: Solid State Ion., 107 (1998) 153..Article
- 49. T. Okumura, T. Ina, Y. Orikasa, H. Arai, Y. Uchimotoa and Z. Ogumi: J. Mater. Chem., 21 (2011) 10061..Article
- 50. C. Bernuy-Lopez, W. Manalastas, J. M. Lopez del Amo, A. Aguadero, F. Aguesse and J. A. Kilner: Chem. Mater., 26 (2014) 3610..Article
- 51. Y. Li, J. T. Han, C. A. Wang, H. Xie and J. B. Goodenough: J. Mater. Chem., 22 (2012) 15357..Article
- 52. C. Deviannapoorani, L. Dhivya, S. Ramakumar and R. Murugan: J. Power Sources, 240 (2013) 18..Article
- 53. C. Cao, Z. Li, X. Wang, X. Zhao and W. Han: Front. Energy Res., 2 (2014) 25..Article
- 54. W. H. Baur, J. R. Dygas, D. H. Whitmore and J. Faber: Solid State ion., 18 (1986) 935..Article
- 55. A. Hayashi, A. Sakuda and M. Tatsumisago: Front. Energy Res., 4 (2016) 25..Article
- 56. L. Zhou, A. Assoud, A. Shyamsunder, A. Huq, Q. Zhang, P. Hartmann, J. Kulisch and L. F. Nazar: Chem. Mater., 31 (2019) 7801..Article
Figure & Data
References
Citations

- A Study on Particle and Crystal Size Analysis of Lithium Lanthanum Titanate Powder Depending on Synthesis Methods (Sol-Gel & Solid-State reaction)
Jeungjai Yun, Seung-Hwan Lee, So Hyun Baek, Yongbum Kwon, Yoseb Song, Bum Sung Kim, Bin Lee, Rhokyun Kwak, Da-Woon Jeong
journal of Korean Powder Metallurgy Institute.2023; 30(4): 324. CrossRef

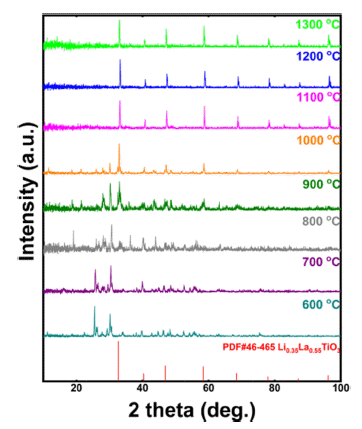


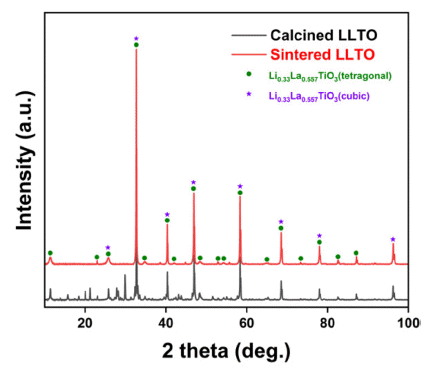
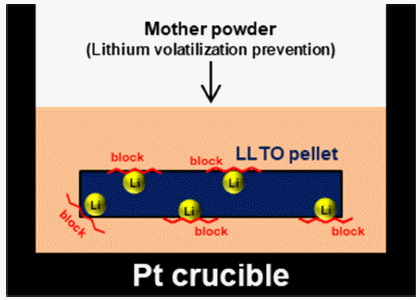
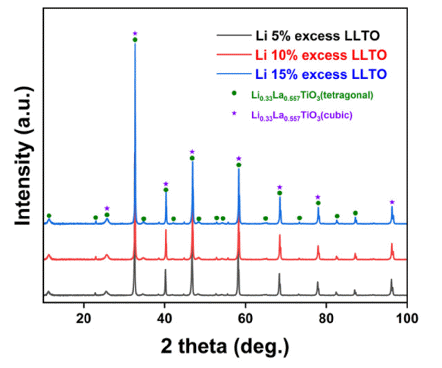
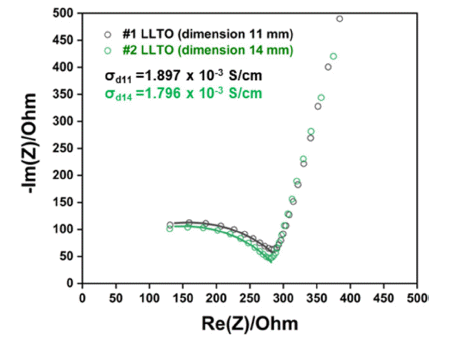

Fig. 1
Fig. 2
Fig. 3
Fig. 4
Fig. 5
Fig. 6
Fig. 7
Fig. 8
Fig. 9
Table 1
TOP
 KPMI
KPMI




 Cite this Article
Cite this Article









