Articles
- Page Path
- HOME > J Powder Mater > Volume 30(4); 2023 > Article
-
Article
난용성 리바록사반 약물의 자가 유화 시스템 분말 제조를 위한 콜로이드 실리카 함유 분말의 제조 및 평가 - 진 성 규*
- Fabrication and Evaluation of Colloidal Silica Containing Powders for Solid Self-emulsifying Drug Delivery System of Poorly Water Soluble Rivaroxaban
- Sung Giu Jin*
-
Journal of Korean Powder Metallurgy Institute 2023;30(4):305-309.
DOI: https://doi.org/10.4150/KPMI.2023.30.4.305
Published online: July 31, 2023
단국대학교 제약공학과
Department of Pharmaceutical Engineering, Dankook University, Cheonan 31116, Republic of Korea
- * Corresponding Author: Sung Giu Jin, TEL: +82-31-400-4784, FAX: +82-31-400-5958, E-mail: sklover777@dankook.ac.kr
- - 진성규: 교수
• Received: July 31, 2023 • Revised: August 13, 2023 • Accepted: August 14, 2023
© The Korean Powder Metallurgy Institute. All rights reserved.
- 768 Views
- 4 Download
Abstract
- This study aims to prepare a colloidal silica-containing powder to enhance the solubility and dissolution rate of rivaroxaban using a self-nanoemulsifying drug delivery system (SNEDDS). We investigate the impact of colloidal silica on a nanoemulsion system for preparing powdered SNEDDS. The liquid SNEDDS comprises 30/20/50 (w/w/w) Peceol/ Cremophor RH40/Tween 80, which results in the formation of the smallest droplets. Three powdered SNEDDS formulations are prepared by suspending the liquid SNEDDS formulation using colloidal silica and spray drying. The powdered SNEDDS prepared with liquid SNEDDS and colloidal silica at a ratio of 1/0.5 (w/w) exhibits the highest water solubility (0.94 ± 0.62 vs. 26.70 ± 1.81 μg/mL) and dissolution rate (38.4 ± 3.6 vs. 85.5 ± 3.4%, 45 min) when compared to the drug alone. Morphologically, the liquid SNEDDS is adsorbed onto colloidal silica and forms smaller particles. In conclusion, an SNEDDS containing rivaroxaban, prepared using colloidal silica, facilitates the creation of a nanoemulsion and enhances the water solubility of rivaroxaban. Accordingly, this technology holds significant potential for commercialization.
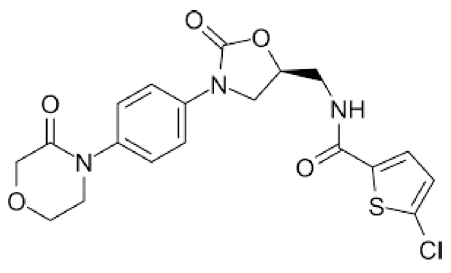
- 리바록사반(Rivaroxaban, 그림 1)은 유리 인자 Xa와 prothrombinase 활성을 직접적으로 억제하는 경구용 항응 고제이다[1]. 이 약은 음식물과 상호작용하지 않으며 정맥 혈전색전증과 폐색전증 치료에 널리 처방되는 약물이다 [2]. 리바록사반은 위장관 전반에 걸친 높은 장관막 투과 성을 지니며 pH에 독립적이며 낮은 수용해도를 나타내는 약물로 바이오의약품 분류 시스템 클래스 II 약물로 분류 된다[3]. 일반적으로 낮은 수용해도는 낮은 경구 생체이용 률을 유발하며 따라서 경구 생체이용률을 높이기 위해서 는 리바록사반의 수용해도를 개선하는 것이 중요하다[4]. SNEDDS(self-nanoemulsifying drug delivery system)는 난용성 약물의 수용해도를 개선하기 위해 사용되는 대표 적인 기술이다[5, 6]. SNEDDS는 오일, 계면활성제 및 보 조계면활성제를 포함하는 균일한 액체 혼합물이다[7]. 물 과 접촉하면 SENDDS에서 약물이 포함된 수중유형(oil in water) 나노에멀젼이 자발적으로 생성되어 수용해도가 증 가한다[8]. 경구 투여 시 SNEDDS는 위장관에서 약물이 침전되는 대신에 난용성 약물의 과포화 상태를 유지하여 용해도를 증가시킨다[9]. 그러나 SNEDDS의 단점은 액체 성분이 포함되어 있어서 저장 및 안정성 문제를 유발한다 [10]. 액상 SNEDDS의 물리적 특성을 극복하기 위해 액상 SNEDDS를 고체 캐리어에 흡착시켜 안정성과 저장성을 높인 분말화 SNEDDS가 연구되고 있다[4, 11]. 분말화 SNEDDS는 정제, 캡슐, 과립 등의 고형 의약품을 생성하 기 위해 필수적으로 준비되어야 하며 분말화 SNEDDS는 액상 SNEDDS가 지니는 용해도 개선, 용출률 개선 등의 필수적인 특성이 변화되어서는 안 된다.
- 따라서 이 연구의 목적은 난용성 약물인 리바록사반의 용해도를 증가시키기 위한 SNEDDS의 처방을 설계하고 SNEDDS를 분말화 하기 위하여 콜로이드 실리카 캐리어 를 이용하여 분무건조 방법으로 분말화 SNEDDS를 제조 하였다. 각각 제조된 분말화 SNEDDS의 수용해도, 용출 특성을 비교하였다. 또한, 최적의 리바록사반이 함유된 SNEDDS의 분말 특성을 주사 전자 현미경을 통하여 형상 을 평가하였다.
1. Introduction
- 리바록사반은 Alembic Pharmaceuticals(Gujarat, India)에 서 공급받았다. Peceol은 Gattefossé(Saint-Priest, France)에 서 공급받았으며 Cremophor RH40은 Basf(Ludwigshafen, Germany)에서 공급받았다. Tween 80은 Daejung Chemical Co.(Siheung, Korea)에서 구입하였다. 콜로이드 실리카 (Colloidal silica)는 한미약품에서 제공받았다. 모든 시약은 대한약전 규격에 적합한 순도 및 규격을 사용하였다. 기기 로는 분무건조기(Model 290, Buchi mini-spray dryer, Switzerland)와 용출기(Dissolution tester, DT 6, ERWEKA, Germany), Scanning Electron Microscope(SEM, SIGMA 500, CARL ZEISS, Germany), Mastersizer(Malvern, Worcestershire, England)을 사용하였다.
- 액상 SNEDDS 제제는 예비실험 결과를 바탕으로 Peceol 을 오일로, Cremophor RH40을 계면활성제로 Tween 80을 보조 계면활성제로 콜로이드 실리카를 고체 캐리어로 선 정하였다. 자가 나노유화 능력이 우수한 각 제제의 에멀젼 액적 크기를 평가하여 오일, 계면활성제 및 보조 계면활성 제 비율을 최적화하였다. 액적 크기가 가장 작은 형태를 지니는 액상 SNEDDS를 선택하였다. 선택된 액상 SNEDDS 제형(5 g)에 약물 4mg을 녹이고 500mL 증류수에 용해시 켜 나노 에멀젼을 형성시키기고 콜로이드 실리카를 캐리 어로 다양한 농도(Table 1)로 사용하여 앞에 제조한 용액 에 현탁시켰다. 분무 건조기를 사용하여 현탁액의 분무 건 조를 수행하였다. 공기 압축기 압력, 입구 온도, 흡입기 압 력 및 공급 유속은 각각 4 kg/cm2, 140°C, -25 mbar 및 5.4 mL/min으로 일정하게 유지하였다. 리바록사반은 Inertsil ODS-4 분석 컬럼(4.6 × 150 mm, 5 μm)을 이용하여 Agilent 1220 고성능 액체 크로마토그래피(HPLC, Santa Clara, CA, USA) 시스템에서 분석하였다. 이동상으로는 20mM 아세트산 암모늄과 아세토니트릴(65:35, v/v)이 혼합한 것 을 사용하였다. 컬럼 온도와 유속은 각각 35°C와 1mL/분 으로 유지하였다. 주입량은 20 μL로 설정하였고 검출은 250 nm의 파장에서 수행하였다[12].
- 리바록사반(0.5 mg)을 함유하는 다양한 리바록사반이 로딩된 분말화 SNEDDS를 튜브 내의 5mL 수용액에 첨 가하였다. 튜브의 뚜껑을 닫고 내용물을 볼텍스 혼합하고 25°C에서 3일 동안 온도가 조절되는 진탕 수조에 넣었다. 튜브를 10,000 g에서 10분 동안 원심분리하여 상등액을 채취하여 HPLC 이동상으로 적절하게 희석하고 위에서 언 급한 리바록사반 HPLC 분석조건으로 분석하였다[13].
- 리바록사반의 방출 거동은 37 ± 0.5°C, 75 rpm 패들로 교반되는 탈이온수에서 45분간 동안 대한약전 용출시험법 중 패들법을 사용하여 시험하였다[12, 14]. 리바록사반 분 석은 위에서 언급한 리바록사반 HPLC 분석조건에 의해 수행하였다.
- 리바록사반(0.5 mg)을 함유하는 고체 자가 유화 시스템 제형의 에멀젼 액적 크기는 Mastezier를 통해 평균 입자 직경을 Malvern 자동 측정 소프트웨어에 의한 누적 분석 으로부터 계산하였다. 주사전자현미경(SEM)을 사용하여 리바록사반이 함유된 분말화 SNEDDS, 콜로이드 실리카, 약물 단독의 표면 형태를 관찰하였다. 각 시편을 양면 테 이프를 사용하여 샘플 홀더에 놓은 다음 분말을 백금으로 스퍼터 코팅하여 15 kV에서 관찰하고 SEM으로 평가하였 다[15].
2. Experimental
Table 1
Composition of rivaroxaban-loaded solid SNEDDS powder composed of Peceol, Cremophor RH40, Tween 80 as a Liquid SNEDDS and Colloidal silica as a solid carrier
| (mg) | CS1 | CS2 | CS3 |
|---|---|---|---|
|
|
|||
| Rivaroxaban | 0.8 | 0.8 | 0.8 |
| Peceol | 300 | 300 | 300 |
| Cremophor RH40 | 200 | 200 | 200 |
| Tween 80 | 500 | 500 | 500 |
| Colloidal silica | 500 | 1000 | 1500 |
- 적절한 액상 SNEDDS 구성 요소를 선택하기 위해 예비 평가를 통하여 약물 용해도 테스트를 수행하여 약물 용해 도를 증가시킬 수 있는 오일, 계면활성제, 보조 계면활성 제를 선택하였다[16]. 오일은 생체 이용률을 향상시키기 위해 널리 사용되는 Peceol(글리세릴 모노올레이트)을 선 택하였다[12]. 선택된 오일은 218.5 ± 12.9 μg/mL의 용해 도를 나타냈으면 계면활성제와 보조 계면활성제로 선택된 Cremophor RH40(10% solution, 133.0 ± 1.3 μg/mL)과 Tween 80(10% solution, 73.7 ± 1.9 μg/mL)는 약물의 용해도(0.7 ± 0.2 μg/mL)를 크게 증가시켰다. 그리고, 분말화를 위한 캐 리어로 의약품에서 사용가능한 콜로이드 실리카를 사용하 였다[17].
- 액상 SNEDDS 제제는 Peceol, Cremophor RH40 및 Tween 80을 다양한 비율로 혼합하여 준비하였다. Peceol (오일) 10~60%, Cremophor RH40(계면활성제) 40~90%, Tween 80(보조 계면활성제) 35~55%를 배합한 경우 수용 액에서 액적 침전이나 상분리 현상이 관찰되지 않고 투명 한 상태를 나타냈다. 액적 크기에 대한 오일/계면활성제 비율의 영향을 평가하였다(그림 2A). Peceol/Cremophor RH40 비율이 60/40에서 10/90으로 감소함에 따라 에멀젼 액적 크기가 감소하였다. Peceol/Cremophor RH40 비율이 30/70에서 가장 작았으며 편차가 적은 액적 크기를 형성 시켰다. 따라서 SNEDDS 내의 Peceol 비율은 30%로 설정 하였다. 오일 비율을 30%로 고정한 후 액적 크기를 기준 으로 Cremophor RH40/Tween 80 비율을 결정하였다(그림 2B). Cremophor RH40과 Tween 80 비율을 변경시켜서 액 적 크기를 평가하였을 때 30/20/50(%, w/w/w) Peceol/ Cremophor RH40/Tween 80를 포함하는 액상 SNEDDS 제 제가 액적 크기가 가장 작기 때문에 선택하였다(237.9 ± 26.9 nm). 액상 SNEDDS 조성을 결정한 후, 리바록사반 0.8 mg을 액상 SNEDDS 1 g에 넣어 리바록사반이 함유된 액상 S N EDDS를 제조하였다. 약물을 함유한 액상 SNEDDS의 액적 크기(271.2 ± 16.3 nm)는 약물이 없는 액 상 SNEDDS의 액적 크기보다 높았다. 그러나 유의한 차 이를 나타내지 않았다(p > 0.05).
- 분말화 리바록사반 함유 SNEDDS의 적절한 캐리어의 양을 결정하기 위하여 약물이 함유된 액상 SNEDDS을 증 류수에 유화시킨 분산액을 콜로이드 실리카 분말화 캐리 어를 사용하여 Table 1의 3가지 처방에 따라 콜로이달 실 리카를 0.5 – 1.5 g으로 현탁하고 분무 건조하여 3개의 분 말화 SNEDDS를 제조하였다. 액상 SNEDDS는 끈적끈적 한 성질을 가진 오일과 액상 계면활성제로 주로 구성된다. 액상 SNEDDS를 분말화하기 위해서는 비표면적이 큰 고 체 다공성 캐리어가 필요로 한다. 콜로이달 실리카(약 200 m2/g)는 높은 비표면적을 가지며 의약용도로 사용이 가능 하기 때문에 액상 SNEDDS를 분말화시키기 위해 선택하 였다[12]. 분말화 리바록사반 함유 SNEDDS의 적절한 캐 리어의 양을 결정하기 위해 제조된 분말화 SNEDDS의 약 물 수용해도 평가를 수행하였다(그림 3). 콜로이드 실리카 양이 제제 CS1에서 CS2 및 CS3으로 증가함에 따라 약물 의 수용해도가 감소하였다. CS1에서 가장 높은 약물 용해 도가 나타났으며 약물 용해도는 약물 단독 대비(0.94 ± 0.62 vs. 26.70 ± 1.81 μg/mL) 매우 크게 증가하였다. CS1 의 액상 SNEDDS 과 콜로이드 실리카의 1/0.5(w/w) 비율 미만에서는 분말로 제조되지 않고 끈적한 반고형상이 제 조되었다. 콜로이드 실리카의 양이 더 증가하였을 경우 최 종 제형의 양이 증가함에 따라 환자의 복용 편의성이 감 소할 수 있으며 콜로이드 실리카의 양이 감소할수록 약물 의 수용해도가 증가한 결과가 나타났다.
- 분말화 SNEDDS에서 약물 방출은 그림 4에 나타내었다. 제조된 모든 분말화 SNEDDS의 용출률(%)은 모든 시점 에서 순수한 리바록사반 약물 분말보다 유의하게 높았다 (p < 0.05). 모든 샘플링 시간에서 수용해도 추세와 동일하 게 콜로이드 실리카 양이 제제 CS1에서 CS2 및 CS3으로 증가함에 따라 약물의 용출율이 감소하였다. 다공성을 지 니는 콜로이드 실리카의 사용량이 많아짐에 따라서 SNEDDS로 생성된 미세 액적이 생성되는 시간이 길어짐 에 따라서 용출속도가 낮아질 수 있다. 최종적으로 테스트 된 조성 중에서, CS1 30/20/50/50(%, w/w/w/w) Peceol/ Cremophor RH40/Tween 80/colloid silica 조성이 가장 높 은 용해도(26.70 ± 1.81 μg/mL)를 제공하였으며 방출 시험 에서도 다른 조성에 비해 향상된 방출(85.5 ± 3.4%, 45분) 을 나타냄을 확인하였다.
- 형태학적 특성은 SEM을 이용하여 평가하였다(그림 5). 리바록사반 약물 분말은 직사각형의 암석과 같은 결정 형 태를 나타냈다(그림 5A). 콜로이달 실리카는 전형적인 미 세기공 형상이 관찰되었다(그림 5B). 최적화된 분말화 SNEDDS(CS1)는 콜로이드 실리카에 흡착되었고 거친 다 공성 표면은 SNEDDS로 덮게 되어서 매끄럽게 되었으며 더 작은 입자가 형성되었다(그림 5C)[18]. 이는 액상 SNEDDS가 콜로이드 실리카 캐리어에 흡착됨을 나타낸다. 따라서, 액상 SNEDDS는 콜로이드 실리카에 흡착되어 순 수 약물 분말에 비해 더 높은 수용해도와 약물 방출속도 와 증가된 최종 용출률을 나타내어 난용성 약물인 리바록 사반의 낮은 수용해도를 높일 수 있으며 고체 형태로 높 은 안정성과 상업적 이용이 가능할 수 있음을 알 수 있었 다[19, 20].
3. Results and Discussion
Fig. 2
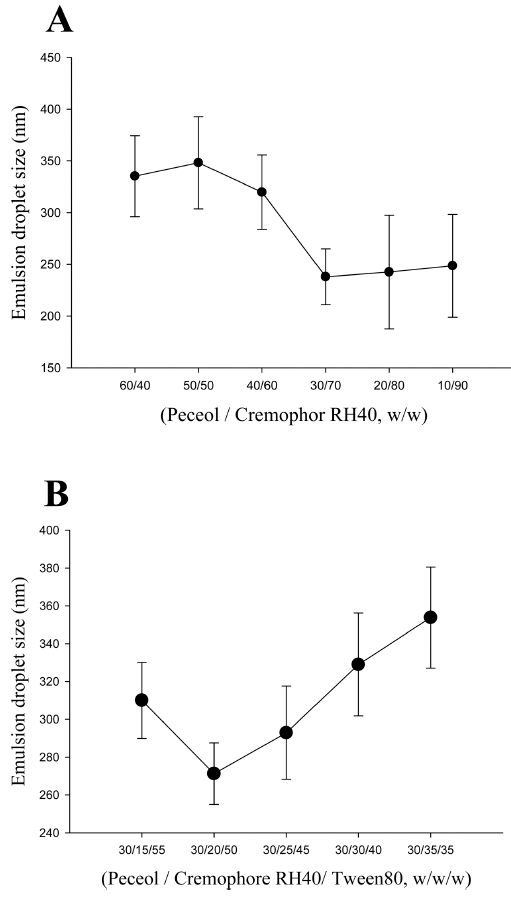
Effect of emulsion droplet size according to composition of liquid self-nanoemulsifying drug delivery system (SNEDDS): (A), Effects of the ratio of surfactant to oil; (B), Effects of the ratio of co-surfactant to surfactant. Each value represents the mean ± S.D. (n = 3).

Fig. 3
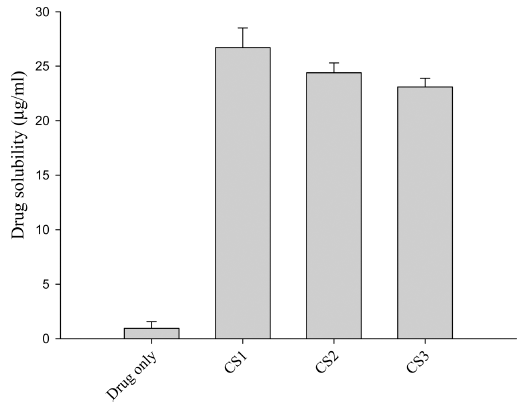
Aqueous solubility of solid self-nanoemulsifying drug delivery system (SNEDDS) formulations as a function of colloidal silica ratio. Each value shows the mean ± S.D. ( n = 3).

Fig. 4

Dissolution profiles of solid self-nanoemulsifying drug delivery system (SNEDDS) formulations as a function of colloidal silica ratio. Each value shows the mean ± S.D. ( n = 3).

- Peceol과 Cremophor RH40 및 Tween 80으로 구성된 리 바록사반이 함유된 SNEDDS는 최적 조성에서 가장 작은 액적 크기를 지녀 약물의 용해도를 현저하게 증가시킬 수 있었다. 분말화된 SNEDDS는 콜로이드 실리카의 최적 비 율에서 약물 단독에 비해 약물의 용해도와 용출률을 현저 하게 개선하였다. 특히, 콜로이드 실리카는 비율이 감소할 수록 약물의 용해도가 더 향상되었다. 연구된 리바록사반 이 함유된 분말화 SNEDDS는 난용성 약물인 리바록사반 의 용해도 향상을 위한 상업용 의약품으로 가능성을 보여 준다.
4. Conclusion
- 1. J. Ansell, S. Bakhru, B. E. Laulicht, G. Tracey, S. Villano and D. Freedman: Eur. Heart J., 43 (2022) 985. .ArticlePubMedPMC
- 2. M. B. Glassberg and P. F. Lachiewicz: J. Arthroplasty, 34 (2019) 1793. .ArticlePubMed
- 3. M. J. Choi, M. R. Woo, H. G. Choi and S. G. Jin: Int. J. Mol. Sci., 23 (2022) 9491. .ArticlePubMedPMC
- 4. J. S. Kim, F. Din, Y. J. Choi, M. R. Woo, S. Cheon, S. H. Ji, S. Park, J. O. Kim, Y. S. Youn, S. J. Lim, S. G. Jin and H. G. Choi: Int. J. Pharm., 628 (2022) 122286. .ArticlePubMed
- 5. E. J. Park, S. A. Choi, K. A. Min, J. P. Jee, S. G. Jin and K. H. Cho: Pharmaceutics, 14 (2022) 1694. .ArticlePubMedPMC
- 6. J. E. Choi, J. S. Kim, M. J. Choi, K. Baek, M. R. Woo, J. O. Kim, H. G., Choi and S. G. Jin: Int. J. Pharm., 597 (2021) 120377. .ArticlePubMed
- 7. J. S. Kim, F. U. Din, S. M. Lee, D. S. Kim, M. R. Woo, S. Cheon, S. H. Ji, J. O. Kim, Y. S. Youn, K. T. Oh, S. J. Lim, S. G. Jin, Choi, H. G Choi: Int. J. Nanomed., 11 (2021) 5797. .ArticlePubMedPMC
- 8. D. S. Kim, J. S. Kim, S. J. Lim, J. O. Kim, C. S. Yong, H. G. Choi and S. G. Jin: Pharmaceutics, 11 (2019) 415. .ArticlePubMedPMC
- 9. J. S. Kim, Y. J. Choi, M. R. Woo, S. Cheon, S. H. Ji, D. Im, F. U. Din, J. O. Kim, Y. S. Youn, K. T. Oh, S. J., Lim, S. G. Jin and H. G. Choi: Carbohydr. Polym., 271 (2021) 118433. .ArticlePubMed
- 10. K. S. Kim, E. S. Yang, D. S. Kim, D. W. Kim, H. H. Yoo, C. S. Yong, J. O., Kim, S. G. Jin and H. G. Choi: Drug Deliv., 24 (2017) 1018. .ArticlePubMedPMC
- 11. D. S. Kim, E. S. Yang, C. S. Yong, Y. S. Youn, K. T. Oh, D. X. Li, J. O. Kim, S. G. J in and H. G. Choi: Colloids Surf. B, 160 (2017) 331. .ArticlePubMed
- 12. M. J. Choi, J. S. Kim, H. Yu, M. R. Woo, J. E. Choi, K. Baek, J. O. Kim, Y. S. Choi, H. G. Choi and S. G. Jin: J. Mol. Liq., 346 (2022) 117057. .Article
- 13. W. Kim, J. S. Kim, H. G. Choi, S. G. Jin and C. W. Cho: J. Drug Delivery Sci. Technol., 66 (2021) 102877. .Article
- 14. J. E. Choi, J. S. Kim, J. Kim, M. J. Choi, K. Baek, J. O. Kim, H. G. Choi and S. G. Jin: J. Drug Delivery Sci. Technol., 76 (2022) 103803. .Article
- 15. H. Yu, J. S. Kim, D. W. Kim, E. S. Park, Y. S. Youn, F. Din, J. O. Kim, Y. S. Youn, K. T. Oh, S. J. Lim, S. G. Jin and H. G. Choi: Composites, Part B, 225 (2021) 109276. .Article
- 16. S. A. Choi, E. J. Park, J. H. Lee, K. A. Min, S. T. Kim, D. J. Jang, H. J. Maeng, S. G. Jin and K. H. Cho: Pharmaceutics, 14 (2022) 1875. .ArticlePubMedPMC
- 17. D. S. Kim, J. S. Choi, D. W. Kim, K. S. Kim, Y. G. Seo, K. H. Cho, J. O. Kim, C. S. Yong, Y. S. Youn, S. J. Lim, S. G. Jin and H. G. Choi: Int. J. Pharm., 511 (2016), 351. .ArticlePubMed
- 18. F. P. Schmied, A. Bernhardt, V. Baudron, B. Beine and S. Klein: AAPS PharmSciTech., 23 (2022) 213. .ArticlePubMed
- 19. K. S. Kim, S. G. Jin, O. Mustapha, A. M. Yousaf, D. W. Kim, Y. H. Kim, J. O. Kim, C. S. Yong, J. S. Woo and H. G. Choi: Int. J. Pharm., 490 (2015) 273. .ArticlePubMed
- 20. A. M. Yousaf, O. Mustapha, D. W. Kim, D. S. Kim, K. S. Kim, S. G. Jin, C. S. Yong, Y. S. Youn, Y. K. Oh, J. O. Kim and H. G. Choi: Int. J. Nanomed., 11 (2016) 213..
Figure & Data
References
Citations
Citations to this article as recorded by 

Fabrication and Evaluation of Colloidal Silica Containing Powders for Solid Self-emulsifying Drug Delivery System of Poorly Water Soluble Rivaroxaban

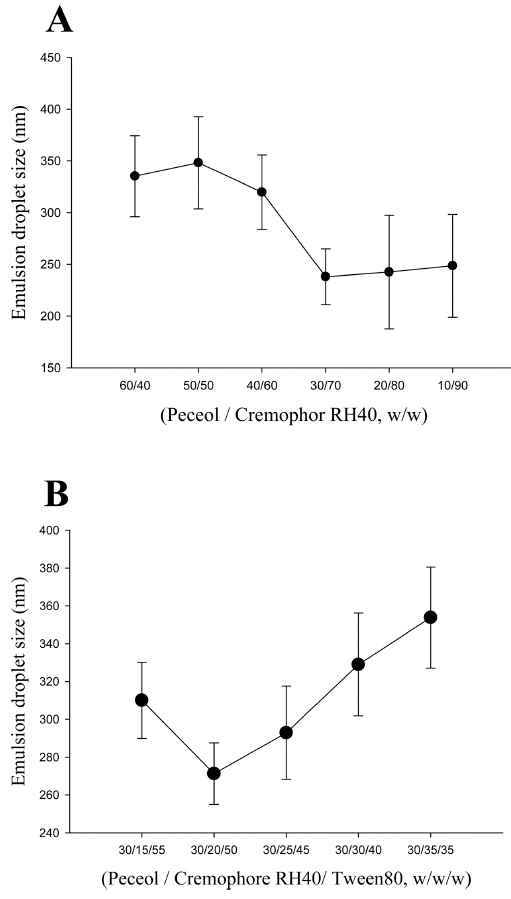
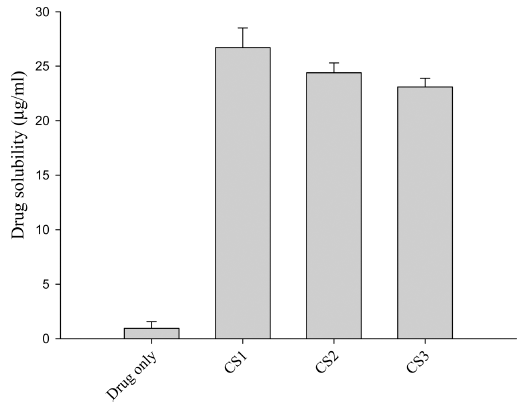


Fig. 1
Structure of rivaroxaban.
Fig. 2
Effect of emulsion droplet size according to composition of liquid self-nanoemulsifying drug delivery system (SNEDDS): (A), Effects of the ratio of surfactant to oil; (B), Effects of the ratio of co-surfactant to surfactant. Each value represents the mean ± S.D. (n = 3).
Fig. 3
Aqueous solubility of solid self-nanoemulsifying drug delivery system (SNEDDS) formulations as a function of colloidal silica ratio. Each value shows the mean ± S.D. ( n = 3).
Fig. 4
Dissolution profiles of solid self-nanoemulsifying drug delivery system (SNEDDS) formulations as a function of colloidal silica ratio. Each value shows the mean ± S.D. ( n = 3).
Fig. 5
Scanning electron micrographs; (A), rivaroxaban; (B), colloidal silica; (C), rivaraoxaban-loaded solid selfnanoemulsifying drug delivery system (SNEDDS).
Fig. 1
Fig. 2
Fig. 3
Fig. 4
Fig. 5
Fabrication and Evaluation of Colloidal Silica Containing Powders for Solid Self-emulsifying Drug Delivery System of Poorly Water Soluble Rivaroxaban
| (mg) | CS1 | CS2 | CS3 |
|---|---|---|---|
|
|
|||
| Rivaroxaban | 0.8 | 0.8 | 0.8 |
| Peceol | 300 | 300 | 300 |
| Cremophor RH40 | 200 | 200 | 200 |
| Tween 80 | 500 | 500 | 500 |
| Colloidal silica | 500 | 1000 | 1500 |
Table 1
Composition of rivaroxaban-loaded solid SNEDDS powder composed of Peceol, Cremophor RH40, Tween 80 as a Liquid SNEDDS and Colloidal silica as a solid carrier
Table 1
TOP
 KPMI
KPMI


 Cite this Article
Cite this Article





