Articles
- Page Path
- HOME > J Korean Powder Metall Inst > Volume 21(6); 2014 > Article
-
ARTICLE
리튬이차전지 전극소재 연구동향 - 이재원, 김우병a,*
- Research Trend of Electrode Materials for Lithium Rechargeable Batteries
- Jae-won Lee, Woo-Byoung Kima,*
-
Journal of Korean Powder Metallurgy Institute 2014;21(6):473-479.
DOI: https://doi.org/10.4150/KPMI.2014.21.6.473
Published online: November 30, 2014
단국대학교 에너지공학과
Department of Energy Engineering, Cheonan, Chungnam 330-714, Korea
- *Corresponding Author : Woo-Byoung Kim, TEL: +82-41-550-3681, FAX: +82-41-559-7914, E-mail: woo7838@dankook.ac.kr
© Korean Powder Metallurgy Institute
This is an Open-Access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/3.0) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
- 3,524 Views
- 64 Download
- 7 Crossref
- 이차전지 (secondary battery)는 한번 사용하고 버리는 건전지와 같은 일차전지와는 달리 충전이 가능한 전지를 의미한다. 납축전지, 니켈카드뮴전지, 니켈수소전지 등 다 양한 전지들이 이차전지의 범주에 포함되는데 일반적으로 전극에 어떤 소재를 사용하는가에 따라 전지의 명칭이 결 정된다. 즉, 납축 전지는 음극에 납을 사용하며 충방전 과 정 중 납이 산화환원반응을 일으킨다. 니켈카드뮴전지는 음극에 카드뮴을 사용하며, 니켈수소전지는 음극에 니켈 수소합금을 사용한다. 그림 1에 다양한 전지의 종류 및 전 지 별 용도를 정리하여 나타내었다.
- 가장 진보된 형태의 이차전지 중 하나인 리튬 이차전지 는 음극에서 리튬 이온이 산화환원반응에 참여하는 전지 를 일컫는데 리튬은 밀도가 0.53 g/cm3인 지구상에 존재 하는 가장 가벼운 알칼리 금속이면서 가장 낮은 표준산화 환원전위(standard redox potential)을 갖고 있는 원소이다. 이 러한 고유의 특성 때문에 리튬을 전지의 음극(anode)으로 이용하고자 하는 많은 연구가 진행되어 왔다. 그러나 리튬 은 수분이나 공기와 강한 반응(산화반응)을 일으킬 수 있 으며, 리튬 금속을 이차전지의 음극으로 사용할 경우 수지 상(dendrite)의 생성으로 인한 전극간의 단락현상과 같은 안전상의 문제점 때문에 리튬 금속 자체를 음극으로 적용 한 이차전지는 상용화에 많은 어려움을 안고 있다. 따라서 지금까지도 리튬 금속을 직접 적용한 전지는 일차전지에 국한되어 있으며 이차전지는 1980년대 상용화되었다가 발 화 등의 안전사고로 인하여 생산이 중단된 상태에 머물고 있다.
- 1990년대 초반에 소니(SONY)가 리튬 금속이 아닌 흑연 을 음극으로 사용한 리튬 이온전지의 상업화에 성공하면 서 최근 휴대폰이나 노트북 등 대부분의 정보전자 기기의 전원에 리튬 이온전지가 적용되고 있다. 리튬 이온전지는 충방전이 가능한 이차전지의 일종으로 리튬 이온의 탈삽 입에 따른 양×음극에서의 산화환원반응에 의해, 축적된 화학에너지를 전기에너지로 변환하는 전기화학적 장치이 다. 리튬 이차전지를 구성하는 주 요소는 양극, 음극, 전해 질 및 분리막이다. 양극과 음극에서는 앞서 언급한 바와 같이 산화환원반응이 일어나는 장소를 제공하고 전해질은 양극과 음극 사이에서 리튬 이온의 전달을 담당하는 요소 이며 분리막은 양극과 음극이 맞붙지 않도록 전기적으로 절연을 시켜 주는 역할을 담당한다.
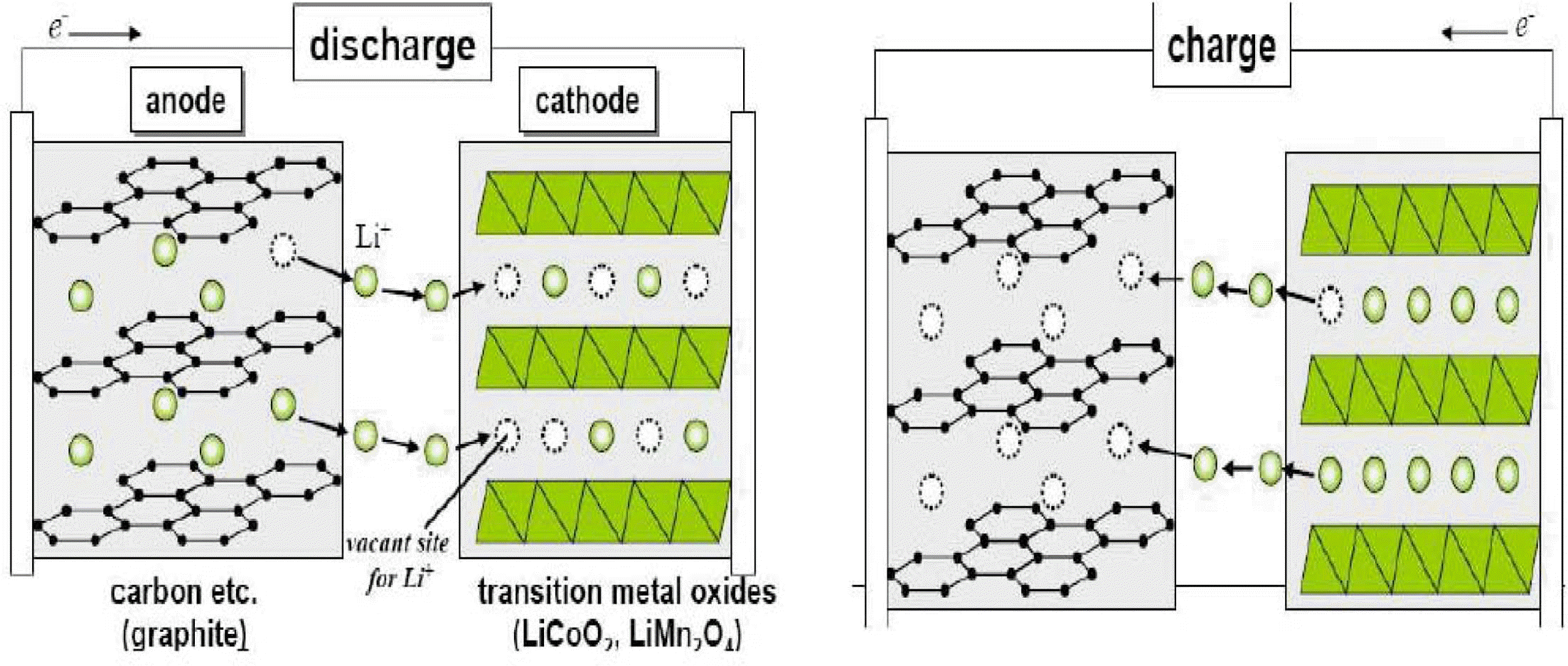
- 그림 2에 리튬 이온전지의 개략도를 나타내었다. 리튬 이온전지의 작동원리는 방전 시, 음극에서 리튬이 리튬 이 온으로 산화된 후 전해질을 통해 양극으로 이동하고 발생 된 전자는 외부도선을 통해 양극으로 이동한다. 양극에서 는 음극으로부터 이동해 온 리튬 이온이 삽입되면서 전자 를 받아들여 환원반응을 일으킨다. 충전 시에는 반대로 양 극에서 산화반응이 일어나고 음극에서 환원반응이 발생한 다. 이와 같이 양극재나 음극재의 결정구조 내로 리튬 이 온이 삽입되는 현상을 인터칼레이션 (intercalation)이라고 부른다. 양극으로 LiCoO2와 같은 LiMO2계 (M=전이금속) 산화물을 사용하고 음극으로 흑연을 사용할 경우, 위의 반 응을 다음과 같이 표시할 수 있다.
- 양극에서의 반응: LiMO2 ← Li1-xMO2+xLi++xe−
- 음극에서의 반응: C6+xLi++xe− ← LixC6
- 전체반응: LiMO2+C6 ← Li1-xMO2+LixC6
- 리튬 이온전지의 전극에서의 산화환원 반응은 다양한 메커니즘에 의해 일어나는데 이를 크게 나누면 다음과 같 다[2].
- 삽입반응은 대표적인 리튬 이온전지의 전극에서 발생하 는 반응 메커니즘으로서 리튬전이금속산화물계 양극재와 흑연을 비롯하여 대다수의 리튬 이온전지용 전극소재의 충방전 과정에 수반되는 반응이 이에 해당한다. LiCoO2와 같은 양극재나 흑연 등 층상구조를 갖고 있는 전극소재의 층간에 리튬 이온이 삽입되는 인터칼레이션 반응은 삽입 반응의 일례이다. 생성반응은 실리콘을 비롯한 합금계 음 극소재가 보이는 반응으로서 리튬과 실리콘이 반응하여 리튬-실리콘 합금과 같은 제 3의 물질을 형성하는 반응이 이에 해당한다. 마지막으로 치환반응은 금속산화물 계열 의 음극재들과 관련이 있는 반응 메커니즘이다. 최근 Co3O4,CuO등 전이금속 산화물의 나노입자를 음극재로 사 용하고자 하는 개발이 활발히 진행되고 있는데 이들 나노 입자의 경우 리튬과 반응하여 Li2O를 생성하고 Co나 Cu 등 금속으로 환원되는 반응을 보이는데 이러한 전환반응 이 치환반응의 범주에 해당한다.
- 리튬 이온은 전해액을 매질로 하여 전극간에 이동하면 서 방전시에 양극으로 삽입되고 충전시에는 음극으로 삽 입되는 반응을 보인다. 이러한 전극간의 리튬 이온의 이동 을 ‘rocking-chair’ 또는 ‘스윙효과’라고도 부른다. 전지의 전압은 양극과 음극에 존재하는 리튬 이온의 깁스 자유에 너지(Gibbs free energy)의 차이로부터 결정되는데 평형상 태에서 전극 전위가 전극 내에 존재하는 리튬 이온 농도 의 함수이며 깁스 자유에너지의 차이는 방전 시 감소하는 모습을 보인다.
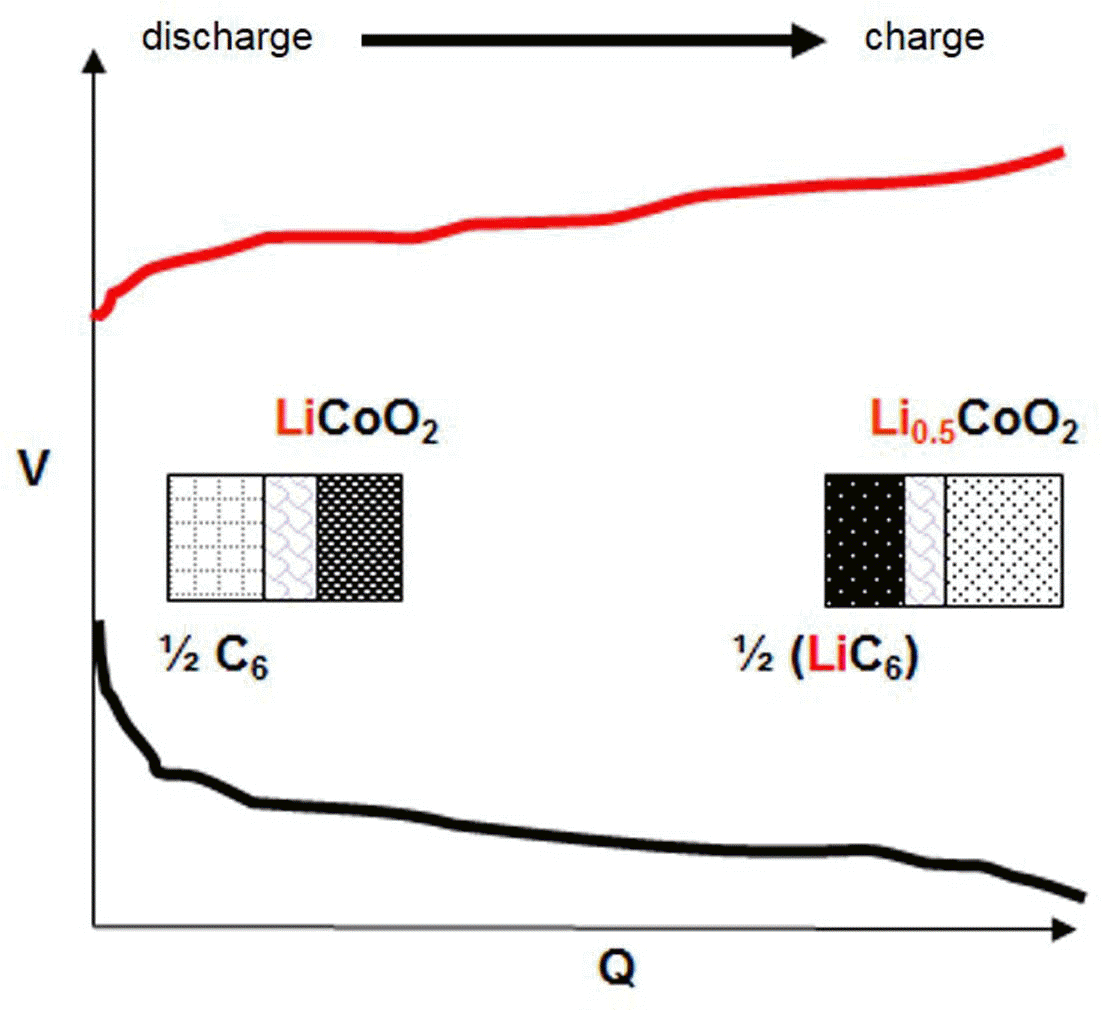
- 전형적인 상용 리튬 이온전지는 2.5~4.3 V의 작동전압 을 나타내는데 방전 말기에는 음극 내에 리튬이 소진되면 서 전지의 전압이 2.5~3.0 V 부근으로 떨어지게 된다. 그림 3에서 보는 바와 같이 충전과정에서 양극의 전위는 지속적으로 증가하고 음극의 전위는 감소하여 양극과 음 극사이의 전위차가 벌어지는 방향으로 진행되는데 이 때, 전지의 전압은 양극과 음극의 전위차로 정의될 수 있다. 반대로 방전과정 중에는 충전과정에서 벌어진 전압차이가 다시 줄어드는 과정을 겪게 된다. 충전상태에서 전지의 전 압을 E라고 할 때, 이차전지로부터 얻을 수 있는 최대 에 너지는 다음의 식으로 주어진다.
- ΔG = –nFE(J)
- 여기서, n은 한 개의 리튬 이온과 산화환원반응에 참여하 는 전자의 개수를 나타내므로 n=1이고 F는 Faraday 상수 (1F=96780 J/equiv.) 를 나타낸다. 또한, E는 전지의 작동 전압을 나타내는데 양극과 음극의 전위차이로 주어진다.
- 리튬 이온전지는 타 전지에 비해 충방전 과정에서 방전 용량이 이전의 낮은 깊이에서의 방전용량을 기억하여 더 이상의 용량을 구현하지 못하는 이른바 ‘메모리 효과’가 거의 없으므로 충방전의 깊이에 관계없이 일정한 수준의 용량을 구현할 수 있다. 이러한 리튬 이온전지의 장점들은 기존의 이차전지를 단기간에 대체하여 현재 대부분의 모 바일 기기의 전원으로 사용되고 하이브리드 자동차용 전 원에도 적용되는 등 시장을 빠르게 확대해 나가는 원동력 을 제공하였으나 아직까지 충방전 과정에서 발생하는 발 열, 발화 등의 문제점은 극복해야 할 부분으로 남아있다.
서 론
- 리튬 이온전지는 크게 양극과 음극 그리고 전해질과 분 리막으로 구성되어 있으며 이를 둘러싸고 있는 외장재와 전극단자가 포함되어 있다. 리튬 이온전지는 리튬 이온이 양극과 음극간을 전해질을 통해 이동하면서 전극에서 산 화환원반응에 참여하는 과정을 통해 화학적 에너지를 전 기적인 에너지로 변환하는 장치이다. 따라서 양극과 음극 은 에너지 변환과정에서 가장 중요한 산화환원반응이 일 어나는 장소를 제공하고 전해질은 리튬 이온의 이동이 원 활하도록 통로를 제공해 주는 역할을 한다. 또한 분리막은 양극과 음극이 직접 맞닿지 않도록 절연성을 제공한다. 조 금 더 세밀하게 살펴보면, 양극은 양극재와 도전재, 바인 더 및 집전체로 이루어져 있다. 양극재는 주로 리튬전이금 속산화물 계열이 주를 이루고 있고 인산염계 혹은 규산염 계 등 일부 다른 종류의 화합물도 사용되고 있다. 도전재 는 카본블랙과 같은 전도성이 높은 비정질 카본 입자들이 주로 사용되는데 양극재 입자간의 전자 전도성을 높임으 로서 전극반응의 속도를 향상시키기 위해 사용된다. 집전 체는 충방전 중에 발생한 전자의 흐름을 모아서 외부 도 선과 연결시켜 주는 역할을 하는데 양극용으로는 주로 알루 미늄박이 사용된다. 바인더는 양극재 입자간의 결착력 및 양 극재 입자와 집전체 사이의 결착력을 확보하기 위한 목적으 로 사용되며 PVDF등 고분자 소재가 주로 사용된다.
- 음극은 양극과 마찬가지로 카본블랙계열의 도전재와 고 분자 바인더가 포함되어 있고 음극용 집전체로는 구리가 주로 사용된다. 그 이유는 알루미늄의 경우 음극의 작동전 위에서 리튬과 반응하여 합금을 생성하기 때문이다. 반면, 구리의 경우 음극의 작동전위에서 산화환원반응에 참여하 지 않으므로 안정하게 사용할 수 있다. 음극재는 양극과 더불어 에너지를 저장하는 핵심소재이며 흑연을 비롯한 탄소계 소재들이 주로 이용되고 있다. 최근에는 soft carbon이나 hard carbon등 신규 소재들이 전기자동차용 리 튬 이온전지 등에 일부 적용되고 있다.
- 전해질은 카보네이트 계열의 유기용매에 리튬염을 녹인 형태로 되어 있으며 리튬 이온의 이동경로를 제공한다. 분 리막은 폴리에틸렌을 비롯한 폴리올레핀계 다공성 막으로 구성되어 있으며 전기적 단락을 방지하는 역할을 한다. 아 래 부분에서는 전해질과 분리막을 제외한 전극소재에 대 한 보다 상세한 설명을 하기로 한다.
- 2.1. 양극재
- 양극재는 전술한 바와 같이 주로 리튬 전이금속 산화물 계 화합물이 주를 이루고 있다. 현재 사용되고 있는 양극 재들은 대부분 리튬과 전이금속을 포함하고 있고 전기적 중성을 맞추기 위하여 음이온을 함유하고 있는 물질들이 다. 즉, LiaMbXc(M: 전이금속, X: 음이온)의 형태를 갖고 있는데 충전 중에는 전이금속이 산화반응을 일으키면서 전위가 올라가고 방전 중에는 환원반응을 일으키면서 전 위가 내려가는 현상을 보인다. 음이온은 O2−, PO43−, SO42−, SiO44− 등 다양한 형태가 구성에 참여할 수 있으며 종류에 따라 많은 특성차이를 보인다.
- 양극의 성능을 규정짓는 주요 특성으로는 용량, 율특성, 수명특성 등이 있는데 용량은 중량당, 혹은 부피당 갖고 있는 전하량을 의미한다. 단위로는 mAh/g 혹은 mAh/cc 등을 주로 이용한다. 출력특성은 높은 전류로 충전 혹은 방전할 때 열 에너지 등을 통해 외부로 잃어버리는 에너 지를 최소화하면서 본래 소재가 갖고 있는 에너지를 충분 히 발현할 수 있는가를 나타내는 특성이다. 수명특성은 충 방전 횟수를 거듭할 때 소재의 용량이 퇴화되는 정도를 나타낸다. 아울러, 양극재는 소재별로 고유의 작동전위가 존재하는데 현재 사용되고 있는 양극재들은 주로 3V이상 이며 4V 부근의 작동전위를 보이는 소재가 많다. 최근에 는 5V급 양극재에 대한 연구개발이 진행되고 있는데 그 이유는 양극재가 갖고 있는 에너지는 동일한 용량의 경우 작동전위에 비례해서 증가하기 때문이다.
- E = V Q = V I t (E: 에너지밀도, V: 작동전압, Q: 용량, I: 전류, t: 시간)
- 양극재가 가져야 하는 주요 요구특성은 다음과 같다[4].
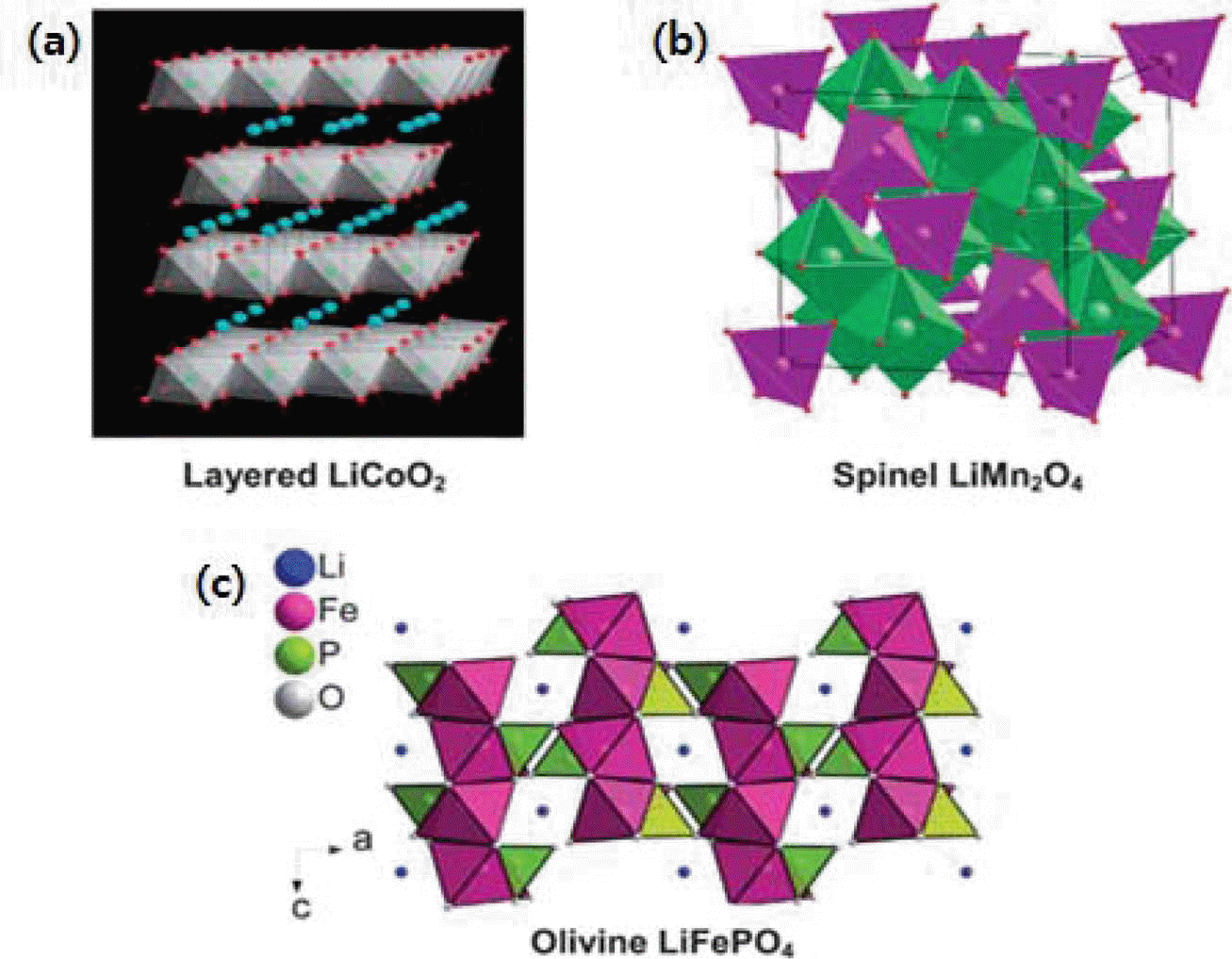
- 현재 주로 사용되고 있는 양극재는 결정구조에 따라, 층 상계, 스피넬계, 올리빈계 등으로 구분될 수 있다. 층상계 소재는 LiCoO2와 Li[NixMnyCoz]O2(NMC계, 3원계) 소재 들이 대표적인 물질들이다. 층상계 소재는 현재 가장 널리 사용되고 있는 양극재이며 기본 구조는 그림 4(a)과 같다. 리튬 이온의 이동이 x, y축을 중심으로 2차원적으로 일어 나며 이론용량은 약 270~280 mAh/g 수준의 값을 갖고 있 다. 그러나, 실제로는 이론용량의 값에 근접하는 고용량을 얻기 위해 과도하게 리튬 이온을 빼 낼 경우, 아래 반응에 의해 결정구조가 비가역적으로 바뀌어 원래의 결정구조로 돌아오지 못하므로 약 50% 수준의 용량만 이용하는 경우 가 대부분이다. 아래의 반응과정에서 산소기체가 발생하 고 열의 방출이 일어나면서 전해질의 산화반응을 유발시 킨다.
- 스피넬계 소재는 LiMn2O4가 대표적인 물질이며 기본 결정구조는 그림 4(b)와 같다. 층상계 소재와는 달리 리튬 이온의 이동이 3차원적으로 일어나므로 리튬 이온의 통로 가 다양하여 빠른 충방전이 필요한 경우에 적합하므로 주 로 하이브리드 전기자동차와 같은 고출력 에너지 전원으 로 사용된다. 또한, 값이 저렴하고 안전성이 우수하다는 장점도 있다. 그러나, 용량이 적고 고온에서 망간이온이 전해질에 용출되는 현상을 나타내므로 전지의 고온에서의 보관이나 충방전에 문제점을 갖고 있다.
- 올리빈계 소재는 리튬철인산염(LiFePO4)가 대표적인 물 질이며 기본 결정구조는 그림 4(c)와 같다. 다른 종류의 산 화물계 양극재와는 달리 인산염 구조를 갖고 있으므로 PO43−-group에 국부적으로 전자들이 강하게 결합되어 있 어 전자전도도가 낮고 소재내부에서의 리튬 이온의 확산 속도도 매우 느려 초기에는 상용화가 어려웠으나 탄소코 팅과 입자의 미세화를 통해 이러한 문제점들을 극복하여 최 근에는 대규모전력저장과 같은 분야에 응용되고 있다. 이외 에도 다양한 구조의 양극재들이 존재하는데 LixFe2-yVy(SO4)3 와 같은 NASICON type의 양극재와 Li2FeSiO4와 같은 LISICON type의 양극재도 고용량 양극 소재로 주목을 받 고 있는데 이들은 극히 낮은 전자 전도도와 이온 전도도 때문에 상용화를 위해서는 앞으로도 많은 연구와 개발이 뒤따라야 할 것으로 예상된다.
- 2.2. 음극재
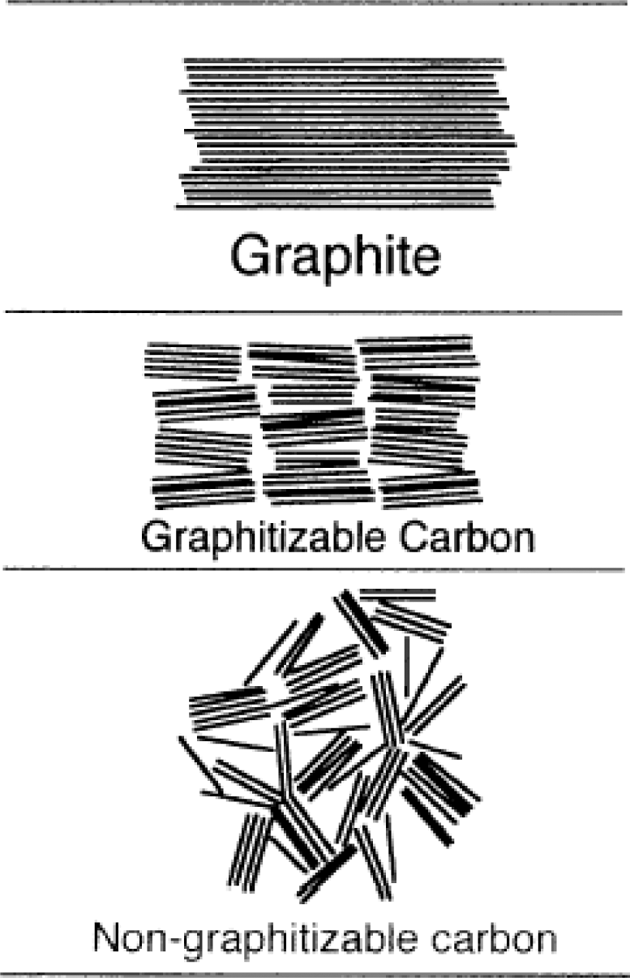
- 현재 주로 사용되고 있는 리튬이온전지용 음극재는 탄 소계 소재들이다. 앞서 설명한 바와 같이 이러한 탄소계 소재들은 리튬을 함유하고 있지는 않지만 리튬 원자가 존 재할 수 있는 공간을 제공하며 외부도선으로 연결되어 전 자를 원활하게 받아들이거나 전달하는 역할을 한다. 이러 한 탄소계 소재는 크게 흑연계와 비정질 탄소계로 나눌 수 있는데 비정질 탄소계 소재는 고온에서 흑연화가 가능 한 soft carbon(graphitizable carbon) 및 흑연화가 어려운 hard carbon(non-graphitizable carbon)으로 구분되며 흑 연계 소재는 인조흑연과 천연흑연으로 구분된다(그림 5). 흑연계 소재는 충방전 효율이 우수하고 낮은 반응전 압을 갖고 있어 음극재 시장의 대부분을 차지하고 있다. 비정질 탄소계 소재는 효율이 낮고 반응전압이 높아 에 너지밀도 측면에서 불리하지만 가격이 저렴하고 수명특 성이 우수하여 주로 자동차용 전지에 적용이 예상되고 있다.
- 음극재료에 요구되는 특성은 다음과 같다.
- 탄소계 음극소재는 충전시에 흑연을 구성하고 있는 graphene layer사이에 리튬 이온이 들어가면서 (intercalation) 환원되는 반응을 나타내고 방전 시에는 리튬이 리튬 이온 으로 산화되면서 grapheme-layer로부터 빠져 나오는(deintercalation) 반응을 보인다.
- 음극소재에 요구되는 특성으로는 높은 에너지밀도와 수 명특성 및 충방전 효율을 들 수 있는데 높은 에너지밀도 를 위해서는 중량당 혹은 부피당 높은 용량을 가져야 하 고 작동 전위가 낮아야 한다. 탄소계 음극의 경우, 충방전 과정에서 전해액이 분해되어 생성물들이 음극 표면에 쌓 이게 되는데 이를 SEI 층이라고 한다. SEI층 생성시에 리 튬 이온이 포함되어 비가역용량(초기 충전용량-초기 방전 용량)이 발생하게 되는데 비가역용량이 클수록 충방전 효 율이 낮아지게 된다. 또한, SEI층이 두꺼워지면 전극 계면 에서의 저항이 커지게 되므로 출력특성도 떨어지게 된다. 그러나, SEI 층은 이후 충방전 과정에서 전해액의 추가적 인 분해를 막아주는 역할을 하므로 긍정적인 효과도 제공 한다. 따라서, SEI층은 저항은 최소화하면서 전해액의 분 해를 막아주는 역할을 할 수 있도록 충방전 초기에 얇게 형성되어 더 이상 두껍게 발달하지 않도록 하는 것이 중 요하다.
- 탄소계 소재 이외에도 다양한 음극소재들이 사용 및 개 발되고 있다. 코발트 산화물이나 산화철 등 전이금속 산화 물이나 Li4Ti5O12와 같은 소재들도 음극재로 이용되고 있 다. 특히, Li4Ti5O12는 중량당 용량은 탄소계 소재에 비해 작으나 안전성과 출력특성 측면에서 유리하므로 하이브리 드 자동차용 전원과 같은 응용분야에 적용이 고려되고 있 다. 아울러, 차세대 음극재로서 실리콘이나 주석과 같은 소재들이 각광받고 있는데 이들은 탄소계 소재와는 달리 리튬 이온의 삽입과 탈리 반응에 의한 메커니즘이 아니라 리튬과의 합금 형성(alloying/de-alloyong)을 통한 메커니즘 에 의해 충방전이 이루어진다. 이러한 소재들은 기존의 탄 소계 소재에 비해 10배 가까운 훨씬 높은 중량당 용량을 갖고 있으므로 고용량 전지의 구현에 유리하나 충방전시 에 부피팽창 및 수축에 따른 전극의 파괴현상이 발생하므 로 아직까지 본격적인 상용화에 이르지 못하고 있다. 그러 나, 가까운 장래에 현재 진행되고 있는 많은 연구개발 노 력에 의해 상용화가 곧 이루어질 것으로 예상되고 있다.
구성요소
- 리튬 이온전지는 휴대폰과 노트북 전원 등 소형전지를 중심으로 시장이 형성되어 왔다. 그러나 최근 하이브리드 전기자동차 및 전력저장시스템의 등장으로 인해 중대형전 지 시장이 급격하게 팽창하고 있으며 RFID카드용 전원이 나 의료기기용 전원 등 초소형 리튬 이차전지에 대한 요 구도 증가하고 있다. 2012년 미국 테슬라 모터스에서는 리튬 이온전지를 장착한 전기자동차를 개발하여 1회 충전 시 426 km라는 놀라운 주행거리를 달성하여 전기자동차 시대를 앞당기는데 크게 기여한 바 있다[7]. 이 자동차는 고용량 원통형 리튬 이온전지를 7000개 가량 장착하여 주 행거리를 늘리는 기술을 적용하였다. 또한, wearable 정보 전자기기에 적합한 flexible전지에 대한 연구개발 또한 활 발하게 전개되고 있다. 최근 LG화학에서는 케이블형 리튬 이온전지를 개발하는데 성공하여 목걸이, 팔찌 형태의 전 지 제조가 가능하여 ‘입는 전지’ 구현을 선도하고 있다[8]. 뿐만 아니라, 심장 제세동기나 인슐린 펌프 등 인체에 삽 입하여 사용하는 의료기기의 보급에 따라 이러한 기기의 작동에 필요한 전지의 개발이 활발히 진행되고 있는데 특 히 이들 전지는 무선충전이 가능한 형태로 제작되어 전원 교체를 위한 재수술이 필요 없도록 하는 역할을 한다. 이 러한 새로운 리튬 이온전지 시장의 출현에 따라, 상기 목 적에 부합하는 적합한 소재의 개발이 필요하게 되었는데 리튬 이온전지용 소재는 크게는 고용량, 고출력, 고안전성 특성 향상 및 이와 더불어 저가 소재개발에 초점이 맞추 어져 있다.
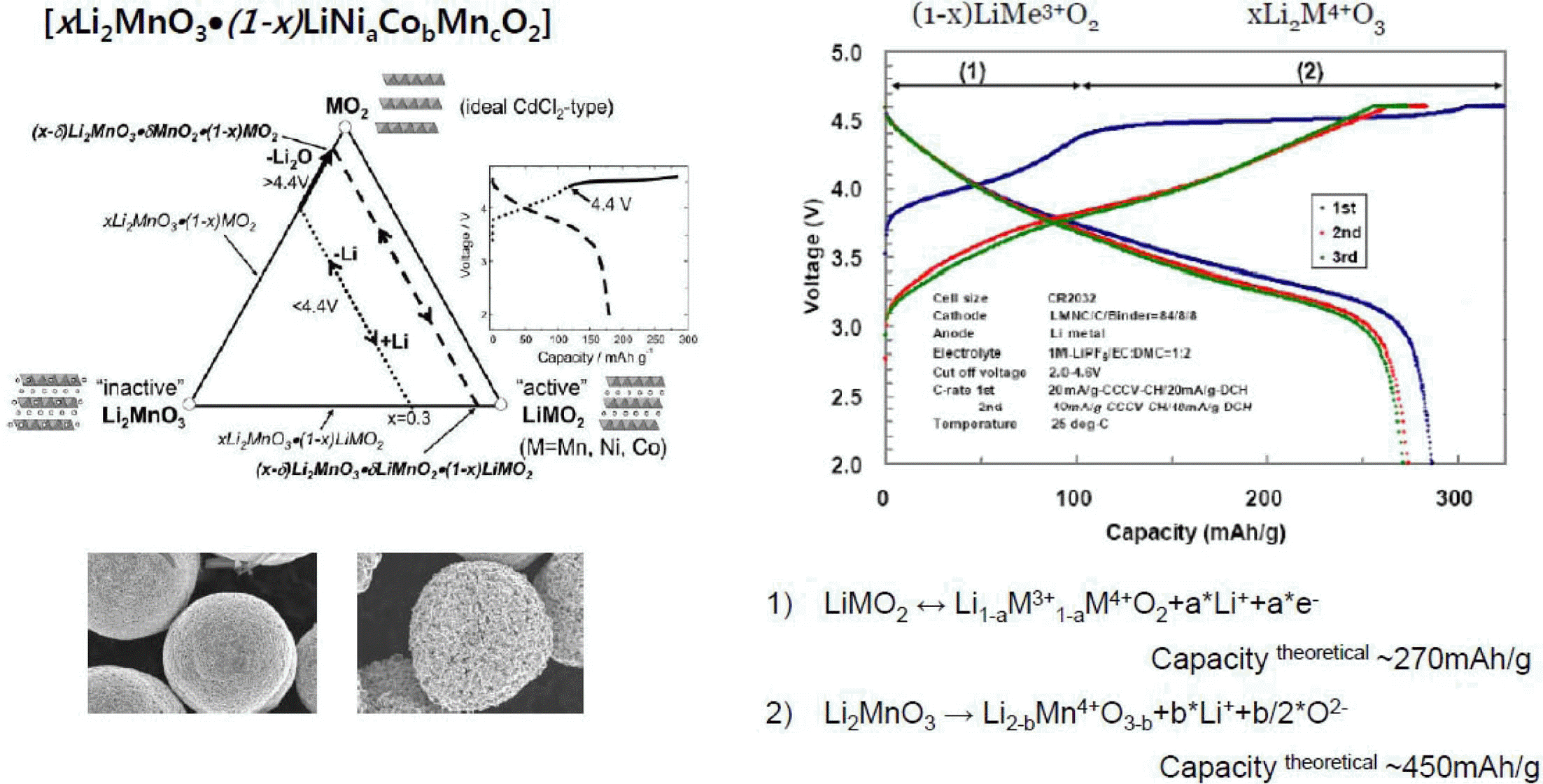
- 양극재의 경우 LiCoO2가 가장 널리 사용되어 왔으나 최 근에는 이른바 3원계 소재가 LiCoO2의 시장규모와 맞먹 는 수준까지 성장하였고 향후에는 고용량 소재에 대한 요 구에 맞추어 니켈함량이 높은 3원계 소재가 계속 출시될 전망이다. 아직까지 고 니켈함량 양극소재의 경우 열적안 정성이 낮고 수명특성이 떨어져 본격적인 상용화에 이르 지 못하고 있으나 조만간 이러한 문제가 해결되어 전지에 적용될 것으로 예상되고 있다. 또한 차세대 양극재로서 Li2MnO3-LiMO2형태의 고용체 양극재 또한 주목을 받고 있다. 소위 OLO(overlithiated oxide)라고 불리는 이 양극 재는 4.5V 수준의 고전압까지 충방전이 가능하며 200 mAh/g이상의 고용량 구현이 가능하지만 출력 및 수명특 성이 낮은 단점을 갖고 있어 앞으로도 많은 연구가 필요 한 소재이다(그림 6).
- 아울러, 기존에 널리 사용되어 오던 LiCoO2가 고전압 충전시 문제점을 일으키므로 이러한 단점을 표면코팅이나 이종원소 치환을 통해 해결함으로서 고용량을 구현하고자 하는 움직임도 있다. 현재 LiCoO2의 표면에 알루미나를 코팅하여 고전압 영역까지 안정성을 높인 제품이 전지에 적용되어 사용되고 있으며 AlF3, AlPO4등의 무기소재를 코팅하여 충방전 중 발생하는 전해액과의 부반응을 억제 하여 수명특성을 향상하는 내용의 연구도 진행된 바 있다.
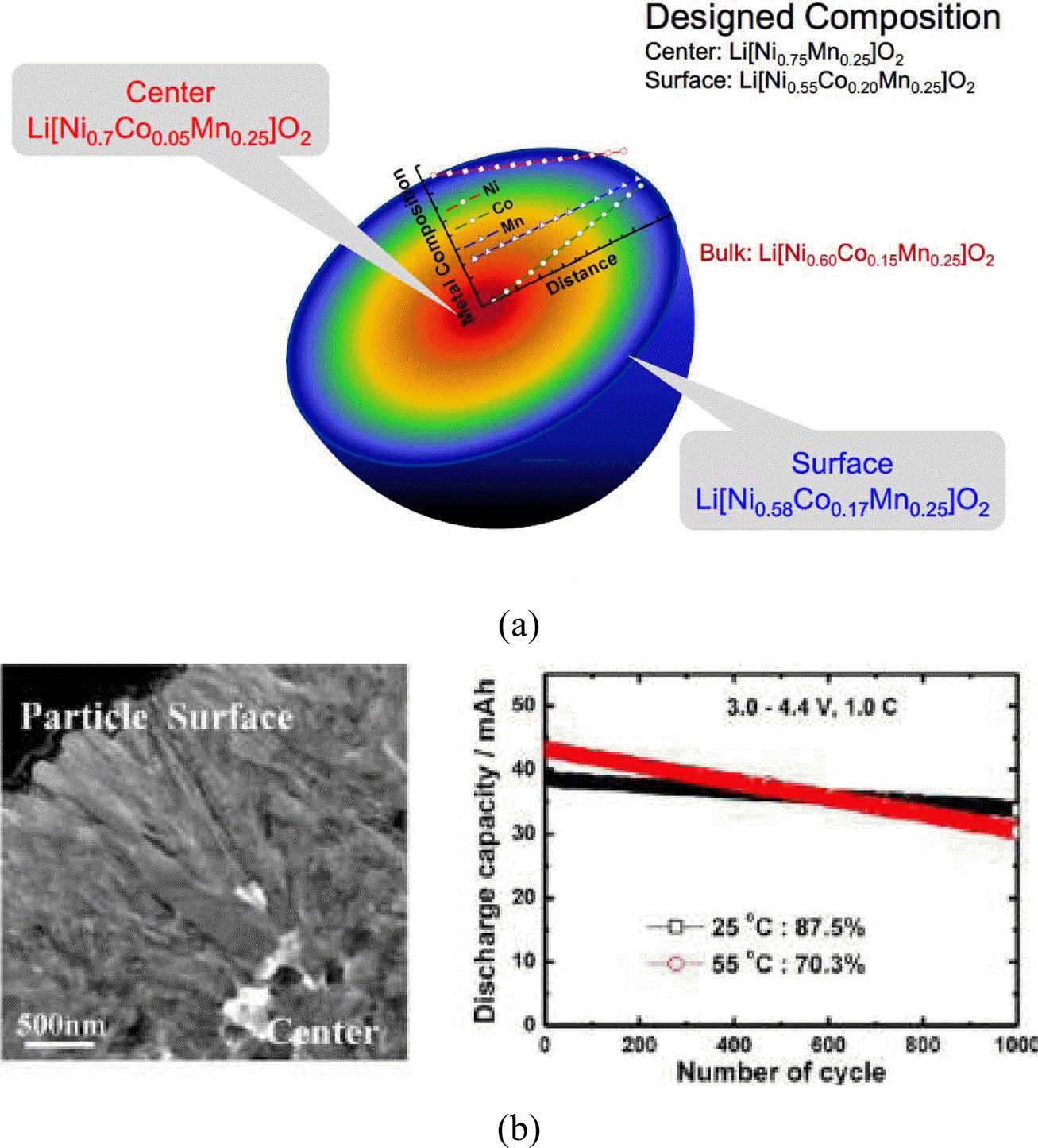
- 최근에는 그림 7에서와 같이 3원계 소재에 포함된 니켈, 망간, 코발트 등 전이금속에 대해 입자 내에서 농도 구배 (concentration gradient)를 부여하여 입자표면과 입자중심 간의 농도에 차이를 줌으로써 고용량을 달성하면서 수명 이나 열적 안정성을 향상시키는 코어-쉘(core-shell)구조 혹은 농도구배 양극재에 대한 연구개발도 활발히 진행되 고 있다. 이러한 소재들은 전해액과 접촉하는 입자표면부 분에는 니켈의 함량을 줄이고 입자 중심부분에는 니켈함 량이 높게 설계하여 전해액과의 부반응을 줄이고 있다.
- 올리빈 구조를 지닌 LiFePO4는 다른 양극재에 비해 탁 월한 안전성을 갖고 있어서 전력저장용 전지로 주목을 받 고 있으나 작동전압이 낮아 에너지밀도가 떨어지는 단점 을 동시에 지니고 있다. 올리빈계 양극재의 안전성을 그대 로 유지하면서 작동전압을 높일 수 있는 소재가 LiMnPO4 이다. 그러나 본 소재는 LiFePO4에 비해서도 더욱 낮은 전자 전도도와 이온 전도도를 갖고 있어 미국, 일본을 비 롯하여 각국에서 LiMnPO4의 성능향상을 위해 노력하고 있으나 아직 본격적인 상용소재로의 적용이 이루어지고 있지는 않다.
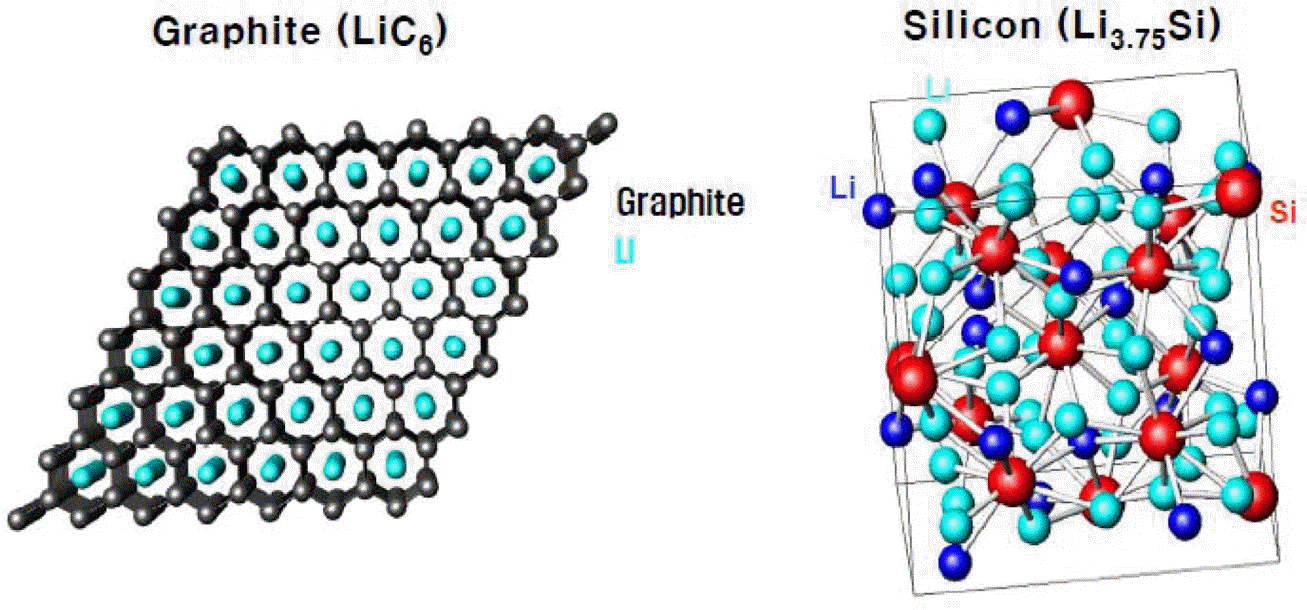
- 음극재의 경우에는 리튬 이온전지의 상용화 초기부터 지금까지 꾸준하게 흑연계 소재가 가장 널리 사용되고 있 다. 그러나, 흑연계 소재가 갖고 있는 이론용량이 372 mAh/g에 불과하여 고용량 전지에 적용하기에는 한계가 있다. 따라서, 고용량 음극소재에 대한 요구가 증가하고 있는데 이러한 요구에 부응하여 실리콘, 주석, 금속산화물 계 소재들이 등장하게 되었다(그림 8). 앞서 기술한 바와 같이 실리콘이나 주석계 소재들은 리튬과 합금을 형성하 는 과정에서 심각한 부피변화를 겪기 때문에 충방전 과정 에서 전극이 파괴되어 전자전도통로가 끊어지고 전지부피 가 변화하는 등의 문제를 일으키게 된다. 이러한 문제를 해결하기 위한 실용적인 접근으로는 단순히 기존 흑연계 소재와 소량의 실리콘을 혼합하거나 복합체를 형성하여 흑연보다 약간 높은 용량을 구현하는 수준의 방법을 이용 하기도 한다. 또한, 실리콘의 부피변화를 해결하기 위한 보다 근원적인 방법으로서 나노와이어 혹은 다공성 실리 콘 등 나노구조체를 형성하여 부피변화를 흡수할 수 있는 구조를 구현하는 접근방법 등도 함께 개발되고 있다. 그러 나 아직까지 해결해야 할 문제점들이 많아 실리콘이나 주 석을 이용한 리튬 이온전지는 본격적으로 상용화 단계에 접어들지 못하고 있다.
연구개발 동향
- 리튬 이차전지는 소형 전자기기뿐만 아니라 전기자동차 및 전력저장시스템의 차세대 에너지 저장소재로써 주목받 고 있으며, 다양한 기능을 구현하기 위해 초소형, 고용량 리튬 이차전지를 중심으로 많은 연구가 진행 중이다. 고기 능성 리튬 이차전지를 구현하기 위해서는 전극소재인 분 말소재 및 합금소재의 개발 및 제조공정 개발이 요구된다. 또한, 분말 전극소재의 표면처리를 통한 고효율에 대한 연 구가 중점적으로 진행되고 있고 있으나 장시간 안정성을 위한 연구개발이 요구된다. 따라서 차세대 고용량 저장소 재로써 리튬 이차전지가 응용되기 위해서는 전극 분말소 재의 개발 및 표면, 계면 특성 제어가 가장 중요할 것으로 예상된다.
결 론
- 1. Research and development trend of lithium ion battery. http://www.battery.or.kr/. (2008.
- 2. R. A Huggins, Energy Storage. (2010) Springer.
- 3. Industrial trend of lithium ion battery J H Kang. Korea Eimbank Overseas Econominc Research Instiute : KERI. (2011.
- 4. S. I Byun, Fundamentals of battery and their application into practice. (2003) Cheong moon gak publishers.
- 5. A Manthiram, A. V Murugan, A Sarkar and T Muraliganth, Energy & Environ. Sci. (2008) 1 621.Article
- 6. R. E Franklin, Acta Cryst. (1951) 4 253.Article
- 7. http://www.teslamotors.com.
- 8. http://www.lgchem.com.
- 9. M. M Thackeray, S-H Kang, C. S Johnson, J. T Vaughey, R Benedek and S. A Hackney, J. Mater. Chem. (2007) 17 3112.Article
- 10. Y. K Sun, S. T Myung, B. C Park, J Prakash, I Belharouak and K Amine, Nature Materials. (2009) 8 320.ArticlePDF
- 11. H-J Noh, Z Chen, C. S Yoon, J Lu, K Amine and Y-K Sun, Chem. Mater. (2013) 25 2109.Article
REFERENCES
Figure & Data
References
Citations
Citations to this article as recorded by 

- A neuro-fuzzy system to evaluate the remaining useful life of the lithium-ion battery using the impedance spectrum in the overall range of SOCs
Min-Seong Kim, Abdul Shakoor Akram, Woojin Choi
Journal of Power Electronics.2025; 25(1): 103. CrossRef - Highly Stable and Rechargeable Lithium‐Ion Battery Using a Designed Organic PTVE‐Impregnated Porous Graphitic Carbon Composite
Ji-Won Son, Jae Seob Lee, Hyun Ho Choi, Fanglin Wu, Hong-Il Kim, Tae Ju Kang, Hyun Woo Kim, Shan Fang, Ying Liu, Jung Sang Cho, Amar Patil
International Journal of Energy Research.2025;[Epub] CrossRef - Hydrogen Reduction Behavior of NCM-based Lithium-ion Battery Cathode Materials
So-Yeong Lee, So-Yeon Lee, Dae-Hyeon Lee, Ho-Sang Sohn
journal of Korean Powder Metallurgy Institute.2024; 31(2): 163. CrossRef - Effect of Calcination Temperature on Ionic Conductivity of All-solid State Battery Electrolytes
Yu Taek Hong, Ji Min Im, Ki Sang Baek, Chan Gyu Kim, Seung Wook Baek, Jung Hyun Kim
New & Renewable Energy.2024; 20(2): 71. CrossRef - FeCO3/rGO Composites Prepared by CO2 Capture and Carbonate Conversion: Anode Material in Lithium-Ion Batteries with Enhanced Performance
Sanglim Lee, Gahwi Gu, Daeung Park, Hwiyun Im, Yongjae Lee, Junseok Moon, Weonho Shin, Hiesang Sohn
Membrane Journal.2024; 34(5): 253. CrossRef - Research Trend in Rock Salt Structured High Entropy Cathode
Minjeong Kim, Jahun Koo, Minjeong Kang, Juah Song, Chunjoong Kim
Ceramist.2022; 25(1): 90. CrossRef - Recovery of Co and Ni from Strong Acidic Solution by Cyanex 301
Yeon-Chul Cho, Ki-Hun Kim, Jae-Woo Ahn
Resources Recycling.2021; 30(6): 28. CrossRef
Research Trend of Electrode Materials for Lithium Rechargeable Batteries
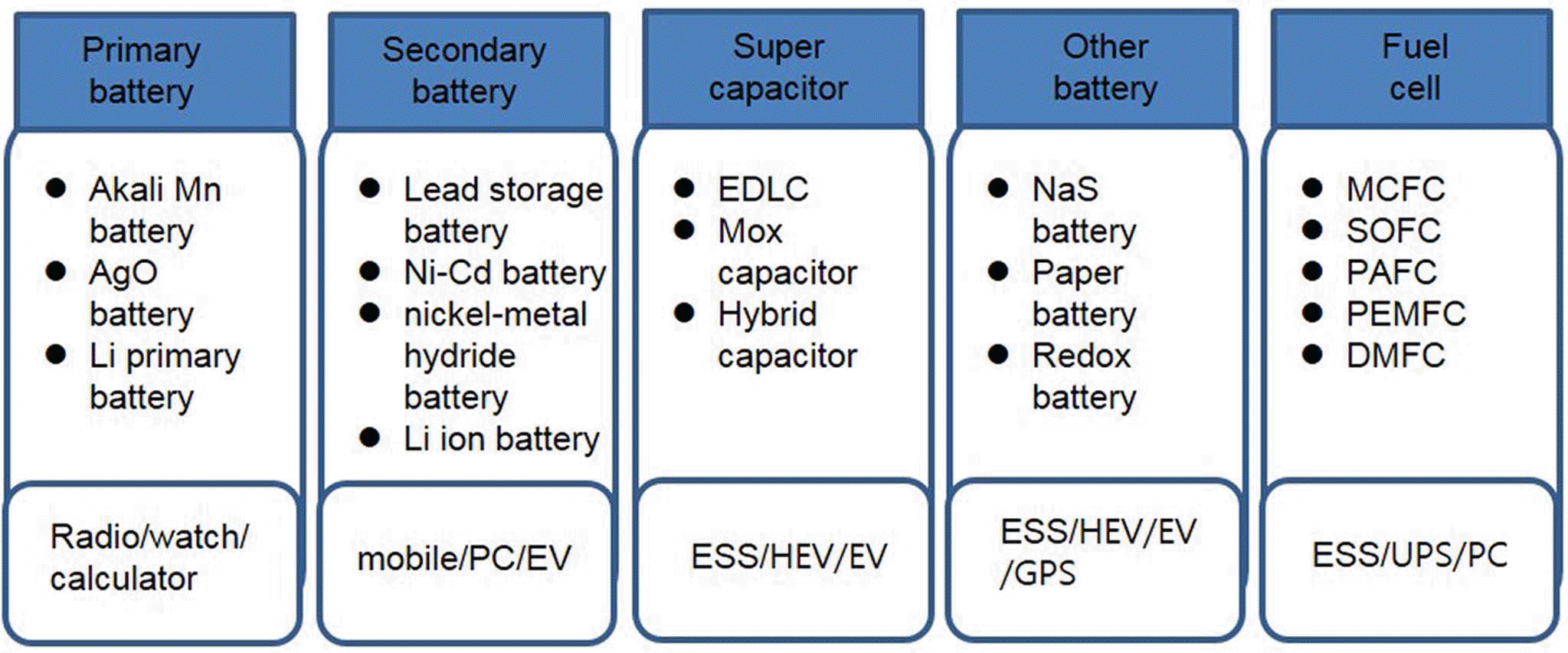



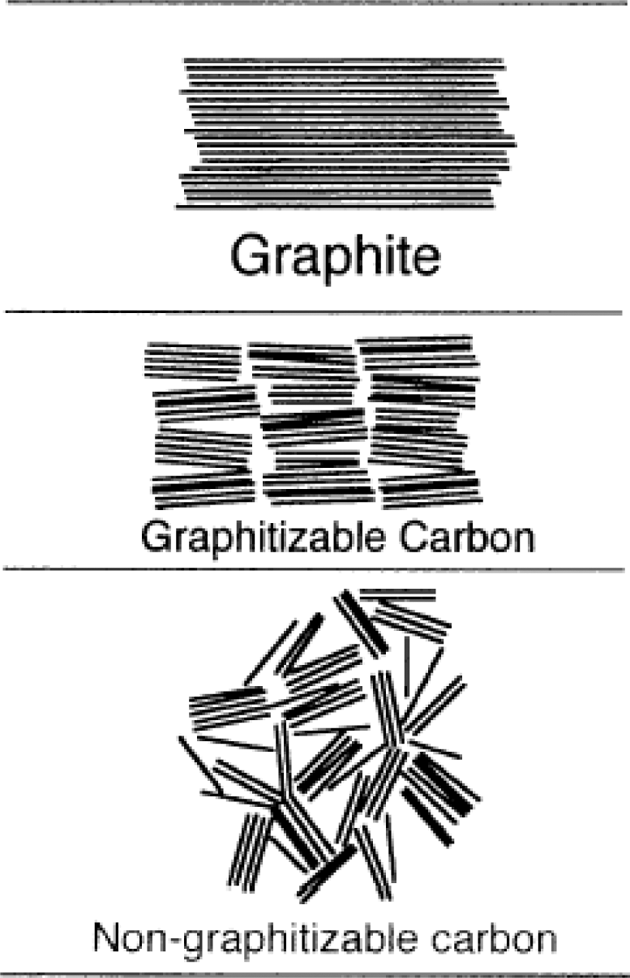


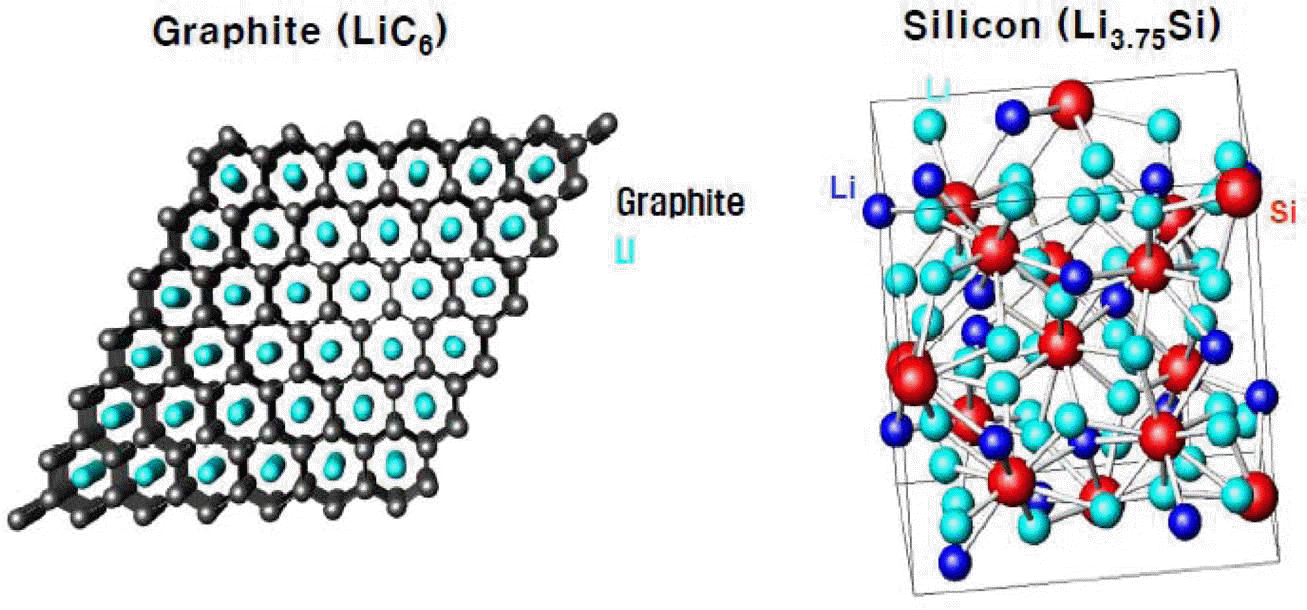
Fig. 1.
Various batteries and its application fields [1].
Fig. 2.
Charge/discharge and electrode reaction of lithium ion battery [3].
Fig. 3.
Voltage changes of lithium ion battery during charge/discharge.
Fig. 4.
Crystal structures of lithium ion battery cathode materials [5].
Fig. 5.
Microstructure of various carbon based anode materials [6].
Fig. 6.
Charge/discharge and voltage changes of Li2MnO3-LiMO2 solid solution [9].
Fig. 7.
(a) structures and (b) properties of various concentration of cathode materials [11].
Fig. 8.
Crystal structures of graphite and silicon based anode materials.
Fig. 1.
Fig. 2.
Fig. 3.
Fig. 4.
Fig. 5.
Fig. 6.
Fig. 7.
Fig. 8.
Research Trend of Electrode Materials for Lithium Rechargeable Batteries
TOP
 KPMI
KPMI

 Cite this Article
Cite this Article








