Articles
- Page Path
- HOME > J Korean Powder Metall Inst > Volume 22(4); 2015 > Article
-
Article
NiO-TiH2 혼합분말의 반응을 이용한 NiTi 합금분말 제조 - 전기철, 이한얼, 임다미, 오승탁*
- Synthesis of NiTi Alloy Powder by the Reaction of NiO-TiH2 Mixing Powders
- Ki Cheol Jeon, Han-Eol Lee, Da-Mi Yim, Sung-Tag Oh*
-
Journal of Korean Powder Metallurgy Institute 2015;22(4):266-270.
DOI: https://doi.org/10.4150/KPMI.2015.22.4.266
Published online: July 31, 2015
서울과학기술대학교 신소재공학과
Department of Materials Science and Engineering, Seoul National University of Science and Technology, Seoul 139-743, Korea
- * Corresponding Author: Sung-Tag Oh, TEL: +82-2-970-6631, FAX: +82-2-973-6657, E-mail: stoh@seoultech.ac.kr
• Received: July 20, 2015 • Revised: August 10, 2015 • Accepted: August 13, 2015
© The Korean Powder Metallurgy Institute. All rights reserved.
- 810 Views
- 2 Download
- 1 Crossref
Abstract
- The synthesis of NiTi alloy powders by hydrogen reduction and dehydrogenation process of NiO and TiH2 powder mixtures is investigated. Mixtures of NiO and TiH2 powders are prepared by simple mixing for 1 h or ball milling for 24 h. Simple-mixed mixture shows that fine NiO particles are homogeneously coated on the surface of TiH2 powders, whereas ball milled one exhibits the morphology with mixing of fine NiO and TiH2 particles. Thermogravimetric analysis in hydrogen atmosphere reveals that the NiO and TiH2 phase are changed to metallic Ni and Ti in the temperature range of 260 to 290°C and 553 to 639°C, respectively. In the simple-mixed powders by heat-up to 700°C, agglomerates with solid particles and solidified liquid phase are observed, and the size of agglomerates is increased at 1000°C. From the XRD analysis, the presence of liquid phase is explained by the formation and melting of NiTi2 intermetallic compound due to an exothermic reaction between Ni and Ti. The simple-mixed powders, heated to 1000°C, lead to the formation of NiTi phase but additional Ni-, Ti-rich and Ti-oxide phases. In contrast, the microstructure of ball-milled powders is characterized by the neck-grown particles, forming Ni3Ti, Ti-oxide and unreacted Ni phase.
- NiTi 금속간화합물은 형상기억 효과와 함께 초탄성, 우 수한 내식성 및 생체 적합성을 가지고 있어 구조용 및 생 체용 재료로 다양하게 응용되고 있으며[1-3], 일반적으로 주조 또는 분말야금 공정을 이용하여 제조한다. 그러나 아 크 또는 유도용해에 의한 주조공정은 조성의 비균질성, 산 화 및 편석에 의한 결함 형성 등의 문제가 있어 이를 해 결하기 위한 후속 공정이 요구되는 단점이 있다[4]. 분말 야금 공정은 Ni과 Ti의 원료분말을 고에너지 볼 밀링하거 나[5] 또는 금속간화합물이 형성될 때 발생하는 높은 반응 열을 이용하는 자전고온합성 (SHS; self-propagating hightemperature synthesis) 법[6, 7]으로 NiTi 분말을 제조한 후, 상압 및 가압소결을 이용하여 조밀체로 제조하는 방법이 다[3]. 그러나 Ti/Ni-rich 상의 형성 및 미세기공의 존재로 완전 조밀화된 균질한 조성의 NiTi 시편제조에는 어려움 이 있다[8].
- 소결체의 밀도향상을 위한 방법으로 TiH2를 Ti의 원료 분말로 사용하여 탈수소 반응과 소결을 통하여 고밀도의 NiTi 및 Ti-6Al-4V 시편을 제조하는 연구가 진행된 바 있 다[9, 10]. 기존 연구에서 소결성 향상의 이유는 주로 TiH2 의 분해에 의한 부피감소, 성형단계에서 파괴에 의한 입자 미세화 및 낮은 산소함유량 등으로 설명하고 있으나[11], 일부 연구에서는 반대되는 결과를 보고한 경우도 있다 [12]. 또한, TiH2분말의 사용은 순수한 Ti분말과 비교하여 경제적이라는 측면과 함께 탈수소 반응에 의한 산화억제 효과로 균질한 NiTi 상의 제조가 가능한 장점도 있다 [11, 13]. 한편 균질한 조성제어를 위해서는 Ni 입자크기 등 원료분말의 특성이 미치는 영향도 고려해야 하나, 아직 까지 이에 대한 많은 연구가 이루어지지 않았다.
- 따라서 본 연구에서는 Ni-50 at% Ti 합금을 실험계로 선택하고, Ni 및 Ti의 원료분말로 NiO 및 TiH2 를 사용 하여 분말특성과 열처리 온도에 따른 상변화를 분석하였 다. 입자크기 등 혼합분말의 특성은 원료분말의 단순혼 합 및 볼 밀링 공정으로 제어하였으며, NiO의 수소환원 및 TiH2의 탈수소 거동과 미세조직 변화를 고찰하고 공 정조건이 NiTi 금속간화합물 등 반응상 형성에 미치는 영향을 해석하여 최적의 합금분말 합성조건을 제시하고 자 하였다.
1. 서 론
- 본 연구에서는 순도 99%, 입자크기 <5 μm의 NiO (Sigma-Aldrich, USA)와 순도 99%, 입자크기 <5 μm의 TiH2 (Alfa Aesar, USA)를 원료분말로 사용하였다. 그림 1 은 원료분말의 형상을 나타낸 것으로 TiH2 분말의 경우 상대적으로 입자크기가 크며 각진 형태임을 알 수 있다. 원료분말은 최종 조성이 Ni-44.9 wt% Ti (Ni-50 at% Ti) 가 되도록 칭량한 후 각각 단순혼합과 볼 밀링을 통하여 혼합분말로 제조하였다. 단순혼합은 3차원 혼합기를 이용 하여 직경 10 mm의 고순도 알루미나 볼과 함께 1시간 혼 합한 경우이고, 볼 밀링에서는 수평식 회전형 밀을 이용하 여 동일한 볼로 24시간동안 밀링하였다.
- 제조 조건에 따른 혼합분말의 환원 및 탈수소 반응거동 은 TGA (thermogravimetric analysis) 기기를 이용하여 수 소분위기에서 10°C/min의 승온속도로 1000°C까지 가열하 며 무게변화를 측정하여 해석하였다. 혼합분말의 제조 조 건 및 열처리온도에 따른 미세조직 특성의 변화는 XRD (Rigaku Denki Co., Japan) 와 SEM (JEOL Co., Japan) 을 이용하여 분석하였다.
2. 실험방법
- 그림 2는 NiO-TiH2 원료분말을 단순혼합 또는 볼 밀링 한 후의 미세조직 사진이며, 볼 밀링한 경우에서 NiO 및 TiH2 분말을 확인하고자 EDX mapping으로 분석한 결과 를 그림 3에 나타내었다. 그림 1의 원료분말 크기와 비교 할 때, NiO의 경우는 단순혼합 또는 볼 밀링한 경우 모두 입자크기가 감소하나 TiH2 분말은 볼 밀링한 경우에서만 크기가 감소됨을 알 수 있다. 한편, 그림 2(a)와 같이 단순 혼합한 경우에서는 TiH2 분말표면에 미세한 NiO 분말들 이 균일하게 코팅된 상태로 존재하였으나, 볼 밀링한 경우 는 코팅보다는 원료분말들이 혼합된 상태로 존재함을 알 수 있다. 혼합분말에서 이러한 입자크기와 NiO 분포의 차 이는 환원 및 탈수소 반응거동과 반응상 형성 등에 많은 영향을 미칠 것으로 판단된다.
- 그림 4는 단순혼합 및 볼 밀링한 원료분말을 수소분위 기 중에서 10°C/min의 승온속도로 가열하며 무게변화를 관찰한 결과이다. 단순 혼합한 분말의 경우 290°C에서 급 격한 무게감소가 관찰되고 볼 밀링한 경우는 260°C로 상 대적으로 낮은 온도에서 무게 감소가 시작되며 감소량은 각각 12% 및 9%이다. 이러한 무게감소는 NiO의 환원에 기인한 것이며 기존에 보고된 연구결과와도 일치한다 [14, 15]. 한편 이론적인 무게감소량이 12.8%임을 고려할 때, 볼 밀링한 분말은 상대적으로 낮은 온도에서 환원이 시작되었음에도 불구하고 완전한 환원이 이루어지지 않았 음을 알 수 있다. Lee and Kim[14]은 7 μm크기의 NiO 분 말을 볼 밀링하였을 경우 환원이 시작되는 온도는 낮아지 나 환원이 종료되는 온도는 높아진다고 보고한 바가 있으 며, 입자미세화에 따라 환원거동이 화학반응에서 확산지 배 반응으로 변화되기 때문인 것으로 해석하였다. 따라서 그림 4의 TGA결과에서 보여주는 NiO의 환원온도 및 무 게 감소량의 변화는 입자특성에 따른 환원거동의 차이로 설명할 수 있다.
- 혼합분말의 TGA결과인 그림 4에서는 NiO의 환원에 의 한 저온부위의 무게감소뿐만 아니라 약 550°C 이상의 온 도에서도 무게변화가 관찰된다. 단순 혼합한 분말에서는 639°C에서 뚜렷한 무게감소가 관찰되고 볼 밀링한 경우는 553°C에서 무게 변화를 보여준다. 일반적으로 TiH2의 탈 수소 반응온도는 약 400~600°C로 보고되었으며 열처리 분위기, 승온속도 및 분말크기 등에 의존한다고 알려져 있 다[16, 17]. 따라서, 볼 밀링한 분말이 상대적으로 낮은 탈 수소 온도를 나타내는 이유는 입도감소에 의한 비표면적 증가로 해석할 수 있으나[16], 상대적으로 무게감소 양이 적은 이유에 대해서는 후속 연구가 요구된다.
- 그림 5는 TGA에서 나타나는 무게변화 후의 온도에서 급랭한 혼합분말을 SEM으로 관찰한 미세조직 사진이다. 그림 5(a)와 (d)에서 보여주듯이, 400°C에서 급랭한 시편 은 초기의 혼합분말과 유사한 미세조직 특성을 나타내었 다. 그러나 볼 밀링한 분말을 700°C까지 가열하고 급랭한 경우는 (그림 5e) 미세입자들의 입자성장이 관찰되며, 단 순 혼합한 분말에서는 (그림 5b) 액상이 형성된 것으로 판 단되는 특이한 미세조직을 보여준다. 한편 급랭온도가 1000°C로 증가한 경우, 단순 혼합한 분말에서는 고상입자 들이 응고된 액상 층에 둘러 쌓인 형태로 커다란 응집체 를 형성하고 있으며 볼 밀링한 분말에서는 전체적으로 목 성장이 일어난 형태의 미세조직 특성을 나타내었다. 따라 서 볼 밀링 조건 및 열처리 온도에 따른 미세조직 변화를 해석하고자 XRD 분석을 행하였다.
- 그림 6(a)는 단순 혼합한 분말에 대한 XRD결과로서, 혼 합 후에는 원료분말인 TiH2와 NiO 상으로만 존재하나 400°C에서 급랭한 경우는 NiO가 환원되어 Ni상으로만 존 재함을 알 수 있다. 한편 볼 밀링한 분말 (그림 6b)을 400°C까지 가열하면, TiH2 및 Ni과 함께 일부 미환원된 NiO 피크가 관찰됨을 알 수 있으며 이는 그림 4의 TGA 와 일치하는 결과이다. 700°C이상의 온도에서 급랭할 경 우 단순 혼합한 분말은 Ni/Ti/NiTi2 상이 형성되고 고온에 서는 Ni3Ti/NiTi/NiTi2/TiO 상으로 존재하며, 볼 밀링한 분 말에서는 Ni/Ni3Ti/NiTi/TiO2상과 고온에서는 Ni/Ni3Ti/ Ti2O3상이 형성됨을 알 수 있다.
- XRD 분석결과를 고려하면 그림 5(b)와 (c)에서 나타나 는 액상조직은 NiTi2의 형성과 관련하여 해석할 수 있다. 즉, 700°C에서 분석한 XRD결과와 같이 금속 Ni과 Ti로 존재하는 원소들이 SHS에 의하여 NiTi2가 일부 형성되고 [18] 이때 발생되는 반응열에 의해 Ni-Ti 계 금속간화합물 중 상대적으로 저융점 (984°C)인 NiTi2 상이 액상으로 변 화되기 때문으로 해석된다. 볼 밀링한 분말의 경우에서도 SHS의 반응열에 의한 액상형성이 가능하나 그림 6(b)의 XRD결과와 같이 일부 미환원된 NiO의 존재와 상대적으 로 고융점인 Ni3Ti와 NiTi의 형성으로 액상의 존재가 어려 웠기 때문으로 해석된다. NiO-TiH2를 원료분말로 사용한 본 연구에서는 반응 후에 대부분이 Ni3Ti상으로 존재하고 일부 산화물 상이 형성되었으나, 단순 혼합한 경우에서는 NiTi 상의 형성이 가능함을 확인하였다. 향후 환원 및 탈 수소 반응거동과 미세조직간의 상관관계에 대한 연구를 통해 NiTi 금속간화합물의 형성을 위한 최적의 공정조건 확립이 요구된다.
3. 실험결과 및 고찰
Fig. 4
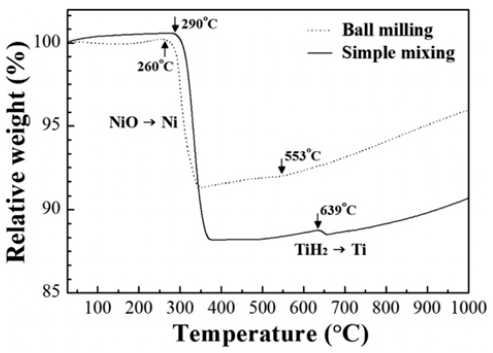
TGA curves for simple-mixed and ball-milled NiOTiH2 powders obtained at a scanning rate of 10°C/min in hydrogen atmosphere.

Fig. 5

SEM images of NiO-TiH2 powders prepared by (a)-(c) simple mixing and (d)-(f) ball milling; heat treatment without holding time at (a) and (d) 400°C, (b) and (e) 700°C, (c) and (f) 1000°C.

Fig. 6
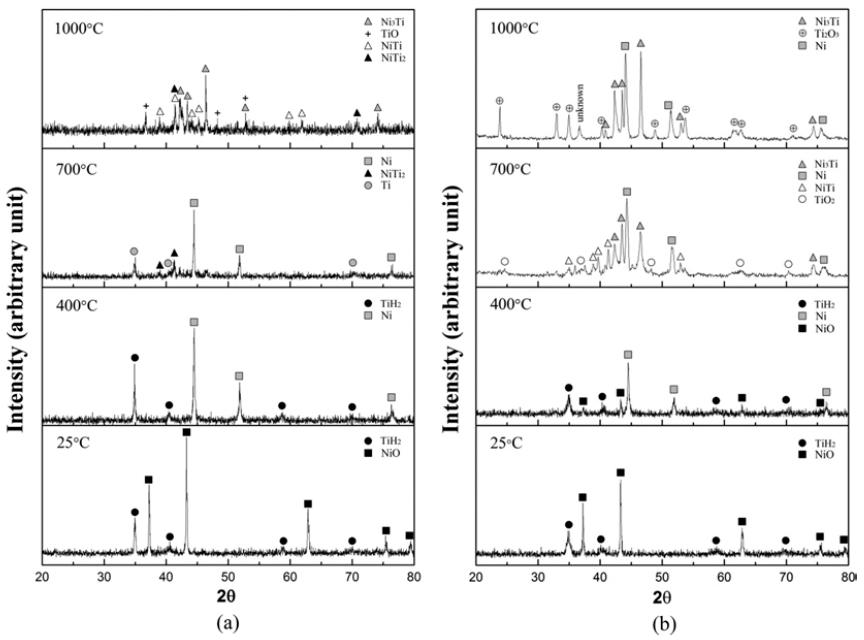
XRD profiles of the powders at different temperatures of heat treatment prepared by (a) simple mixing and (b) ball milling.

- 본 연구에서는 NiO-TiH2 혼합분말의 특성과 열처리 온 도에 따른 상변화를 분석하여 공정조건이 NiTi 합금분말 의 형성에 미치는 영향을 분석하였다. NiO-TiH2 원료분말 을 단순 혼합한 경우 TiH2 분말표면에 미세한 NiO 분말 들이 균일하게 코팅된 상태로 존재하였으나, 볼 밀링한 경 우는 원료분말이 혼합된 상태의 미세조직을 나타내었다. 수소분위기에서의 TGA 분석결과 260-290°C의 온도범위 에서 NiO의 환원에 의한 무게 감소와 약 550°C 이상 온 도에서 TiH2의 분해에 의한 무게변화가 관찰되었다. 단순 혼합한 분말을 700°C이상의 온도까지 가열하고 급랭한 경 우 고상입자들이 응고된 액상 층에 둘러 쌓인 형태를 나 타내었고, 볼 밀링한 분말의 경우는 입자 및 목 성장이 일 어난 형태를 보여주었다. 급랭온도에 따른 XRD 분석결과 로부터, 단순 혼합한 분말에서의 액상은 NiTi2 형성과 관 련된 것 해석하였으며, NiTi 상은 볼 밀링한 혼합분말에서 는 존재하지 않았으나 단순 혼합한 분말의 경우에서는 형 성이 가능함을 확인하였다.
4. 결 론
-
Acknowledgements
- 이 연구는 서울과학기술대학교 교내연구비의 지원으로 수행되었습니다.
감사의 글
- 1. W. J. Buehler, J. V. Gilfrich and R. C. Wiley: J. Appl. Phys., 34 (1963) 1475. .Article
- 2. K. Otsuka and X. Ren: Prog. Mater. Sci., 50 (2005) 511. .Article
- 3. M. H. Elahinia, M. Hashemi, M. Tabesh and S. B. Bhaduri: Prog. Mater. Sci., 57 (2012) 911. .Article
- 4. J. Frenzel, Z. Zhang, K. Neuking and G. Eggeler: J. Alloys Comp., 385 (2004) 214. .Article
- 5. T. Mousavi, F. Karimzadeh and M.H. Abbasi: Mater. Sci. Eng. A, 487 (2008) 46. .Article
- 6. C. L. Yeh and W. Y. Sung: J. Alloys Comp., 376 (2004) 79. .Article
- 7. J. S. Kim, V. E. Gjunter, J. C. Kim and Y. S. Kwon: J. Korean Powder Metall. Inst., 17 (2010) 59 (Korean). .Article
- 8. J. C. Hey and A. P. Jardine: Mater. Sci. Eng. A, 188 (1994) 291. .Article
- 9. B. Bertheville, M. Neudenberger and J.-E. Bidaux: Mater. Sci. Eng. A, 384 (2004) 143. .Article
- 10. C. R. F. Azevedo, D. Rodrigues and F. B. Neto: J. Alloys Comp., 353 (2003) 217. .Article
- 11. I. M. Robertson and G. B. Schaffer: Powder Metall., 53 (2010) 12. .Article
- 12. G. Chen and P. Cao: Metall. Mater. Trans., 44A (2013) 5630. .Article
- 13. B.-Y. Li, L.-J. Rong and Y.-Y. Li: J. Mater. Res., 13 (1998) 2847. .Article
- 14. J.-S. Lee and B.-S. Kim: Mater. Trans., 42 (2001) 1607. .Article
- 15. B. Janković, B. Adnadević and S. Mentus: Thermoch. Acta, 456 (2007) 48. .Article
- 16. V. Bhosle, E.G. Baburaj, M. Miranova and K. Salama: Mater. Sci. Eng. A, 356 (2003) 190. .Article
- 17. A. Rasooli, M. A. Boutorabi, M. Divandari and A. Azarniya: Bull. Mater. Sci., 36 (2013) 301. .Article
- 18. B. Y. Li, L. J. Rong, Y. Y. Li and V. E. Gjunter: Acta Mater., 48 (2000) 3895..Article
Figure & Data
References
Citations
Citations to this article as recorded by 

- Effect of Heat Treatment Atmosphere on the Microstructure of TiH2-MoO3 Powder Mixtures
Ki Cheol Jeon, Sung Hyun Park, Na-Yeon Kwon, Sung-Tag Oh
Journal of Korean Powder Metallurgy Institute.2016; 23(4): 303. CrossRef
Synthesis of NiTi Alloy Powder by the Reaction of NiO-TiH2 Mixing Powders



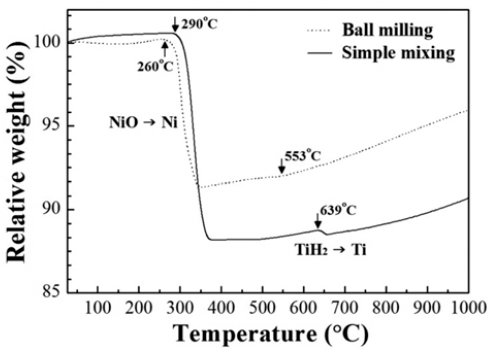

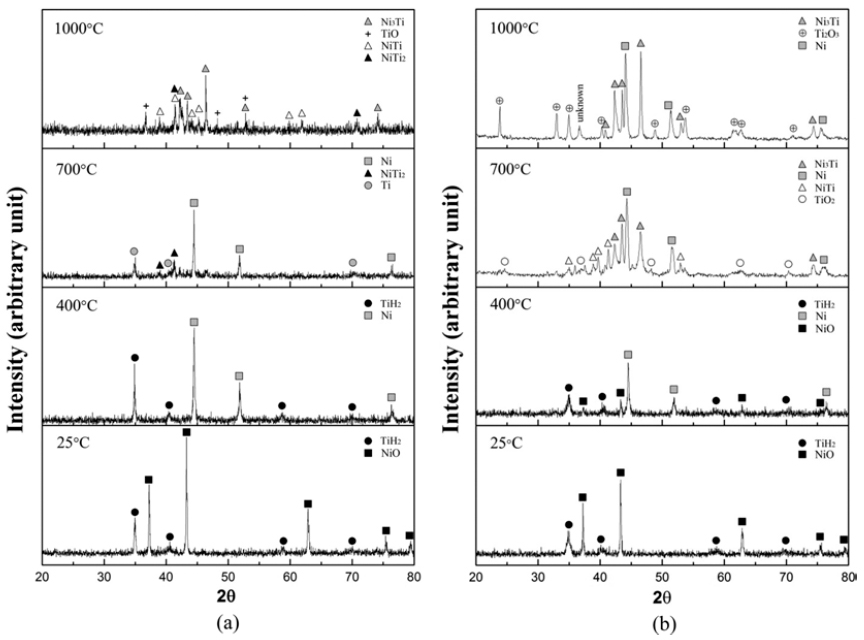
Fig. 1
SEM images of (a) NiO and (b) TiH2 raw powders.
Fig. 2
SEM images of NiO-TiH2 powders by (a) simple mixing for 1 h and (b) ball milling for 24 h.
Fig. 3
SEM microstructure and EDX mapping of ball-milled NiO-TiH2 powder.
Fig. 4
TGA curves for simple-mixed and ball-milled NiOTiH2 powders obtained at a scanning rate of 10°C/min in hydrogen atmosphere.
Fig. 5
SEM images of NiO-TiH2 powders prepared by (a)-(c) simple mixing and (d)-(f) ball milling; heat treatment without holding time at (a) and (d) 400°C, (b) and (e) 700°C, (c) and (f) 1000°C.
Fig. 6
XRD profiles of the powders at different temperatures of heat treatment prepared by (a) simple mixing and (b) ball milling.
Fig. 1
Fig. 2
Fig. 3
Fig. 4
Fig. 5
Fig. 6
Synthesis of NiTi Alloy Powder by the Reaction of NiO-TiH2 Mixing Powders
TOP
 KPMI
KPMI




 Cite this Article
Cite this Article






