Articles
- Page Path
- HOME > J Korean Powder Metall Inst > Volume 23(4); 2016 > Article
-
Article
액중 전기선 폭발법을 이용한 비정질 탄소가 코팅된 주석 나노분말의 제조 및 전기화학적 특성 - 김유영, 송주석a, 조권구a,*
- Fabrication of Carbon-coated Tin Nano-powders by Electrical Wire Explosion in Liquid Media and its Electrochemical Properties
- Yoo-Young Kim, Ju-Suck Songa, Kwon-Koo Choa,*
-
Journal of Korean Powder Metallurgy Institute 2016;23(4):317-324.
DOI: https://doi.org/10.4150/KPMI.2016.23.4.317
Published online: July 31, 2016
경남과학기술대학교 기계공학과
경상대학교 나노신소재융합공학과 & 그린에너지 융합연구소
Dept. of Mechanical Engineering, Gyeongnam National University of Science and Technology, 33, Dongjin-ro, Jinju-si, Gyeongsangnam-do, 52725, Korea
a Dept. of Materials Engineering and Convergence Technology & RIGET, Gyeongsang National University, 501, Jinju-daero, Jinju-si, Gyeongsangnam-do, 52828, Korea
- * Corresponding Author: Kwon-Koo Cho, TEL: +82-55-772-1668, FAX: +82-55-772-1670, E-mail: kkcho66@gnu.ac.kr
• Received: August 2, 2016 • Revised: August 12, 2016 • Accepted: August 15, 2016
© The Korean Powder Metallurgy Institute. All rights reserved.
- 986 Views
- 4 Download
- 2 Crossref
Abstract
- Tin is one of the most promising anode materials for next-generation lithium-ion batteries with a high energy density. However, the commercialization of tin-based anodes is still hindered due to the large volume change (over 260%) upon lithiation/delithiation cycling. To solve the problem, many efforts have been focused on enhancing structural stability of tin particles in electrodes. In this work, we synthesize tin nano-powders with an amorphous carbon layer on the surface and surroundings of the powder by electrical wire explosion in alcohol-based liquid media at room temperature. The morphology and microstructures of the powders are characterized by scanning electron microscopy, Xray diffraction, Raman spectroscopy, and transmission electron microscopy. The electrochemical properties of the powder for use as an anode material for lithium-ion battery are evaluated by cyclic voltammetry and a galvanometric dischargecharge method. It is shown that the carbon-coated tin nano-powders prepared in hexanol media exhibit a high initial charge specific capacity of 902 mAh/g and a high capacity retention of 89% after 50 cycles.
- 리튬이온전지는 현재 가장 많이 상용화 되어 있는 이차 전지이며, 양극활물질로 리튬 전이금속산화물을 그리고 음극활물질로 흑연계 소재를 사용한다. 하지만 이 리튬이 온전지는 소형전지에는 적합하지만 중대형전지에 적용하 기에는 에너지밀도가 낮고 수명이 비교적 짧아 상용화에 어려움이 있다[1,2]. 특히, 현재 상용화되어 있는 음극 활 물질인 그라파이트(graphite)의 이론용량은 372 mAg-1 정 도이며, 이 정도의 이론용량으로는 중·대형전지로 응용 범위를 넓히기는 어렵기 때문에 그라파이트를 대체할 수 있는 높은 에너지밀도와 긴 수명을 갖는 음극재료의 개발 이 시급하다[3].
- 이러한 흑연계 음극소재를 대체하기 위해 현재 많이 연 구되고 있는 대표적인 후보물질로는 Si, Sn, Ge, Al, Sb, SnO2 등이 있다[4-8]. 이 중에서 주석(Sn)은 리튬과의 반 응전위가 낮고 Li4.4Sn을 형성함으로써 1몰당 4.4개의 Li을 저장할 수 있고, 체적당 7246 mAh/cm3 그리고 중량당 992 mAh/g의 고용량을 가지기 때문에 기존 흑연 음극활물 질의 대체 후보물질로 큰 관심을 받고 있다[9]. 그러나 주 석은 이론용량이 매우 높다는 장점이 있지만 충·방전시 리튬과 반응하면서 부피가 약 260%정도 팽창한다는 단점 이 있다. 이러한 부피팽창은 활물질의 균열을 일으키고 이 균열로 인해 활물질이 전기적 단락이 발생하게 되고, 결국 에는 이 전기적 단락으로 고립된 활물질이 전기화학적 반 응에 참여하지 못하게 되기 때문에 사이클 특성 감소로 이어진다[10,11]. 부피팽창으로 발생되는 음극활물질의 균 열은 새로운 계면의 형성을 의미하고 이 계면에서는 리튬 이온과 전해질의 반응으로 전극과 전해질 계면에서 고체 전해질분열간기(solid electrolyte interphase, SEI)층을 형성 하게 된다. 잘 알려진 바와 같이 SEI층은 전지반응에서 리 튬이온의 고갈을 유도하고 저항을 높여 전지의 수명을 단 축시키는 역할을 한다[12]. 즉, 주석분말을 음극물질로 사 용하기 위해서는 충·방전시 전기화학적 반응에 따른 주 석분말의 부피변화를 잘 억제할 수 있어야 한다. 다양한 방법으로 이러한 단점을 보완하기 위한 연구가 진행 중에 있으며, 주석입자 크기의 나노화, 리튬과 반응하는 다중상 합금, 활성/비활성 주석 복합체, 리튬합금/탄소 복합체 등 의 방법들이 주로 검토되고 있다[13-16]. 이 중에서 가장 많이 검토되는 방법은 주석표면을 탄소로 코팅하는 방법 이다. 주석표면에 탄소 코팅을 하는 이유는 리튬과의 반응 시 부피변화에 따라 발생되는 응력 감소, 주석 음극활물질 내의 전기 전도성 개선 그리고 주석분말의 응집 억제 등 의 효과로 전기화학적 특성의 개선을 기대할 수 있기 때 문이다[17,18]. 지금까지 아크방전, 이온빔 스퍼터링, 고온 열처리, 화학기상증착 등 많은 방법으로 주석뿐만 아니라 여러 가지 전극물질에 탄소를 코팅하여 전기화학적특성 평가를 실시하였다[19-21]. 하지만 이러한 제조법은 장치 와 공정이 어렵고 복잡하며 대체적으로 다량의 탄소가 전 극물질에 코팅되기 때문에 전기화학적 특성 평가에서 사 이클 특성은 개선되나 전극물질 대비 탄소의 높은 비율로 이론용량 및 에너지밀도를 낮추는 단점이 있다[22].
- 따라서 본 연구에서는 되도록 간단한 장치와 공정으로 탄소층이 표면 혹은 주위에 전체적으로 형성된 미세한 주 석분말을 제조하고 이를 음극활물질로 적용하여 음극활물 질로써의 가능성을 평가하고자 하였다. 이를 위해 주석분 말의 제조방법으로는 금속나노분말을 제조하는 여러 가지 제조법 중에서 가장 순수한 분말을 얻을 수 있는 방법 중 의 하나로 평가되는 액상 중 전기선폭발법(electrical wire explosion in liquid media)을 선택하였고, 또한 탄소 소스 를 가지고 있는 알코올계 용액에서 주석 와이어를 전기폭 발시킴으로써 폭발시 발생하는 에너지를 이용하여 주석분 말의 표면 혹은 주위에 탄소층을 형성시키고자 하였다. 이 러한 탄소층이 코팅된 주석분말을 음극활물질로 적용하여 전극을 제조하여 전기화학적 특성을 평가하였다.
1. 서 론
- 2.1. 탄소 코팅된 주석 나노분말 제조 및 특성분석
- 본 연구에서는 전기선폭발장치(Nano technology Inc., NTi 20)를 이용하여 주석 나노분말을 제조하였다. 또한 주석와이 어의 전기선폭발은 3 가지 알코올 용매(메탄올[methanol- CH3OH], 에탄올[ethanol-C2H5OH], 헥산올[hexanol-C6H13OH]) 에서 실시하였다. 직경 0.3 mm의 고순도(>99%) 주석 와이 어를 사용하였으며, 주석 와이어에 순간적인 전기에너지 를 가하기 위하여 1.5 kV의 인가전압을 가하였다. 1회당 폭발되는 주석 와이어의 길이(전극간격)는 12 mm였고, 분 당 6회의 속도로 1000회 실시하여 나노 콜로이드를 제조 하였다. 제조된 각 용액별 나노 콜로이드는 에탄올을 이용 해 3회 세척하였고, 60°C의 오븐(Oven)에서 건조하여 최 종 나노분말를 얻었다.
- 제조된 주석 입자의 입도와 형상을 분석하기 위하여 전 계방출형주사전자현미경(field emission scanning electron microscopy, FE-SEM; Philips, XL30 S FEG)을 이용하였 고, 주석 입자 주위에 탄소층이 형성되었는지 그리고 주석 분말과 탄소층의 결정성 등을 관찰하기 위하여 전계방출 형투과전자현미경(field emission transmission electron microscopy, FE-TEM; TECNAI, TF30 ST)을 이용하였다. 또한 제조된 주석분말의 결정구조를 조사하기 위하여 Cu- Kα 파장 1.542Å의 타켓을 이용한 X-선 회절장치(X-ray diffraction, XRD; Bruker, DE/D2 PHASER)를 사용하였으 며, 514.5 nm의 Ar ion 레이저를 이용한 라만분광법(Raman spectroscopy; Lab RAM HR800 UV)을 이용하여 탄소코팅 된 주석의 결정질과 비정질 탄소를 상대적으로 비교 분석하 고 코팅층 내에 존재 할 수 있는 비정질 산화막의 유무를 분석하였다. 제조된 주석분말내에 존재하는 주석, 탄소 그 리고 수소 등의 함량을 분석하기 위해 열무게측정분석 (thermogravimetric analysis, TGA; TA Inc., Q600,)과 원소 분석(elemental analyzer, EA; Thermo Scientific, Flash 2000)을 실시하였다.
- 2.2. 전극 제조 및 전기화학적 특성평가
- 주석전극을 제조하기 위하여 활물질과 도전재인 Super- P 카본블랙(carbon black) 그리고 에탄올(ethanol)에 용해 시킨 PAA(polyacrylic acid, Mw ~450,000, Aldrich) 바인 더를 60 wt% : 20 wt% : 20 wt%의 비율로 혼합한 후 유성 형 볼밀기(planetary ball mill machine)에 넣어 기계적 교반 으로 슬러리를 제조하였다. 슬러리는 집전체 역할을 하는 구리호일(copper foil)에 0.1 mm의 두께로 도포하여 24시간 동안 60°C의 오븐에서 건조하였다. 에탄올과 헥산올 용매에 서 제조한 주석분말을 적용하여 제조한 전극의 전극밀도는 각각 5.44 g/cm3과 5.24 g/cm3이었다. 전해질은 EC(ethylene cabonate, Wellcos)와 DEC(diethyl carbonate, Wellcos)를 1:1 의 부피비의 용액에 1 M의 LiPF6(lithium hexafluorophosphate, Wellcos)의 전해염과 5 wt% FEC(fluoroethylene carbonate, Aldrich)를 첨가하여 사용하였다. 분리막은 PP(polypropylene) 소재의 Celgard 2400을 사용하였다. 전지 제조의 모든 과 정은 Ar 기체로 채워진 글러브박스에서 진행되었으며 코 인셀(2032 coin type cell)의 전지가 사용되었다. 전지는 리튬 금속/전해질/분리막/전해질/주석전극 순으로 조립하였다. 주 석전극의 충·방전시 산화·환원에 의한 전기 화학적인 거 동 및 원료분말의 전기화학적 특성을 확인하기 위하여 전압 범위 0.001 V ~ 3.0 V 그리고 주사속도 0.2 mV/s로 순환전압 전류법(cyclic voltammetry, CV)분석을 실시하였으며, 전류 밀도 0.2C의 정전류(galvanostic mode)방법 그리고 종지전압 (cut-off voltage) 0.001 V~2.5 V 구간에서 전기화학적특성을 평가하였다. 또한 0.2C, 0.5C, 1C, 2C의 다양한 C-rate로 0.001 V~2.5 V 구간에서 전극의 율속특성을 평가하였다. 모 든 전지의 실험은 상온에서 실시하였다.
2. 실험방법
- 실험에서 사용한 세 가지 알코올계 용매는 메탄올 (methanol-CH3OH, 에탄올(ethanol-C2H5OH), 그리고 헥산 올(hexanol-C6H13OH)이며, 각 분자식에서 볼 수 있듯이 탄 화수소(C-H)의 함량이 서로 다르다. 즉, 배열된 순서에 따 라 탄화수소의 함량이 증가한다. 본 연구에서는 액상 중 전기선폭발법과 탄화수소의 함량이 서로 다른 세 가지 용 매를 적용하여 표면에 탄소가 코팅된 순수한 주석 나노분 말을 제조하고자 하였으며, 또한 이 분말을 음극활물질로 적용하여 전기화학적 특성을 개선하고자 하였다.
- 그림 1은 세 가지 용매에서 제조된 주석분말과 주석분 말 표면 혹은 주위에 형성된 탄소층을 보여주는 FE-SEM 과 FE-TEM 결과이다. 그림 1의 (a), (b) 그리고 (c)는 각 각 메탄올, 에탄올 그리고 헥산올 용매에서 얻어진 FESEM( 위)과 FE-TEM(아래)의 결과이다. 그림 1(a)~(c)에서 볼 수 있듯이 세 가지 용매에서 모두 구형의 주석 나노분 말이 잘 형성되었다는 것을 알 수 있었으며, 분말의 크기는 메탄올, 에탄올 그리고 헥산올 용매에서 각각 50~150 nm, 50~100 nm 그리고 30~50 nm 급이었다. 즉, 탄화수소의 량이 증가할수록 분말의 크기가 점점 작아졌을 뿐만 아니라 분말 크기의 분포도 점점 균일해지는 것을 알 수 있었다. 그림 1(d-f)는 그림 1(c) 즉 헥산올 용매에서 얻은 주석 나노분 말과 그 주위를 고배율로 관찰한 FE-TEM결과이다. 화살 표로 표시된 것처럼 주석 나노분말 주위에는 탄소층이 존 재하였다. 이러한 탄소층은 액상 중 전기선폭발법으로 나 노입자가 제조되는 과정에서 용매에 존재하는 많은 탄화 수소가 주석 나노입자와 함께 순간적으로 고온에서 반응 하여 주석입자 표면에 형성되는 것으로 알려져 있다[23]. 탄소층은 그림 1(d)와 (e)에 화살표로 나타낸 것처럼 주석 입자의 기지(matrix) 형태로 존재하는 것과 그림 1(f)에 나 타낸 것처럼 주석입자 주위에 코팅층으로 존재하는 두 가 지 형태로 구분할 수 있었다. 이때 코팅된 탄소층의 두께 는 대략 5 nm정도였다(그림 1(f)). 이러한 두 가지 탄소층 의 결정화 정도를 FE-TEM으로 세밀히 관찰한 결과 부분 적으로 결정성을 가지는 그라파이트의 격자선(lattice line) 이 관찰되었으나 전체적으로는 비정질이었다. 이러한 두 가지 형태의 탄소층은 리튬과 주석의 전기화학반응시 주 석의 부피변화로 발생되는 응력을 감소시키고 또한 음극 활물질 내의 전기 전도성을 개선하여 전기화학적 특성을 향상시킬 수 있을 것으로 기대된다. 본 논문에서는 탄소층 이 주석 나노입자의 표면과 주위에 동시에 존재하였기 때 문에 이 탄소층을 “Sn@C 코아-셀 복합체 분말”이라 명명 하였다. 탄소 코팅층은 메탄올과 에탄올 용매에서도 부분적 으로 관찰되었으나 헥산올 용매에서의 결과처럼 주석 나노 분말을 전체적으로 감싸는 탄소층은 관찰되지 않았다. 주석 입자의 크기가 메탄올이나 에탄올의 용매에서 보다 헥산 올 용매에서 급격히 작아지는 것도 헥산올 용매에서 제조 된 주석입자의 표면과 주위에 형성된 탄소층이 전기선 폭 발과정에서 주석 나노입자의 성장을 방해하기 때문이라 판단된다[23,24].
- 그림 2(a)와 (b)는 헥산올 용매에서 제조된 주석 나노분 말의 XRD와 라만 분석결과이다. 이 결과들로부터 두 탄 소층이 결정성을 갖는지 혹은 다른 부가적인 생성물(예, 주석산화물 등)이 형성되는지를 평가할 수 있다. 일반적으 로 주석 혹은 금속 나노분말의 표면이나 주위에 형성된 탄소층이 높은 결정성을 가질 경우 XRD결과에 명확히 흑 연 회절픽이 관찰된다[25]. 하지만 그림 2(a)에서 볼 수 있 듯이 측정된 결과에서 나타난 모든 회절픽의 값들은 JCPDS카드 No. 04-0673의 β-주석과 정확히 일치하였으며, 주석 회절픽을 제외한 다른 회절픽은 전혀 관찰되지 않았 다. 이는 높은 결정성을 갖는 순수한 주석입자만이 형성되 었다는 것을 의미한다. 본 논문에는 나타내지 않았지만 메 탄올과 에탄올에서 제조된 주석 나노분말도 그림 2(a)와 거의 똑 같은 XRD결과를 보였다. 그림 2(b)는 라만 분석 결과로서 1583 cm-1 근처에서 관찰되는 픽을 G-band라고 하고 결정성 탄소를 의미하며, 1327 cm-1 근처에서 관찰되 는 픽을 D-band라 하고 비정질 탄소를 의미한다. 즉, 두 픽의 강도 비(IG/ID)를 비교하여 결정화 정도를 나타낼 수 있다. 그림 2(b)에서 볼 수 있듯이 D-와 G-band의 강도가 비슷하다는 것은 주석입자의 표면이나 주위에 형성된 탄 소층이 일부 결정성을 가지지만 비정질 특성이 더욱 높다 는 것을 의미한다. 한편, 618 cm-1 부근에서 관찰되는 화살 표로 표기된 픽은 A1g픽이라고 하며 주석산화물(SnO2)과 관련된 픽이다. 그림에서 볼 수 있듯이 픽의 강도가 매우 낮고 또한 FE-TEM관찰과 XRD결과에서 주석산화물이 관 찰되지 않은 것으로 볼 때 아주 소량의 주석산화물이 형 성되었다고 볼 수 있다. 하지만 본 연구의 결과로는 그 주 석산화물이 주석입자의 어느 위치에 존재하는지 관찰할 수 없었다.
- 이상의 실험결과를 종합해 보면, 주석산화물이 극히 미 량 존재한다고 볼 수 있지만 입자의 크기 분포가 우수하 고(30~50 nm) 입자 주위에 두 종류의 비정질 탄소층을 가 진 순도와 결정성이 높은 주석 나노분말(Sn@C 코아-셀 복합체 분말)이 헥산올 용매에서의 전기선폭발법으로 성 공적으로 합성되었다고 할 수 있다. 이러한 주석 나노분말 의 특징은 본 연구의 출발에서 의도한 분말형상과 매우 유사하다고 할 수 있다.
- 제조된 주석 나노분말의 전기화학적 특성평가는 분말 주위에 탄소층이 전체적으로 잘 형성되어 있는 헥산올 용 매에서 제조된 Sn@C 코아-셀 복합체 분말 위주로 이루어 졌고, 또한 전기화학적 특성에 미치는 탄소층의 효과를 알 아보기 위해 탄소층이 전체적으로 잘 형성되지 않은 에탄 올에서 제조된 주석 나노분말을 평가하였다. 그런데 그림 1(b)와 (c)에서 볼 수 있듯이 에탄올과 헥산올 용매에서 제 조된 주석분말의 크기에는 다소 차이가 있으며, 이러한 크 기 차이는 전기화학적 특성에 영향을 줄 수 있다. 따라서 본 연구에서는 두 분말의 크기 차이를 최소화 하기 위해 분말크기가 큰 에탄올 용매에서 제조된 주석분말에 대해 10분간 몇 가지 속도록 원심분리를 실시하였다. 그림 3의 주석분말은 에탄올 용매에서 제조된 주석분말을 4000 rpm 에서 10분간 원심분리를 실시한 결과이다. 그림에서 볼 수 있듯이 분말의 크기는 30~60 nm급 크기로 그림 1(c)에서 보여준 헥산올 용매에서 제조한 나노분말의 크기분포와 매우 유사하였고 따라서 두 주석분말의 전기화학적 특성 을 비교하는데 크기의 영향은 배제할 수 있다고 판단된다.
- 전기화학적 특성을 정확히 평가하기 위해서는 전극 제 조시 사용한 활물질의 양을 최대한 정확히 알아야 한다. 즉, 본 연구에서는 액상 중 전기선폭발법으로 제조된 주석 나노분말에 존재하는 순수한 주석의 량이 얼마인지 정확 히 알아야 한다. 하지만 제조된 주석 나노분말에는 순수한 주석 외에 탄소, 산소, 수소 그리고 주석산화물이 존재하 기 때문에 각 물질의 함량 평가가 필요하다. 본 연구에서 는 가장 일반적으로 많이 적용하는 Yunhua Xu 등이 제시 한 열무게측정분석(TGA)과 원소분석(EA)으로 평가하는 방법을 적용하였다[22]. 그림 4는 헥산올 용매에서 제조한 Sn@C 코아-셀 복합체 분말의 열무게측정분석과 원소분석 의 결과이다. 그림 4의 TGA 곡선은 220°C도에서 800°C까 지 꾸준히 무게가 증가하는 경향을 보였으며, 최종적으로 는 처음 무게 대비 117.9%가 증가하였다. 이는 순수 금속 주석이 산화되면서(Sn + O2 → SnO2) 무게가 증가하는 것 과 400°C에서 550°C 사이의 곡선의 기울기 변화에서 알 수 있듯이 주석 나노분말 주위의 탄소가 산소와 반응하여 (C + O2 → CO2) 기화되면서 무게가 감소하는 것이 반영 된 결과이다. 이 TGA분석 결과를 바탕으로 아래의 식을 이용하여 TGA분석에 사용된 Sn@C 코아-셀 복합체 분말 에 존재하는 순수 금속 주석의 함량을 계산하였다[22].
- 상기의 식을 이용하여 순수 주석 함량을 계산하면 92.86%(Sn(wt%) = 100 × (118.71/150.71) × (1.179/1)=92.86%≈ 93%)이다. 그림 4의 TGA 결과 내에 나타낸 표는 원소분 석을 통해 얻은 결과로서 탄소의 함량이 대략 5%이고 기 타 수소와 질소는 극히 미량이거나 존재하지 않는 것으로 나타났다. TGA 분석결과와 원소분석 결과를 종합해 보면 Sn@C 코아-셀 복합체 분말에는 순수 주석의 함량이 93%, 탄소가 5% 그리고 산소가 2% 정도 존재하는 것으로 분 석된다. 이때 산소는 주석산화물의 형태로 존재하는 것으 로 판단된다. 이와 같은 방법을 그림 3에 나타낸 에탄올 용매에서 제조된 주석 나노분말에 적용한 결과 순수 주석 의 함량이 98%, 탄소가 1.8% 그리고 기타 원소들(산소, 수소 등)이 0.2% 존재하는 것으로 분석되었다. 이러한 각 물질의 함량은 전기화학적 특성 분석에 필요한 기초 데이 터로 사용되었다.
- 그림 5(a), (b) 그리고 (d)는 그림 1(c)에서 보여준 헥산 올 용매에서 제조된 Sn@C 코아-셀 복합체 분말을 음극활 물질로 적용한 전극의 전기화학적 특성이고 그림 5(c)는 헥 산올 용매와 그림 3에서 보여준 에탄올 용매에서 제조한 두 주석 나노분말의 전지 수명특성을 비교한 결과이다. 그 림 5(a)는 0.001~3.0 V 사이에서 0.2 mV/s의 주사속도로 CV특성을 분석한 결과이다. 아래 쪽 곡선에 화살표로 표 시된 3개의 픽은 LixSn합금을 형성하기 위해 주석분말로 리튬이 삽입되는 반응이고 위쪽에 표시된 3개의 픽은 LixSn합금에서 리튬이 탈리되는 반응을 나타내며 이 결과 는 기존의 결과와 잘 일치한다[26-28]. 첫 번째와 두 번째 사이클 곡선은 약간의 차이를 보이는데 이는 SEI층 형성 을 위한 전해질의 분해에 기인한 것이다. 첫 번째 사이클 을 제외하고는 전반적으로 화살표로 표시된 전류의 강도 가 일정하며, 이것은 음극 활물질로 적용한 Sn@C 코아- 셀 복합체 분말이 전지의 사이클 안정성에 좋은 기여를 한다는 것을 의미한다. 그림 5(b)는 0.2C의 정전류방법으 로 0.001~2.5 V 전압구간에서 측정한 충방전곡선(chargedischarge curve)이다. 첫 번째 방전용량은 1215 mAh/g이 었고 두 번째 방전용량은 933 mAh/g으로 282 mAh/g의 용 량이 감소하였다. 이러한 용량감소는 SEI 막의 형성에 기 인한 것으로 판단된다. 첫 번째 사이클 이후에는 좋은 사 이클 안정성을 의미하는 용량감소 없이 반복적인 충방전 곡선을 나타내었다. 그림 5(c)는 헥산올과 에탄올 용매에 서 제조한 주석 나노분말을 음극활물질로 사용한 전극의 사이클 거동을 나타낸 결과이며 전기화학특성 평가 실험 조건은 그림 5(b)와 동일하다. 헥산올 용매에서 제조된 Sn@C 코아-셀 복합체 분말을 음극 활물질로 적용한 전극 의 사이클 거동은 초기 충전용량은 902 mAh/g였으며 이 용량은 30사이클까지 안정적으로 유지되었다. 30 사이클 이후에 조금씩 감소하였으나 50 사이클 후에도 높은 충전 용량(802 mAh/g)을 유지하였으며, 89%의 높은 용량 유지 율을 보였다. 또한 50 사이클 후의 충전용량은 주석의 이 론용량(992 mAh/g)의 81%에 해당하는 매우 우수한 값이 다. 반면, 에탄올 용매에서 제조된 주석 나노분말의 사이 클 거동은 초기 충전용량과 50 사이클 후 충전용량이 각 각 857 mAh/g와 334 mAh/g로 용량 유지율이 단지 39%에 불과했다. 또한 그림에서 볼 수 있듯이 대략 12 사이클까 지는 초기 충전용량을 유지하였으나 이후에 급격히 감소 하는 매우 좋지 않은 사이클 거동을 보였다. 그림 5(d)는 헥산올 용매에서 제조한 주석 나노분말의 율속특성을 평 가한 것으로 0.2C, 0.5C, 1C, 2C 그리고 다시 0.2C 순으 로 5 사이클마다 변화를 주었다. 율속이 높아질수록 충전 용량이 조금씩 낮아졌으나 다시 처음의 율속(0.2C)으로 평 가하였을 때는 거의 처음 용량 수준으로 회복하는 매우 우수한 율속특성을 보였다.
3. 결과 및 고찰
Fig. 1

FE-SEM and FE-TEM images of Sn nano-sized powders produced by using electrical Sn wire explosion in (a) methanol, (b) ethanol, and (c) hexanol media. (d), (e), and (f) are high resolution FE-TEM images showing carbon layers of Sn nano-sized powders shown in Fig. 1(c). The Sn nano-sized powders shown in Fig. 1(c)~(f) is named as a “Sn@C core-shell composite powder”

Fig. 2

(a) X-ray diffraction spectrum and (b) Raman spectroscopy of Sn@C core-shell composite powder shown in Fig. 1(c)~(f).

Fig. 3

FE-TEM image of powder obtained during a centrifugation with a suspension of Sn nano-sized powder fabricated in ethanol media (shown in Fig. 1(b)). Centrifugation was conducted for 10 min at 4000 rpm.

Fig. 4

TGA curve of Sn@C core-shell composite powder shown in Fig. 1(c). Insert table is result of elementary analysis.

Fig. 5

(a) Cycle voltammograms and (b) charge-discharge profiles of Sn@C core-shell composite powder electrodes, (c) electrochemical cycling performance of electrodes prepared in ethanol (Sn nano-sized powder) and hexanol (Sn@C core-shell composite powder), and (d) rate capability of Sn@C core-shell composite powder electrode cycled at various current densities.

- 본 연구에서는 헥산올 용매를 사용한 액상 중 전기선폭 발법으로 주석 나노분말 표면과 주위에 탄소층을 가진 Sn@C 코아-셀 복합체 분말을 성공적으로 합성하였으며, 이를 리튬이온배터리의 음극 활물질로 사용하여 전기화학 적 특성을 평가하였다. 이 복합체 분말의 초기 방전과 충 전용량은 1215 mAh/g과 902 mAh/g으로 매우 우수한 특 성을 보였으며, 50 사이클 후의 충전용량은 802 mAh/g로 89%에 해당하는 높은 용량 유지율 즉, 사이클 안정성을 보였다. 0.2C, 0.5C, 1C, 2C 그리고 다시 0.2C에서 평가된 율속특성은 용량감소가 거의 없는 우수한 율속특성을 보 였다. 이러한 Sn@C 코아-셀 복합체 분말의 우수한 전기 화학적 특성은 주석 나노분말의 표면과 주위에 형성된 탄 소층이 충전과 방전 과정에서 나타나는 주석의 큰 부피변 화를 잘 수용할 뿐만 아니라 응력을 완화시키고 그리고 주석분말이 깨어지는 것을 효과적으로 억제해 주는 역할 을 하기 때문인 것으로 판단된다. 실험에서 사용한 3가지 알코올계 용매에서는 용매의 분자식에 탄화수소(C-H)의 함량이 높을수록 주석입자의 크기도 작아졌고 탄소층도 잘 형성되었다.
4. 결 론
-
Acknowledgements
- 이 연구는 2014년도 경남과학기술대학교 기성회 연구비 지원에 의하여 수행되었음에 감사드립니다.
감사의 글
- 1. G.G. Harding: J. Power Sources, 78 (1999) 193. .Article
- 2. Hong Li, Zhaoxiang Wang, Liquan Chen and Xuejie Huang: Adv. Mater., 21 (2009) 4593. .Article
- 3. Yunhua Xu, Yujie Zhu, Yihang Liu and Chunsheng Wang: Adv. Energy Mater., 3 (2013) 128. .Article
- 4. Duc Tung Ngo, Ramchandra S. Kalubarme, Hang T. T. Le, John G. Fisher, Choong-Nyeon Park, Il-Doo Kim and Chan-Jin Park: Adv. Funct. Mater., 24 (2014) 5291. .Article
- 5. Masaki Yoshio, Takaaki Tsumura and Nikolay Dimov: J. Power Sources, 146 (2005) 10. .Article
- 6. Martin Winter and Jurgen O. Besenhard: Electrochim. Acta, 45 (1999) 31. .Article
- 7. Meng-Chang Lin, Ming Gong, Bingan Lu, Yingpeng Wu, Di-Yan Wang, Mingyun Guan, Michael Angell, Changxin Chen, Jiang Yang, Bing-Joe Hwang and Hongjie Dai: NATURE, 520 (2015) 324. .ArticlePubMed
- 8. Vilas G. Pol, Jianguo Wen, Dean J. Miller and Michael M. Thackeray: J. Electrochem. Soc., 161 (2014) A777. .Article
- 9. Eiji Hosono, Hirofumi Matsuda, Itaru Honma, Masaki Ichihara and Haoshen Zhou: J. Electrochem. Soc., 154 (2007) A146. .Article
- 10. Mario Wachtler, Jrgen O. Besenhard and Martin Winter: J. Power Sources, 94 (2001) 189. .Article
- 11. Jiangwei Wang, Feifei Fan, Yang Liu, Katherine L. Jungjohann, Seung Woo Lee, Scott X. Mao, Xiaohua Liu and Ting Zhu: J. Electrochem. Soc., 161 (2014) F3019. .Article
- 12. Kwang Sup Eom, JaehanJung, Jung Tae Lee, Valentin- Lair, TapeshJoshi, Seung Woo Lee, ZhiqunLin and Thomas. F. Fuller: Nano Energy, 12 (2015) 314. .Article
- 13. Zhiqiang Zhu, Shiwen Wang, Jing Du, Qi Jin, Tianran Zhang, Fangyi Cheng and Jun Chen: Nano Lett., 14 (2014) 153. .ArticlePubMed
- 14. J. Read, D. Foster, J. Wolfenstine and W. Behl: J. Power Sources, 96 (2001) 277. .Article
- 15. Yangang Wang, Bo Li, Chengli Zhang, Hong Tao, Shifei Kang, Sheng Jiang and Xi Li: J. Power Sources, 219 (2012) 89. .Article
- 16. Xiulin Fan, Jie Shao, Xuezhang Xiao, Xinhu Wang, Shouquan Li, Hongwei Ge and Lixin Chenn: Nano Energy, 9 (2014) 196. .Article
- 17. Chun-jing Liu, Hao Huang, Guo-zhong Cao, Fang-hong Xue, Ramon Alberto Paredes Camacho and Xing-long Dong: Electrochim. Acta, 144 (2014) 376. .Article
- 18. Jusef Hassoun, Gaelle Derrien, Stefania Panero and Bruno Scrosati: Adv. Mater., 20 (2008) 3169. .Article
- 19. Meng Wu, Xiaowei Li, Qun Zhou, Hai Ming, Jason Adkins and Junwei Zheng: Electrochim. Acta, 123 (2014) 144. .Article
- 20. Il-seok Kim, G. E. Blomgren and P. N. Kumtaa: Electrochem. Solid-State Lett., 7 (2004) A44. .Article
- 21. M. Marcinek, L.J. Hardwick, T.J. Richardson, X. Song and R. Kostecki: J. Power Sources, 173 (2007) 965. .Article
- 22. Yunhua Xu, Qing Liu, Yujie Zhu, Yihang Liu, Alex Langrock, Michael R. Zachariah and Chunsheng Wang: Nano Lett., 13 (2013) 470. .ArticlePubMed
- 23. Duk-Hee Lee, Hyun-Woo Shim, Jae-Chan Kim and Dong-Wan Kim: RSC Adv., 4 (2014) 44563. .Article
- 24. S. H. Jun, Y. R. Uhm and C. K. Rhee: J. Korean Powder Metall. Inst., 17 (2010) 295. .Article
- 25. Yan Wang, Zengsheng Ma and Chunsheng Lu: Compos. Interfaces, 23 (2016) 273. .Article
- 26. K. T. Lee, Y. S. Jung and S. M. Oh: J. Am. Chem. Soc., 125 (2003) 5652. .ArticlePubMed
- 27. I. A. Courtney and J. R. Dahn: J. Electrochem. Soc., 144 (1997) 2045. .Article
- 28. Y. Xu. Q. Liu, Y. Zhu, Y. Liu, A. Langrock, M. R. Zachariah and C. Wang: Nano Lett., 13 (2013) 470..ArticlePubMed
Figure & Data
References
Citations
Citations to this article as recorded by 

- Optimization of carbon coating thickness to prevent crack generation in Sn nanoparticles during charge/discharge process and their electrochemical properties
Ji-Seub Choi, Yeon-Ju Lee, Hoi-Jin Lee, Gyu-Bong Cho, Jai-Won Byeon, Hyo-Jun Ahn, Ki-Won Kim, Jou-Hyeon Ahn, Kwon-Koo Cho
Journal of Alloys and Compounds.2020; 843: 155892. CrossRef - Fabrication of multilayer graphene-encapsulated Sn/SnO2 nanocomposite as an anode material for lithium-ion batteries and its electrochemical properties
Ju-Seok Song, Gyu-Bong Cho, Ki-Won Kim, Hyo-Jun Ahn, Hye-Sung Kim, Jou-Hyeon Ahn, Kwon-Koo Cho
Applied Surface Science.2019; 481: 736. CrossRef
Fabrication of Carbon-coated Tin Nano-powders by Electrical Wire Explosion in Liquid Media and its Electrochemical Properties
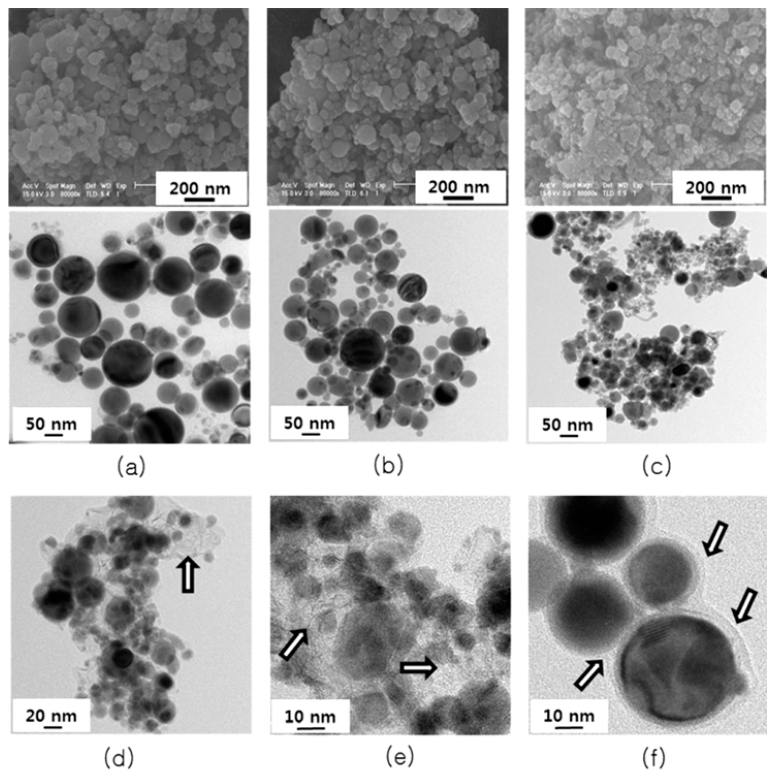




Fig. 1
FE-SEM and FE-TEM images of Sn nano-sized powders produced by using electrical Sn wire explosion in (a) methanol, (b) ethanol, and (c) hexanol media. (d), (e), and (f) are high resolution FE-TEM images showing carbon layers of Sn nano-sized powders shown in Fig. 1(c). The Sn nano-sized powders shown in Fig. 1(c)~(f) is named as a “Sn@C core-shell composite powder”
Fig. 2
(a) X-ray diffraction spectrum and (b) Raman spectroscopy of Sn@C core-shell composite powder shown in Fig. 1(c)~(f).
Fig. 3
FE-TEM image of powder obtained during a centrifugation with a suspension of Sn nano-sized powder fabricated in ethanol media (shown in Fig. 1(b)). Centrifugation was conducted for 10 min at 4000 rpm.
Fig. 4
TGA curve of Sn@C core-shell composite powder shown in Fig. 1(c). Insert table is result of elementary analysis.
Fig. 5
(a) Cycle voltammograms and (b) charge-discharge profiles of Sn@C core-shell composite powder electrodes, (c) electrochemical cycling performance of electrodes prepared in ethanol (Sn nano-sized powder) and hexanol (Sn@C core-shell composite powder), and (d) rate capability of Sn@C core-shell composite powder electrode cycled at various current densities.
Fig. 1
Fig. 2
Fig. 3
Fig. 4
Fig. 5
Fabrication of Carbon-coated Tin Nano-powders by Electrical Wire Explosion in Liquid Media and its Electrochemical Properties
TOP
 KPMI
KPMI

 Cite this Article
Cite this Article





