Articles
- Page Path
- HOME > J Korean Powder Metall Inst > Volume 23(5); 2016 > Article
-
Article
WC/Co 초경합금 가공 슬러지로부터 알칼리침출 정련공정에 의한 W 회수 - 이길근*, 권지은
- Recovery of Tungsten from WC/Co Hardmetal Sludge by Alkaline Leaching Hydrometallurgy Process
- Gil-Geun Lee*, Ji-Eun Kwon
-
Journal of Korean Powder Metallurgy Institute 2016;23(5):372-378.
DOI: https://doi.org/10.4150/KPMI.2016.23.5.372
Published online: September 30, 2016
부경대학교 신소재시스템공학과
Department of Materials System Engineering, College of Engineering, Pukyong National University, 365 Sinseon-ro, Nam-gu, Busan, 48547, Korea
- * Corresponding Author: Gil-Geun Lee, TEL: +82--51-629-6381, FAX: +82-51-629-6373, E-mail: gglee@pknu.ac.kr
• Received: September 12, 2016 • Revised: September 30, 2016 • Accepted: October 3, 2016
© The Korean Powder Metallurgy Institute. All rights reserved.
- 837 Views
- 3 Download
- 1 Crossref
Abstract
- This study focuses on the development of an alkaline leaching hydrometallurgy process for the recovery of tungsten from WC/Co hardmetal sludge, and an examination of the effect of the process parameters on tungsten recovery. The alkaline leaching hydrometallurgy process has four stages, i.e., oxidation of the sludge, leaching of tungsten by NaOH, refinement of the leaching solution, and precipitation of tungsten. The WC/Co hardmetal sludge oxide consists of WO3 and CoWO4. The leaching of tungsten is most affected by the leaching temperature, followed by the NaOH concentration and the leaching time. About 99% of tungsten in the WC/Co hardmetal sludge is leached at temperatures above 90°C and a NaOH concentration above 15%. For refinement of the leaching solution, pH control of the solution using HCl is more effective than the addition of Na2S·9H2O. The tungsten is precipitated as high-purity H2WO4·H2O by pH control using HCl. With decreasing pH of the solution, the tungsten recovery rate increases and then decrease. About 93% of tungsten in the WC/Co hardmetal sludge is recovered by the alkaline leaching hydrometallurgy process.
- WC/Co 초경합금은 경도가 높고 내마모성이 우수하여, 공구 및 금형소재로 널리 사용되고 있다[1]. WC/Co 초경 합금을 구성하는 원소인 W과 Co는 지구 지각의 일부 지 역에 편중되어 분포하고, 매장량 또한 한정되어 있다[2]. 따라서 W과 Co는 전략소재로 인식되어, WC/Co 초경합 금으로부터 희소금속인 W과 Co를 회수하기 위한 기술개 발이 진행되고 있다. WC/Co 초경합금의 재자원화기술은 크게 건식법과 습식법으로 나눌 수 있다[4].
- 건식법은 아연처리법(zinc process)[3,4], 저온분쇄법 (cold stream process)[5] 등이 있다. 이들 건식법은 공정이 단순하고 공정비용이 저가인 장점이 있으나, 이들 방법을 통하여 재자원화된 WC/Co 분말은 품위가 낮아 사용 용도 에 제한이 있어 왔다. 이러한 단점을 보완하기 위하여 저 자 등은 새로운 산화/기계적밀링/환원/침탄법(oxidationmechanical milling-carbothermal reduction process)을 개발 하였다[6,7]. 이 방법은 종래의 건식법들과는 달리 WC/Co 초경합금 제조에 바로 사용할 수 있는 고품위의 WC/Co 복합분말을 회수할 수 있다. 그러나 회수되는 원소들의 형 태가 WC/Co 복합체 형태로, 회수되는 원소들의 활용이 WC/Co 초경합금에 제한되는 단점이 있다. 따라서 회수되 는 원소들의 활용도를 높이기 위해서는, W과 Co 성분을 분리하여 각각을 회수할 수 있는 습식 공정기술에 대한 검토가 필요하다.
- 습식법은 정련법(hydrometallurgy process)[8-14], 전해 법(electrolysis process)[15,16], 정련-전해법(combined hydrothermal and electrolysis process)[17] 등이 개발되어 있다. 이들 습식법은 W과 Co 성분의 분리가 가능하고, W 과 Co를 다양한 형태(순수금속, 화합물 등)로 순도 높게 회수할 수 있는 장점이 있으나, 건식법에 비하여 공정비용 이 비싸고 환경에 부담이 큰 것이 단점으로 지적되고 있 다. 전술한 습식법들 중에서 상대적으로 공정비용과 환경 부담비용이 작은 것은 알칼리침출을 이용한 정련법으로 알려져 있다[11,12]. 알칼리침출 정련법은 W과 Co 성분을 분리하기 위하여, 고농도의 산용액을 사용하는 산침출법 과 달리 저농도의 알칼리용액을 사용하여 W 성분을 침출 시키므로 환경부담이 작을 뿐만 아니라 부가적인 에너지(전 기에너지, 기계에너지 등)를 사용하지 않아 공정비용 부담 이 작다. 알칼리 침출 후 이온교환수지법을 이용하여 W 성분을 APT 형태로 회수하는 기술이 보고되고 있으나, 이 경우에는 공정이 복잡하고 중화제, 박리액 등 추가적인 화 학종이 요구되는 단점이 있다[11,13]. 이를 극복하기 위해 알칼리 침출 후 이온교환수지법을 사용하지 않고 W 성분 을 회수하고자 하는 연구들이 일부 시도되고 있으나, 공정 변수의 영향에 대해서는 구체적으로 보고되고 있지 않다 [12,14].
- 한편 전술한 WC/Co 초경합금 재자원화 기술은 대부분 벌크 형태의 초경 스크랩을 대상으로 하여 보고되고 있다. 일반적으로 분말야금 공정에 의해 제조된 벌크형태의 WC/Co 초경합금은 산업현장에서의 사용을 위해 다양한 형태로 기계 가공을 하게 된다. 기계가공 중에 많은 양의 가공 슬러지가 생기게 되고, 이들 가공 슬러지로부터 W과 Co 성분을 회수할 수 있는 재자원화기술의 개발이 필요하 다. 본 연구에서는 WC/Co 초경합금 가공 슬러지로부터 W의 회수가 가능한 알칼리침출 정련법을 개발하고, W 회 수에 미치는 공정변수의 영향을 검토하고자 한다.
1. 서 론
- 초기원료로는 벌크형태의 WC/Co 초경합금을 기계 가 공할 때 발생하는 가공 슬러지를 사용하였다. 기계가공 절 삭유가 포함된 가공슬러지를 헥산을 이용하여 상온에서 세척 건조하여, 절삭유 성분이 제거된 슬러지분말을 얻었 다. 절삭유 성분이 제거된 슬러지 분말을 900°C의 대기 분 위기에서 12시간 동안 산화시켜, 산화물분말을 제조하였 다. 산화물분말과 NaOH 수용액을 환류응축기가 부착된 용 기에 장입하여 산화물분말 중의 W 성분을 침출하였다. 이 때 산화물분말과 NaOH 수용액의 장입비는 63 × 10-3 kg/L로 일정하게 하였으며, 온도는 70~110°C, NaOH 수용액농도 는 15~25%, 침출시간은 1~4시간으로 변화시켰다. 소정의 시간 침출 후 침출용액과 미용해 잔사를 진공여과를 통하여 고액분리하였다. 고액분리된 침출용액을 HCl과 Na2S·9H2O 을 사용하는 2가지 방법으로 정제하였다. HCl을 사용하는 경우에는 HCl를 첨가하여 용액의 pH를 조정한 후 1시간 동안 상온 교반하여 생성되는 침전물을 고액분리하여 정 제용액을 제조하였다. 이때 HCl의 첨가량은 용액의 pH가 8~14가 되도록 변화시켰다. Na2S·9H2O를 사용하는 경우 에는 Na2S·9H2O 수용액(5 ml)을 침출용액에 첨가한 후 1 시간 동안 상온 교반하여 생성되는 침전물을 고액분리하 여 정제용액을 제조하였다. 이때 Na2S·9H2O의 첨가량은 전체 용액 중에서 Na2S·9H2O 농도가 0~0.6%가 되도록 변 화시켰다. 제조된 정제 용액에 소정의 HCl을 첨가하여 1 시간 동안 교반 석출시켜 고액분리한 후 석출물을 세척 건조하여 W 성분을 최종적으로 회수하였다. 이때 HCl의 첨가량은 정제 용액의 pH가 −0.2~−0.6이 되도록 변화시켰 다. 슬러지분말, 슬러지분말의 산화물, 미용해 잔사, 최종 석 출물 들의 중량측정과 XRD(x-ray diffractometer; X'Pert-MPD system, Philips)분석 및 XRF(x-ray fluorescence spectrometer; XRF-1800, Shimadzu)분석을 하였으며, 정제 용액을 ICP (inductively coupled plasma mass spectrometer; NexIon 300D, Perkin-elmer)분석하여, 각각의 공정변수가 침출, 정 제, 석출에 미치는 영향을 검토하였다. 또한 슬러지분말과 최종 석출물을 FE-SEM(field emission scanning electron microscope, JSM-6700F, Jeol)으로 관찰하여 형상과 크기 를 분석하였으며, 슬러지 분말을 TGA(thermo gravimetric analyzer, TGA-7, Perkin-elmer)분석하여 산화에 따른 열중 량변화를 분석하였다.
2. 실험방법
- 그림 1에 본 연구에서 사용한 WC/Co 가공 슬러지의 (a) 세척 전과 (b) 세척 후 건조된 슬러지 입자의 사진을 나타 내었다. 가공 슬러지는 WC/Co 초경합금의 엔드밀 가공 슬러지이다. 가공 슬러지 입자는 약 8~140 μm(평균입자크 기: 약 34 μm)의 입자크기를 가지고 있었다. 표 1에 세척 후 건조된 가공 슬러지의 XRF 분석결과를 나타내었다. 가 공 슬러지에는 약 88 wt%의 W과 약 9 wt%의 Co 및 미량 의 불순물(Cr, Fe, Si 등)이 함유되어 있었다.
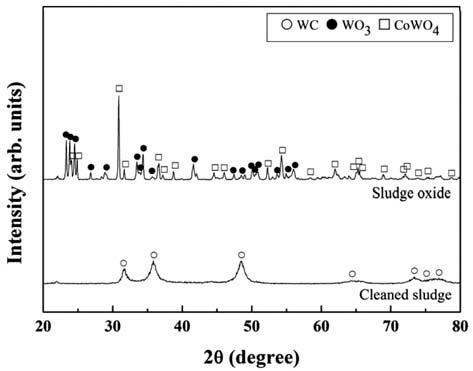
- 본 연구에서는 W 광석(Scheelite, Wolframite)으로부터 알칼리 용액을 사용하여 텅스텐 성분을 추출하는 원리를 활용하기 위하여[11,12,18,19], WC/Co 가공 슬러지내에 탄화물 상태로 존재하는 W을 산화물 상태로 변환시키고 자 하였다. 가공 슬러지를 TGA 분석한 결과 대기 분위기 에서 약 700°C 이상의 온도에서 약 116%의 무게 증가를 보이며 완전히 산화되는 거동을 나타내었다. 그림 2에 가 공 슬러지를 900°C의 대기 분위기에서 12시간 동안 산화 시킨 분말의 XRD 회절패턴을 나타내었다. 비교를 위해 산화 전의 세척 후 건조상태의 가공 슬러지의 XRD 회절 패턴도 함께 나타내었다. 가공 슬러지 상태에서는 WC의 회절피크 만이 관찰되고 있으나, 산화처리된 상태에서는 WO3와 CoWO4의 회절피크 만이 관찰되고 있다. 따라서 본 연구의 산화처리 조건에서 WC/Co 초경합금의 가공 슬 러지는 완전히 산화되는 것을 알 수 있다. 또한 WC/Co 초 경합금의 가공 슬러지의 산화물은 WO3와 CoWO4 복합체 로 구성되어 있으며, 이들 구성 상(phase)은 WC/Co 초경 합금 벌크의 산화물의 구성 상[6,7]과 동일하였다.
- 그림 3에 산화처리된 가공 슬러지로부터 NaOH 수용액 을 사용하여, 침출온도, NaOH 농도, 침출시간을 변화시켜 침출한 경우 W 침출율의 변화를 나타내었다. 그림 3 (a) 는 침출시간이 일정(2 시간)할 때 침출온도와 NaOH 농도 에 따른 변화를, 그림 3 (b)는 NaOH 농도가 일정(20%)할 때 침출시간과 침출온도에 따른 변화를 나타내었다. 침출 율은 침출에 사용된 가공 슬러지의 무게와 가공 슬러지 내의 W 함량 및 침출 후 고액분리된 미용해 잔사의 무게 와 잔사내의 W 함량으로부터 추산하였다. W 침출율은 침 출온도가 증가함에 따라 증가하여 포화되는 경향을 나타 내었으며, 침출율이 포화되는 온도는 NaOH의 농도가 15%에서 25%로 증가함에 따라 감소하였다. 침출온도 90°C 이상에서는 침출온도와 침출시간에 무관하게 약 99%의 침출율을 나타내었다. 본 연구의 침출조건 범위에 서는 침출온도 90°C 이상에서는 NaOH 농도와 침출시간 에 무관하게 W 침출율은 약 99%를 나타내었다. 따라서 WC/Co 초경합금 가공 슬러지로부터 NaOH를 이용한 W 의 침출에는 침출온도, NaOH 농도, 침출시간의 순으로 영 향이 큰 것을 알 수 있다.
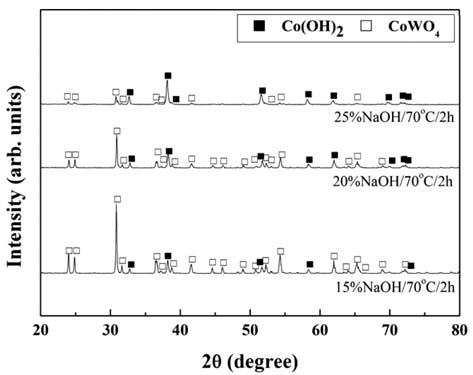
- 그림 4에 침출온도 70°C에서 2시간 침출 후 고액분리된 미용해 잔사의 XRD 회절피크의 NaOH 농도에 따른 변화 를 나타내었다. 미용해 잔사에서는 Co(OH)2와 CoWO4의 회절피크가 관찰되고, NaOH의 농도가 증가함에 따라 Co(OH)2의 회절피크의 강도가 높아지고 CoWO4의 회절피 크의 강도는 감소하고 있다. 본 연구의 모든 침출조건에서 얻어진 미용해 잔사에서는 그림 4에서 관찰되어지는 것과 동일한 상(phase)의 회절피크가 관찰되었다. 또한 W 침출 율이 증가하는 침출조건(높은 침출온도, 높은 NaOH 농도, 긴 침출시간)일수록 Co(OH)2의 회절피크의 강도는 높아 지고 CoWO4의 회절피크의 강도는 감소하는 경향을 나타 내었다. 따라서 산화처리된 WC/Co 초경합금 가공 슬러지 의 산화물에 존재하는 WO3와 CoWO4 중에서 WO3가 우 선적으로 침출되고, CoWO4의 침출과 동시에 Co(OH)2가 형성되는 것을 알 수 있다. 즉 산화처리된 WC/Co 초경합 금 가공 슬러지 산화물의 NaOH 수용액에 의한 W의 침출 반응은 식 (1), (2)와 같이 진행되는 것으로 판단된다.
- 침출용액 내에는 W 이외에도 Co와 기타 불순물 성분이 포함되어 있다. 용액으로부터 석출에 의해 고순도의 W을 회수하기 위해서는 침출용액 내에 존재하는 Co와 불순물 을 제거하는 정제과정이 필요하다. 용액의 정제 방법으로 는 용액의 pH를 변화시켜 용액 내에 존재하는 원소의 활 성상태를 조절하여 W 이외의 불순물을 침전시키는 방법 과 용액의 pH 변화 없이 불순물과 화합물을 이루는 원소 를 첨가하여 불순물을 침전시키는 2가지 방법을 생각 할 수 있다. 본 연구에서는 2가지 방법을 모두 시도하여 그 효과를 비교하였다. 일반적으로 수용액 내에 존재하는 화 학종은 용액의 pH에 따라 활성상태가 변화하고, 존재하는 형태는 이온상태와 고체상태(금속, 수화물, 수산화물, 산화 물)로 나누어진다. 침출용액에서 W 이외의 화학종을 고체 상태로 침전시키기 위해서는 W은 이온상태로 존재하고 W 이외의 화학종은 고체상태가 되도록 용액의 pH를 조절하여 야 한다. 본 연구에서는 대상으로 하는 화학종(W, Co, Cr 등)의 상온에서의 Pourbaix diagram (potential-pH equilibrium diagram)을 근거로 하여 용액의 pH를 조절하였다[20]. 즉 Pourbaix diagram에서 강한 염기성(pH = 약 14) 상태인 침 출용액에서는 W을 포함한 모든 화학종이 이온상태로 존 재함을 확인할 수 있었다. 침출용액내의 W 이외의 화학종 (Co, Cr 등)이 고체상태(수산화물 혹은 산화물)로 존재하 는 pH는 약 8~10으로 판단되었다. 침출용액의 pH 조절에 의한 정제에는 취급이 용이하고 수용액 상태에서 해리도 가 높아 화학반응에 유리하며 침출용액 내의 화학종의 종 류를 크게 증가시키지 않을 것으로 판단되는 HCl을 사용 하였다. 한편 침출용액의 pH 변화 없이 정제하기 위해서 는 반응성이 좋은 산소족의 두 번째 원소인 황(S)이 포함 된 Na2S·9H2O를 사용하였다.
- 표 2에 HCl을 사용하여 용액의 pH를 조절하여 정제한 용액과 Na2S·9H2O를 첨가하여 정제한 용액의 ICP 분석결 과를 나타내었다. 정제에는 20% NaOH 수용액으로 110°C 에서 2시간 침출한 침출용액을 사용하였으며, ICP 분석은 불순물 원소(Co, Cr 등)를 대상으로 실시하였다. 불순물의 농도는 용액의 pH가 낮아지고, Na2S·9H2O의 첨가량이 증 가할수록 감소하는 경향을 나타내었으나, pH와 Na2S·9H2O 첨가량에 따른 뚜렷한 차이는 보이지 않았다. 그러나 pH 를 조절한 경우가 Na2S·9H2O를 첨가한 경우보다 S, Al, Si이 낮은 농도를 나타내어, 침출용액의 정제에는 용액의 pH 조절이 보다 효과적인 것으로 판단된다.
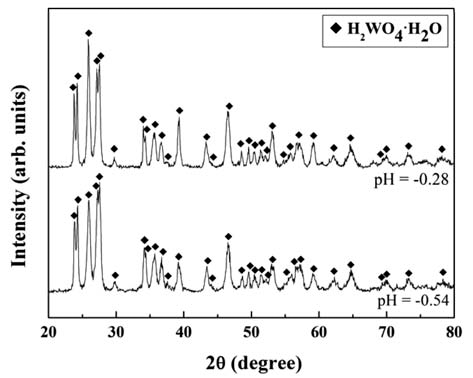
- 그림 5에 용액의 pH를 조절하여 정제된 정제용액(pH=9) 으로부터 HCl을 사용하여 용액의 pH를 −0.28, −0.54로 하 여 석출시킨 석출물의 XRD 회절피크를 나타내었다. 석출 물은 H2WO4·H2O의 회절피크를 나타내었다. 본 연구의 석출조건(pH = −0.2~−0.6)에서 석출된 모든 석출물은 그 림 5와 동일한 회절피크를 나타내었다. 따라서 정제용액 으로부터 HCl을 사용한 pH 조절에 따른 W 성분의 석출 반응은 식 (3)과 같이 진행되는 것으로 판단된다.
- 또한 석출물의 XRF 분석결과, W 이외의 원소는 관찰되 지 않았다. 따라서 WC/Co 초경합금 가공 슬러지로부터 W을 고순도(순도 약 100%)의 H2WO4·H2O 형태로 회수할 수 있음을 알았다.
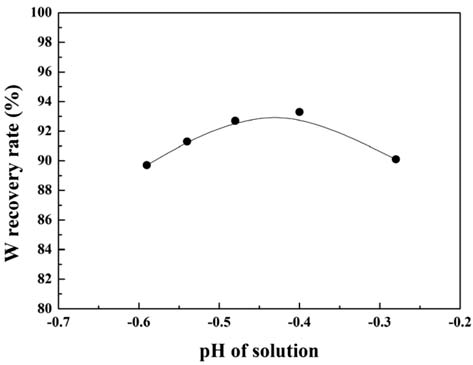
- 그림 6에 용액의 pH에 따른 W 회수율의 변화를 나타내 었다. W 회수율은 사용된 초기 가공 슬러지의 무게와 가 공 슬러지 내의 W 함량 및 최종 석출물의 무게로부터 추 산하였다. 용액의 pH가 감소함에 따라 W 회수율는 증가하 여 pH = −0.4일 때 최대 회수율 약 93%를 나타낸 후 pH 의 감소와 함께 감소하고 있다. 이러한 용액의 pH에 따른 W 회수율의 변화를 본 연구에서는 식 (3)의 반응성과 각 화 학종들의 용액내의 안정도 관점에서 검토하고자 하였다. 그 림 7에 W과 Cl의 상온 Pourbaix diagram (potential-pH equilibrium diagram)을 나타내었다[20]. Pourbaix diagram (potential-pH equilibrium diagram)에서 W은 용액의 pH가 낮을수록 이온상태보다 고체상태로 존재하는 것이 안정하 다. 따라서 용액의 pH 감소에 따른 W 회수율의 증가는 용액내 H+, Cl- 이온의 증가에 따른 식 (3) 반응의 촉진 및 W의 고체상태의 안정성의 증가에 의한 것으로 판단된다. 따라서 용액의 pH가 감소할수록 W 회수율은 계속 증가 할 것으로 예상할 수 있다. 그러나 실제 W 회수율은 pH = −0.4 이하에서는 오히려 감소하였다. 한편 Cl의 Pourbaix diagram (potential-pH equilibrium diagram)에서는 pH가 감소함에 따라 Cl은 이온상태로 존재하는 것보다 분자상 태(HCl)로 존재하는 것이 안정함을 알 수 있다. 따라서 용 액의 pH가 어느 임계값 이하가 되면, H+와 Cl- 이온의 활 성도가 감소하여 식 (3) 반응이 억제될 것으로 예상된다. 따라서 본 연구의 경우 용액의 pH = −0.4 이하에서 pH가 감소함에 따라 W 회수율이 감소한 것은 이러한 H+와 Cl- 이온의 활성도 변화에 의한 것으로 판단된다.
- 그림 8에 용액의 pH = −0.4에서 석출된 H2WO4·H2O 입 자의 FE-SEM 사진을 나타내었다. 입자는 입자크기 분포 약 100~300 nm (평균입자크기: 약 180 nm)를 나타내었으 며, 형상은 판상의 모양을 가지고 있다. 본 연구의 W 석 출조건 범위에서는 용액의 pH에 따른 석출입자의 크기와 형상의 변화는 관찰할 수 없었다. 본 연구에서 회수된 W 은 고순도의 텅스텐산 수화물 형태로 향후 적정한 건식 열처리에 의해 미립의 텅스텐산화물로 변환이 가능할 것 으로 판단된다.
3. 결과 및 고찰
Table 1
Chemical composition of cleaned WC/Co hardmetal sludge.
| Material | Composition (wt.%) | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
|
|
||||||||||
| W | Co | Cr | Fe | S | Al | Si | Na | Ca | Total | |
|
|
||||||||||
| Sludge | 88.10 | 8.96 | 0.50 | 0.34 | 0.15 | 0.31 | 0.69 | 0.65 | 0.30 | 100 |
Fig. 3
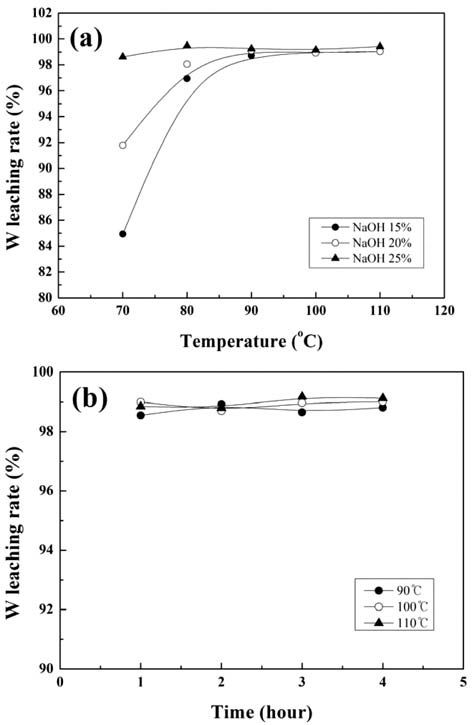
Changes in the tungsten leaching rate with (a) leaching temperature for the various NaOH concentrations, and (b) leaching time for the various leaching temperatures.

Table 2
Impurity content of the refined solutions.
Fig. 7
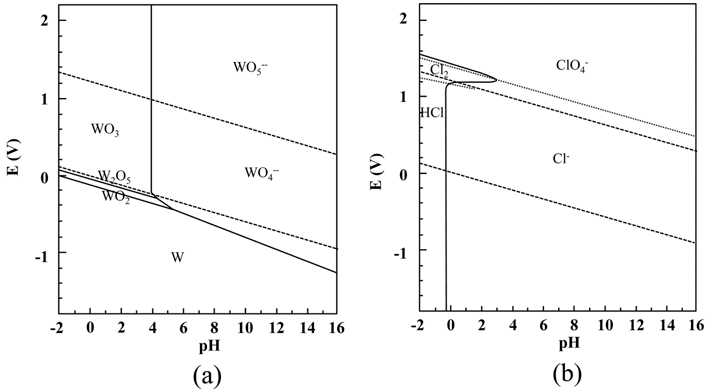
Pourbaix diagram (potential-pH equilibrium diagram) for (a) the system tungsten-water, and (b) the system chlorinewater, at 25°C.

- WC/Co 초경합금 가공 슬러지로부터 W의 회수가 가능 한 알칼리침출 정련공정을 개발하고, W 회수에 미치는 공 정변수의 영향을 검토하였다. 알칼리침출 정련공정은 가공 슬러지 산화, W 침출, 침출용액 정제, W 석출공정으로 이 루어져 있다. 가공 슬러지의 산화물은 WO3와 CoWO4로 구성되어 있었다. 가공 슬러지 산화물로부터 NaOH를 이용 한 W 성분의 침출에는 침출온도, NaOH 농도, 침출시간의 순으로 큰 영향을 미쳤다. 침출온도 90°C 이상, NaOH 농 도 15% 이상에서 약 99%의 W 성분이 침출되었다. 가공 슬러지의 산화물을 구성하는 WO3와 CoWO4 중에서 WO3가 우선적으로 침출되었다. 침출용액의 정제에는 Na2S·9H2O를 첨가하는 것 보다 HCl을 이용한 용액의 pH 조절이 보다 효과적이었다. HCl을 사용하여 용액의 pH를 조절함으로써 W 성분을 고순도의 H2WO4·H2O 입자형태(입자크기분포: 약 100~300 nm)로 석출, 회수하였다. W 회수율은 용액의 pH가 감소함에 따라 증가한 후 감소하는 경향을 나타내었 다. WC/Co 초경합금 가공 슬러지에 포함된 W의 약 93% 를 알칼리침출 정련공정으로 회수하였다.
4. 결 론
-
Acknowledgements
- 이 논문은 부경대학교 자율창의학술연구비(2016년)에 의하여 연구되었음.
감사의 글
- 1. K. J. A. Brookes: World Directory and Handbook of Hardmetals and Hard Materials, sixth ed., International Carbide Data, Hertfordshire (1996) 9. .
- 2. K. Halada: J. Jap. Soc. Powder & Powder Metall., 57 (2010) 87. .Article
- 3. E. Lassner and W. D. Schubert: Tungsten Properties, Chemistry, Technology of the Element, Alloys and Chemical Compounds, Bloating-Crushing Process Kluwer Academic Plenum Publishers, New York (1999) 377. .Article
- 4. C. S. Freemantle, N. Sacks, M. Topic and C. A. Pineda- Vargas: Int. J. Refractory Met. & Hard Mater., 44 (2014) 94. .Article
- 5. L. S. Friedman, I. L. Friedman, K. C. Zagielski and L. A. Adams: U. S. patent No. 3184169 (1965). .
- 6. G. G. Lee and G. H. Ha: J. Korean Powder Metall. Inst., 12 (2005) 112. .Article
- 7. G. G. Lee and G. H. Ha: Met. Mater. Int., 22 (2016) 260. .Article
- 8. R. Sasai, F. Inagaki, N. F. Gao and H. Itoh: J. of the Soc. Mater. Sci., 55 (2006) 254. .Article
- 9. J. C. Lee, E. Y. Kim, J. H. Kim, W. Kim, B. S. Kim, and B. D. Pandey: Int. J. Refract. Met. Hard Mater., 29 (2011) 365. .Article
- 10. H. K. Chang: Korea patent No. 1020070059108 (2007). .
- 11. S. W. H. Yih and C. T. Wang: Tungsten Sources, Metallurgy, Properties and Applications, Plenum Press, New York (1979) 79. .
- 12. K. Nose and T. Okabe: Met. & Tech., 81 (2011) 908. .
- 13. K. Vadasdi: Int. J. Refractory Met. & Hard Mater., 13 (1995) 45. .Article
- 14. J. C. Lee and G. H. Kim: Korea patent No. 1020100117087 (2010). .
- 15. V. V. Malyshev and A. I. Hab: Mater. Sci., 40 (2004) 555. .Article
- 16. V. V. Malyshev and A. I. Gab: Theorectical Foundations of Chem. Eng., 41 (2007) 436. .Article
- 17. S. Wongsisa, P. Srichandr and N. Poolthong: Mater. Trans., 56 (2015) 70. .Article
- 18. K. Srinivas, T. Sreenivas, R. Natarajan and N. P. H. Padmanabhan: Hydrometallurgy, 58 (2000) 43. .Article
- 19. A. M. Amer: Hydrometallurgy, 58 (2000) 251. .Article
- 20. M. Pourbaix: Atlas of Electrochemical Equilibria in Aqueous Solutions, Pergamon Press Ltd., New York (1966) 95..
Figure & Data
References
Citations
Citations to this article as recorded by 

- Fabrication of tungsten oxide powder from WC–Co cemented carbide scraps by oxidation behaviour
Min Soo Park, Jong-Min Gwak, Kyeong-mi Jang, Gook-Hyun Ha
Powder Metallurgy.2023; 66(5): 688. CrossRef
Recovery of Tungsten from WC/Co Hardmetal Sludge by Alkaline Leaching Hydrometallurgy Process

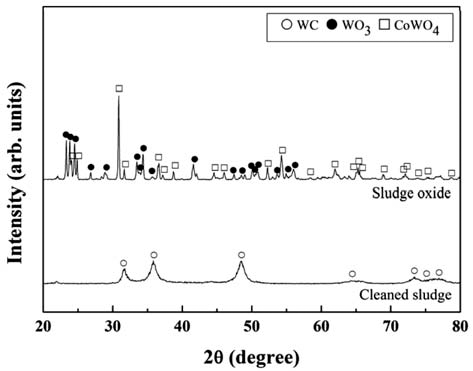
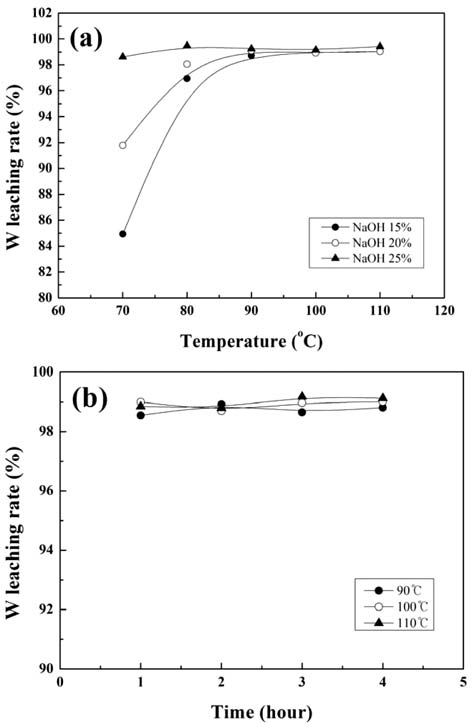
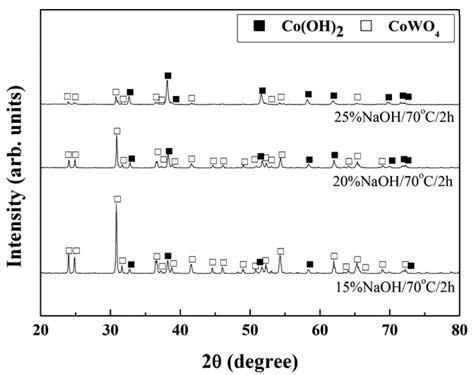
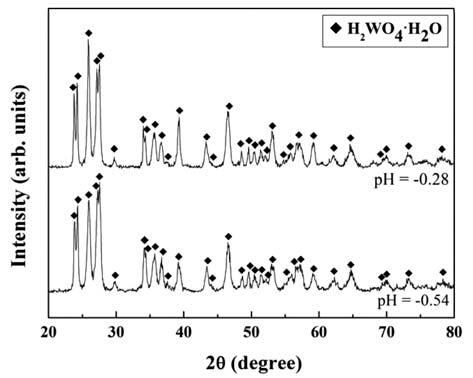
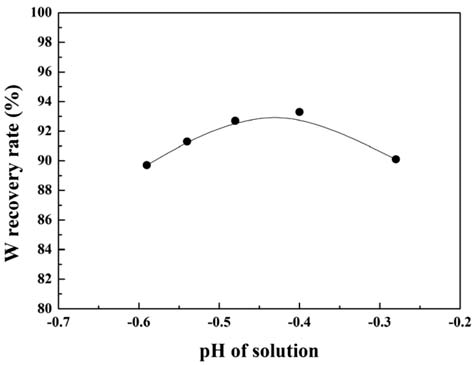
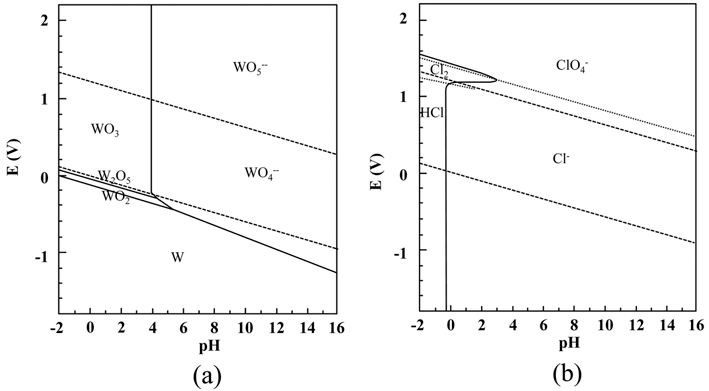

Fig. 1
Micrographs of WC/Co hardmetal sludge of (a) before cleaning, and (b) after cleaning.
Fig. 2
X-ray diffraction patterns of WC/Co hardmetal sludge and its oxide.
Fig. 3
Changes in the tungsten leaching rate with (a) leaching temperature for the various NaOH concentrations, and (b) leaching time for the various leaching temperatures.
Fig. 4
X-ray diffraction patterns of the residuum leached at various NaOH concentrations.
Fig. 5
X-ray diffraction patterns of precipitate extracted at various pH of solutions.
Fig. 6
Changes in the tungsten recovery rate with pH of solution.
Fig. 7
Pourbaix diagram (potential-pH equilibrium diagram) for (a) the system tungsten-water, and (b) the system chlorinewater, at 25°C.
Fig. 8
FE-SEM micrograph of precipitate (H2WO4·H2O) extracted at pH = -0.4.
Fig. 1
Fig. 2
Fig. 3
Fig. 4
Fig. 5
Fig. 6
Fig. 7
Fig. 8
Recovery of Tungsten from WC/Co Hardmetal Sludge by Alkaline Leaching Hydrometallurgy Process
| Material | Composition (wt.%) | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
|
|
||||||||||
| W | Co | Cr | Fe | S | Al | Si | Na | Ca | Total | |
|
|
||||||||||
| Sludge | 88.10 | 8.96 | 0.50 | 0.34 | 0.15 | 0.31 | 0.69 | 0.65 | 0.30 | 100 |
| Refinement parameter | Concentration (mg/L) | |||||
|---|---|---|---|---|---|---|
|
|
||||||
| Co | Cr | S | Al | Si | ||
|
|
||||||
| pH control | pH = 10 | 2.61 | 2.26 | 1.11 | 0.10 | 10.45 |
| pH = 9 | 1.39 | 1.50 | 1.85 | 0 | 7.29 | |
| pH = 8 | 1.23 | 2.01 | 1.95 | 0 | 33.27 | |
| Na2S·9H2O addition | 0.2% Na2S·9H2O | 1.41 | 2.39 | 20.57 | 4.57 | 104.21 |
| 0.4% Na2S·9H2O | 1.38 | 2.39 | 46.39 | 4.45 | 111.82 | |
| 0.6% Na2S·9H2O | 1.20 | 2.12 | 80.81 | 4.46 | 114.51 | |
Table 1
Chemical composition of cleaned WC/Co hardmetal sludge.
Table 2
Impurity content of the refined solutions.
Table 1
Table 2
TOP
 KPMI
KPMI



 Cite this Article
Cite this Article








