Articles
- Page Path
- HOME > J Powder Mater > Volume 31(3); 2024 > Article
-
Research Article
다양한 고체분산체 제조방법으로 제조한 실로도신 함유 고체분산체의 비교 및 특성분석 - 이수만, 송다영, 김경수*
- Comparison and Characterization of Silodosin-loaded Solid Dispersions Prepared by Various Solid Dispersion Preparation Methods
- Su Man Lee, Da Young Song, Kyeong Soo Kim*
-
Journal of Powder Materials 2024;31(3):263-271.
DOI: https://doi.org/10.4150/jpm.2024.00143
Published online: June 27, 2024
경상국립대학교 제약공학과
Department of Pharmaceutical Engineering, Gyeongsang National University, 33 Dongjin-ro, Jinju 52725, Republic of Korea
- *Corresponding author: Kyeong Soo Kim, Tel: +82-55-772-3391 Fax: +82-55-772-3399 E-mail: soyoyu79@gnu.ac.kr
• Received: May 27, 2024 • Revised: June 18, 2024 • Accepted: June 18, 2024
© The Korean Powder Metallurgy & Materials Institute
This is an Open Access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/4.0/) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
- 1,580 Views
- 37 Download
Abstract
- This study focused on improving the solubility of silodosin, a drug poorly soluble in water, by utilizing solid dispersions. Three types of dispersions were examined and compared against the drug powder: surface-attached (SA), solvent-wetted (SW), and solvent-evaporated (SE). Polyvinyl alcohol (PVA) was identified as the most effective polymer in enhancing solubility. These dispersions were prepared using spray-drying techniques with silodosin and PVA as the polymer, employing solvents such as water, ethanol, and a water-acetone mix. The physicochemical properties and solubility of the dispersions were evaluated. The surface-attached dispersions featured the polymer on a crystalline drug surface, the solvent-wetted dispersions had the amorphous drug on the polymer, and the solvent-evaporated dispersions produced nearly round particles with both components amorphous. Testing revealed that the order of improved solubility was: solvent-evaporated, solvent-wetted, and surface-attached. The results demonstrated that the preparation method of the solid dispersions significantly impacted their physicochemical properties and solubility enhancement.
- 양성 전립선 비대증(Benign prostatic hyperplasia, BPH)은 노년 남성에게서 흔히 관찰되는 전립선의 크기가 증가하는 질병이다. 이로 인해 환자는 잔뇨감, 소변줄기 약화 또는 끊김, 빈뇨, 야뇨증 등 다양한 하부 요로 증상(Lower urinary tract symptoms, LUTS)을 겪게 된다[1]. 사람의 전립선, 방광기저부, 방광 경부, 전립선 피막 및 요도에는 교감 신경 중 하나인 시냅스 후 α1 아드레날린 수용체가 다량 분포한다. 실로도신(Silodosin)은 α1 아드레날린 수용체를 차단하는 역할을 하여 이러한 조직의 평활근을 이완시켜 소변흐름이 개선되고, 전립선 비대증의 증상이 감소하게 된다[2].
- 실로도신의 IUPAC명은 1-(3-hydroxypropyl)-5-[(2R)-2-({2-[2-(2,2,2-trifluoroethoxy)phenoxy]ethyl}amino)propyl]-2,3-dihydro-1H-indole-7-carboxamide이며[3], 화학식은 C25H32F3N3O4, 분자 구조는 Fig. 1과 같다. 흰색~황백색 분말로 녹는점은 약 105 °C~109 °C이며, 아세트산과 알코올에는 매우 잘 용해되나 물에는 아주 약간 용해된다고 FDA 라벨에 명시되어 있다[4]. 경구 투여 약물의 경우 위장관 막을 통하여 전신순환에 도달하기 때문에 먼저 위 또는 장액에서 용해되어야 한다[5]. 물에 잘 녹지 않는 약물의 특성으로 인하여 경구 투여 시 용해 및 흡수에 관련한 문제 가능성을 가지고 있다. 실로도신의 수용해도 개선은 궁극적으로 약물의 경구 생체 이용률을 증가시킬 수 있을 것으로 사료된다.
- 약물의 수용해도 개선을 위한 방법으로는 공결정 형성, 염형성, 사이클로덱스트린과의 복합체화, SNEDDS (Self-NanoEmulsifying Drug Delivery System) 및 나노 파티클 등 여러가지 방법이 사용되어왔다[6]. 이러한 가용화 방법 외에 고체분산체(Solid dispersion, SD) 제조는 약물의 용해도를 향상시켜 생체 이용률을 향상시키는 전통적이며 효과적인 수단 중 하나이다[7]. 고체분산 기술에 의한 약물 가용화와 관련한 메커니즘의 기본 원리는, 약물의 입자 크기를 감소시키고 약물의 결정성을 제거함으로써 무정형 약물을 만들 수 있게 된다[8]. 결정성 약물은 용해 과정에서 격자 분해 에너지가 필요하지만 무정형 약물은 격자 에너지가 불필요하며 표면적이 증가하여 무정형 약물이 결정형보다 더 잘 용해되게 된다[9]. 고체분산체 제조는 사이클로덱스트린 복합체화와 달리 하이드록시프로필-β-사이클로덱스트린과 같은 고가의 부형제가 필수가 아니기 때문에 비용 효율적인 기술로 간주할 수 있다[10]. 고체분산체가 효과적으로 작동하기 위해서는 약물의 입자크기가 감소하여 표면적이 증가하고, 무정형 형태로 전환되는 것이 효과적이다. 무정형 형태를 안정화하기 위해 약물과 담체 사이에 수소결합과 같은 적절한 상호작용이 필요한 것으로 사료된다.
- 본 연구에서는 표면부착(SA) [11], 용매습윤(SW) [12], 용매증발(SE) [13] 세 가지 방법으로 제조한 고체분산체를 비교하기 위하여 PVA 그리고 다양한 용매를 사용하여 실로도신을 함유한 고체분산체를 제조하였다.
- SA-SD는 용해된 담체가 분무건조 시 약물입자 표면에 부착된다. 용액 내 약물이 분산 상태이므로 약물의 고유 결정 형태가 남아있을 수 있지만 약물표면의 담체에 의해 용해능은 향상될 수 있다. 대부분 용매로 물을 사용하기 때문에 제조 시 폭발의 위험성이 적고 무정형 고체분산체에 비하여 재결정화 위험이 감소하지만, 약물의 결정성이 잔존하므로 용해도 개선이 제한적이라는 단점을 가지고 있는 것으로 알려져 있다[11].
- 약물은 용해되고 담체는 용해되지 않는 유기용매를 사용하여 SW-SD를 제조한다. 이는 SA-SD와는 달리, 용해된 약물이 무정형 형태로 담체와 결합하게 된다. 이 시스템은 약물의 재결정화를 감소시키지만 SE-SD에 비해 약물용해도 향상이 상대적으로 낮을 수 있다[12].
- SE-SD는 용매에 약물과 담체를 모두 용해시켜 무정형 고체분산체를 제조함으로써 약물용해도를 크게 향상시키는 장점을 가지고 있다. 그러나 SE-SD에서 약물이 무정형에서 결정형으로 변환될 가능성을 내재하고 있다[13].
- 주사전자 현미경(SEM)과 분말 X-선 회절 분석기(PXRD), 푸리에-변환 적외선 분광기(FT-IR)를 이용하여 세 가지 상이한 방법으로 제조한 고체분산체의 물리적 특성을 확인하고 포화용해도 및 동적 용해도를 확인하여 결정성을 지닌 실로도신과 비교하였다. 또한 SA, SW 및 SE 제조방법의 차이로 인하여 제조된 각 고체분산체는 입자의 형태 및 크기 등 특성에 차이를 가지게 된다. 연구를 통해 이러한 차이에 대해 확인하고, 특성 차이에서 기인한 용해도 향상 정도의 차이를 알아보았다.
1. Introduction
- 2.1. 시약 및 기기
- 실로도신 및 Na-alginate, HPMC 2910 P-603, HPMC 2910 P-645, PVP K30, Gelatin은 한미약품 (Hwasung, South Korea)에서 제공받아 사용하였다. Parteck SRP 80 (폴리비닐알코올, PVA)은 Merck (Darmstadt, Germany)에서 구매하여 사용하였다. Dextran은 한양대학교(Seoul, South Korea)에서 제공받아 사용하였다. HPC-L은 코스맥스(Seongnam, South Korea)에서 제공받아 사용하였다. Na-CMC는 덕산약품(Ansan, South Korea)에서 구매하여 사용하였다. β-Cyclodextrin은 Ashland (Delaware, USA)에서 구매하여 사용하였다. Carbopol 934 및 Carbopol 941은 3V sigma (Bergamo, Italia)에서 구매하여 사용하였다. Kollidon VA64는 보령제약(Seoul, South Korea)에서 제공받아 사용하였다. 아세토니트릴, 아세톤, 에탄올 및 제2인산칼륨(K2HPO4)는 대정화금(Siheung, South Korea)에서 구매하여 사용하였다. 기타 용매 및 시약은 모두 시판 시약급을 사용하였다.
- HPLC 분석 장비는 Agilent 1260 Infinity HPLC system (Agilent Technologies, Santa Clara, CA, USA)를 사용하였으며, 검출기는 Chemstation software, G1311C 1260 Quat Pump, G1314 1260 VWD를 사용하였다. 실로도신의 최대 흡광 파장 확인은 자외선-가시선 분광 광도계(UV-1800, Shimadzu, Japan)를 이용해 확인했으며, HPLC 분석 시 컬럼은 VDSpher 100 C18 M-E (VDS optilab, Berlin, Germany), 4.6 mm x 150 mm, 5 µm particle size를 선정하여 사용하였다. 포화용해도 및 동적 용해도 평가를 위한 진탕 항온수조는 대한랩테크사의 LSB-045S (Namyangju, South Korea)를 사용하였다. 원심분리기는 Micro Centrifuge 1730R (Gyrozen, Gimpo, South Korea)을 사용하였다. 고체분산체 제조를 위한 분무건조기는 실험실 규모의 미니 분무건조기 Model - ADL311 Spray dryer (Yamato, Tokyo, Japan)을 사용하였다.
- 2.2. 실로도신을 함유한 세 가지 고체분산체 제조
- 고체분산체를 제조할 고분자 선정을 위해 1 % (w/v) 고분자용액을 사용하였다. 10 % 또는 20 %와 같은 고농도 고분자 용액의 경우 점도가 증가하여 약물의 용해도 확인에 영향을 미칠 가능성을 고려하였다. 또한 저농도의 고분자 용액에서는 고분자의 침전이 약물의 용해도를 왜곡할 가능성을 감소 시킬 수 있을 뿐 아니라, 1 %와 같은 저농도에서 용해도 평가를 시작하면 기준 값의 설정이 가능하기 때문에 고농도에서 추가 실험을 수행하여 농도 의존적 효과의 관찰이 가능하다고 판단하여 이와 같이 실험을 설계하였다.
- 1 % (w/v) 고분자 용액 1 mL가 들어있는 e-tube에 실로도신 약 10 mg을 넣은 후 혼합액을 37 ± 0.5 ℃의 진탕 항온수조에서 5일간 보관하며 볼텍스 믹서(Vortex-Genie 2, Scientific Industries, Inc., USA)로 섞어주며 과포화 시켰다. 이 후 각 e-tube를 원심분리기를 사용하여 37 ℃, 13,500 g조건에서 15분 동안 원심분리 하여 얻어진 상등액을 0.45 μm 주사기 필터로 여과해 얻어진 맑은 용액을 이동상으로 10배 또는 100배 희석하여[14, 15], 상기의 HPLC 시스템을 이용하여 분석하였다. 이동상은 아세토니트릴과, 50 mM 제2인산칼륨을 인산으로 pH가 6.0이 되도록 조정한 용액을 35 : 65부피비로 혼합하여 사용하였다. 유속은 1.0 mL/min, 컬럼온도는 40 ℃, 주입 부피는 20 μL로 분석하였다[16]. 메탄올 용액으로 500 μg/mL실로도신 원액을 제조 후 계대 희석하여 1, 2.5, 5, 10, 25, 50 μg/mL 시험액을 제조한다. 이를 자외선-가시선 분광 광도계로 최대흡수부가 210 nm인 것을 확인하여, 흡수파장은 210 nm로 설정하여 분석하였다.
- 1 % (w/v) 고분자용액의 용해도 결과를 바탕으로 선택된 PVA와 약물, 서로 다른 용매로 구성된 고체분산체 제조용 용액을 분무건조기를 사용하여 고체분산체를 제조하였다. PVA를 정제수에 완전히 용해시킨 후 실로도신을 현탁 시킨 후 분무건조기의 주입구 온도 110 ℃, 배출구 온도 62 ~ 63 ℃, 공급 유속은 2 mL/min이 되도록 설정하여 표면부착 고체분산체(SA-SD)를 제조하였다. 용매습윤 고체분산체(SW-SD) 제조를 위하여 실로도신을 에탄올에 완전히 용해시키고 PVA를 이 용액에 현탁 시켰다. 분무건조기의 주입구 온도 80 ℃, 배출구 온도 50 ℃, 공급 유속은 4 mL/min이 되도록 설정한 후 분무건조 하였다. 용매증발 고체분산체(SE-SD)의 경우, 실로도신을 아세톤에 완전히 용해시키고 PVA는 정제수에 완전히 용해시킨다. 이 후 두 solution을 혼합하여 분무건조기의 조건을 주입구 온도 90 ℃, 배출구 온도 55 ℃, 공급 유속은 2 mL/min이 되도록 설정 후 분무건조하여 제조하였다. 분무 공기 압력은 0.1 MPa로 세 조건 모두 동일하며, 실로도신과 PVA 및 용매의 비율은 Table 2와 같다.
- 2.3. 실로도신을 함유한 세 가지 고체분산체의 물리화학적 특성 분석
- 표면 형태학적 특성 - 실로도신 약물 분말과 PVA, 표면부착(SA), 용매 습윤(SW) 및 용매증발(SE)방법으로 제조된 고체분산체의 형태 및 표면 특성을 방사형 주사 전자 현미경(FE-SEM, Tescan-MIRA3, Kohoutovice, Czech)을 사용하여 확인하였다. 샘플을 고정하기 위해 이중 접착 탄소 테이프를 디스크에 붙인 후 테이프 부착면에 샘플을 붙였다. 샘플은 EmiTech Sputter Coater(K575X)를 사용하여 7 × 10-3 mbar의 압력, 25 mA 전류에서 6 nm/min의 속도로 4분간 백금 코팅을 진행 후 확인하였다.
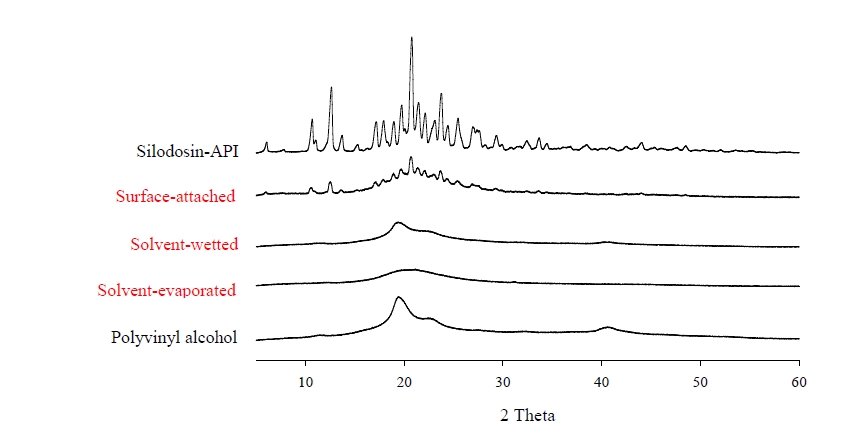
- 결정성 – 실로도신 약물 분말과 PVA, 표면부착, 용매 습윤 및 용매증발 방법으로 제조된 고체분산체의 결정 상태를 확인하기 위해 miniflex goniometer와 Cu Kα1 단색 방사선 소스가 장착되어 있는 Rigaku X-Ray Diffracto meter(D/MAX-2500 PC, RIgaku Corporation, Tokyo, Japan)을 이용하여 결정상태를 평가하였다. 상온에서 40mA와 40kv 조건, 5°≤2θ≤60°에서 초당 0.02°의 증가 속도로 측정하였다.
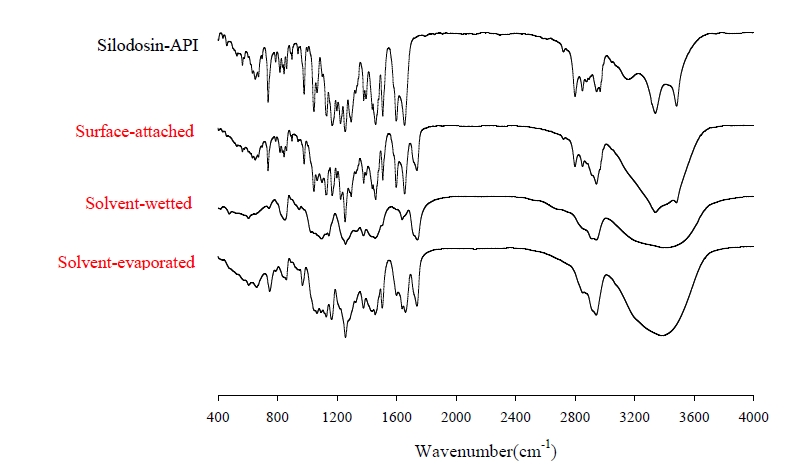
- 분자간 상호작용 – 단독 원료와 고체분산체 3종류를 FT-IR (Spectrum Two Pharmaceutical System, PerkinElmer, USA)을 사용하여 분석하였다. 파장범위는 400 ~ 4000 cm-1으로 설정하였으며, 검출기는 고직선성 실온 검출기를 사용하였다.
- 약물함량 시험 – 실로도신 10 mg을 정확하게 칭량하여 정제수와 에탄올을 50:50 (v/v)로 제조한 용매에 완전히 용해 시킨다. 0.45 μm 주사기 필터를 사용해 여과하여 표준액으로 하였다. 각 고체분산체는 20 mg(실로도신 함량 10 mg 해당량)을 정밀히 칭량하여 표준액과 같은 용매로 용해시킨 후 상기와 같이 0.45 μm 주사기 필터를 사용해 여과하여 검액으로 하였다. 모든 실험은 3번 반복하였다.
- 포화용해도 시험 – pH 6.8 용액 및 정제수에서의 용해도를 평가하기 위해 실로도신 약물 및 실로도신을 함유한 고체분산체를 실로도신으로서 10 mg해당량이 되도록 정밀히 칭량하여 e-tube에 넣은 후 각 시험액을 1 mL씩 넣는다. 혼합액을 37 ℃의 진탕 항온수조에서 5일간 보관하며 볼텍스 믹서로 섞어주며 포화 시켰다. 이 후 각 e-tube를 원심분리기를 사용하여 13,500 g에서 15분 동안 원심 분리하여 얻어진 상등액을 0.45 μm 주사기 필터를 통해 얻어진 맑은 용액을 이동상으로 희석하여, 상기의 HPLC 시스템과 조건으로 분석하였다. 모든 실험은 3번 반복하였다.
- 동적 용해도 시험 – 세 종류의 실로도신 함유 고체분산체 각각의 동적 용해도를 평가하기 위하여 포화용해도 시험과 마찬가지로 pH 6.8 용액 및 정제수를 시험액으로 하여 확인하였다. 고체분산체(실로도신으로서 10 mg해당량)를 시험액 30 mL가 들어있는 Conical tube에 넣고, 진탕 항온수조를 37 ℃, 100 rpm 조건으로 설정하였다. 이를 교반 하면서 10, 20, 30, 60, 120, 180 및 240분에서 1 mL씩 샘플링 하여 0.45 μm 주사기 필터를 이용해 여과하여 샘플을 얻었다[17]. 샘플을 이동상으로 10배 희석하여 포화용해도와 같은 조건으로 HPLC 분석을 진행하였다. 모든 실험은 3번 반복하였다.
2. Experimental
- 3.1. 부형제 선정 및 고체분산체의 제조
- 본 연구에서는 실로도신 용해도를 향상시키기 위한 방법으로 약물과 고분자가 균질하게 혼합되어 있는 고체분산체 제조기술을 사용하였다. 실로도신의 용해도를 개선시킬 수 있는 고분자를 선정하기 위하여 다양한 고분자 용액에서의 실로도신 용해도를 확인하였다. 평가에 사용된 친수성 고분자 1 % 용액 중 PVA용액에서 실로도신의 용해도가(264.1 ± 0.6 μg/mL vs 1063.7 ± 16.6 μg/mL)가 가장 크게 증가한 것을 알 수 있었다(Table 1, Fig. 2). PVA는 수용성 특성이 있는 합성 고분자로 친수성인 하이드록실 그룹과 소수성인 아세틸 그룹을 모두 가지는 독특한 특성을 가지고 있으며, pH에 비의존적인 용해도 특성을 가진 비이온성 고분자이다[18]. 무독성, 발암 무해성, 우수한 상용성 및 인체조직과 체액에서 생분해성을 가지므로 의학/약학 분야에서 많이 사용되는 고분자 중 하나로 알려져 있다. 또한 물에는 쉽게 용해되지만, 일반 유기용매에서는 불용성인 특성을 가지고 있다[19]. 이러한 PVA의 특성을 고려하여 용매를 달리하여 각기 다른 특성을 가진 3가지 (SA, SW, SE) 고체분산체를 제조하기에 적절하다고 사료되어, PVA를 실로도신의 가용화를 위한 고분자 담체로 선정하였다. 용매의 특성을 고려하여 제조할 수 있는 다양한 고체분산체를 제조하기 위하여, 용매를 달리한 후 약물과 고분자 비율은 모두 1:1 (w/w)로 하여 3가지 형태(SA, SW, SE)의 고체분산체를 제조할 수 있었으며, 제조한 고체분산체는 Fig. 3과 같이 백색의 분말상으로 수득할 수 있었다.
- 3.2. 실로도신 고체분산체의 물리화학적 특성 평가
- Table 2의 조성비로 제조된 3가지 고체분산체의 물리화학적 특성에 대해 평가를 진행하였다. 제조된 고체분산체의 함량을 분석한 결과 이론함량 대비하여 SA-SD는 105.6 %, SE-SD는 95.9 %로 고체분산체 조성에 비례한 실로도신 함량 값을 나타내었으나, SW-SD는 68.6 %로 SA, SE 고체분산체에 비해서는 낮은 실로도신 함량을 가진 것으로 확인되었다. 이는 SW-SD 제조 시 용매인 에탄올에 녹아 있는 실로도신이 용매에 녹지 않은 PVA에 비하여, 분말화로 수득 되지 못하고 상대적으로 많은 양이 용매와 함께 휘발되어 날아갔기 때문인 것으로 판단되었다.
- Fig. 4는 주사 전자 현미경으로 실로도신과 그 고체분산체 및 PVA의 표면 형태학적 특성을 촬영한 결과이다. 실로도신 원료 약물은 약 5 μm 정도의 얇고 긴 바늘 모양의 결정형태를 가지고 있으며, 담체로 선정한 PVA는 50 μm이상의 입자부터 그보다 작은 입자들로 구성되며 불규칙한 모양으로 확인되었다.
- SA-SD는 현탁 된 상태로 결정형을 유지한 실로도신에 정제수에 용해된 PVA가 분무건조 과정에서 실로도신 표면에 부착되어 실로도신 약물 분말의 원래 형태인 바늘에 코팅되어 있는 형태로 제조된 것으로 판단되었으며(Fig. 4, C, D), SW-SD의 경우 분무건조 과정에서 용해된 실로도신이 원래의 형태를 유지한 PVA의 표면에 부착되어 얇은 실처럼 가느다란 입자 형태로 부착되어 있는 것으로 확인되었다(Fig. 4, E, F). SE-SD의 경우는 실로도신과 PVA가 아세톤에/정제수 용액에 투명하게 용해된 후 분무건조되어 제조된 고체분산체이다. SE-SD의 형태를 SEM 촬영한 결과, 다른 두 고체분산체와 달리 구형에 가까운 형태로 제조되었다. 이는 침상의 결정형태인 실로도신이 PVA와 함께 용해된 상태인 용액을 분무건조 함으로써 구형태의 미세액적에서 용매가 순간적으로 건조되어 제조된 형태인 것으로 사료되었다[20].
- 제조된 고체분산체들의 다형성(Polymorphism) 결정상태를 확인하기 위해 분말 X선 회절 패턴을 이용해 분석한 결과(Fig. 5), SEM촬영 시 실로도신의 결정 형태가 확인되었던 SA-SD의 경우 PXRD그래프에는 실로도신 약물이 가진 고유한 결정 피크를 유지하고 있는 것을 알 수 있었다. 실로도신의 형태가 완전히 사라진 SW-SD 및 구형태로 제조된 SE-SD의 PXRD그래프에서는 실로도신의 결정 특성을 나타내는 피크가 모두 사라진 것이 확인되었다. 이를 통해 이 두가지 고체분산체의 경우 실로도신이 무정형태로 만들어진 것으로 사료되었다.
- 실로도신과 PVA간의 분자간 상호작용을 확인하기 위해 FT-IR을 이용해 스펙트럼 변화를 분석하였다. 먼저 약물인 실로도신의 스펙트럼을 분석하였을 때 1655 cm-1에서 C=O, 3340 cm-1에서 N-H stretching 및 3483m-1에서 O-H stretching등의 주요 피크를 가지는 것으로 확인되었다(Fig. 6) [21]. 원료 약물이 가진 특정한 피크들은 고체분산체의 스펙트럼에서 3340 cm-1의 N-H stretching, 3483m-1의 O-H stretching피크가 완만해지는데, 이는 실로도신과 PVA 간의 수소 결합 상호작용에 따른 것으로 추측할 수 있었다. 무정형 고체분산체의 경우 발생하는 분자 간의 수소 결합이 결정성 약물 실로도신보다 더 강할 수 있으므로 N-H stretching, O-H stretching이 약화되어 PVA으로 추정되는 완만하고 넓은 피크가 나타난 것으로 사료되었다[22]. 제조된 고체분산체들은 모두 실로도신이 가진 특정 스펙트럼에 큰 변화를 나타내지는 않았지만, 결정형의 변화가 없었던 SA-SD가 약물인 실로도신과 가장 유사한 스펙트럼을 나타낸 것으로 사료되었다.
- Fig. 7, Table 3의 실로도신 함유 고체분산체의 포화용해도 시험 결과와 Fig. 8의 동적 용해도 시험 결과에 따르면, 정제수에서의 포화용해도는 실로도신 약물(264.1 μg/mL)에 비하여 SA-SD(1099.6 μg/mL)는 약 4.2배, SW-SD(1593.4 μg/mL)는 약 6배, SE-SD(1975.4 μg/mL)는 약 7.5배 증가하였다. pH 6.8 용액의 경우에는 실로도신(1398.3 μg/mL)에 비하여 SA-SD(4181.8 μg/mL)는 약 3배, SW-SD(6537.8 μg/mL)는 4.7배, SE-SD(7246.9 μg/mL)는 약 5.2배 용해도가 증가하였다. 두 용액에서 모두 SA-SD, SW-SD, SE-SD순으로 SE-SD의 용해도가 가장 증가하였음을 알 수 있었다.
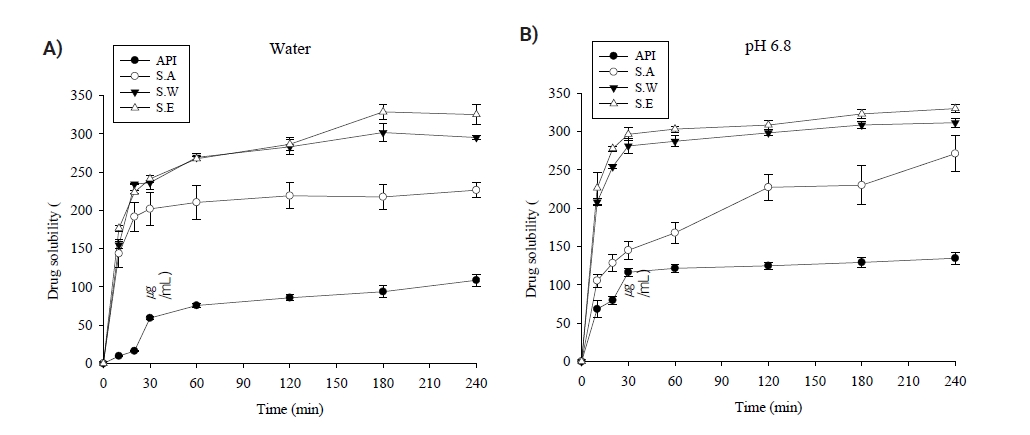
- 실로도신 원료약물 및 3종류의 고체분산체에 대한 동적 용해도 시험을 진행하였다. SA-SD는 정제수에서 실험 시 초기 10분 시점에 143.6 μg/mL으로 약물(9.7 μg/mL)대비 14.7배 상승되었으며, 60분에서 210.3 μg/mL 용해된 이후 용해도에 큰 변화를 보이지 않았다(Fig. 8A). pH 6.8용액에서는 더욱 천천히 용해가 되면서 초기 용해도는 실로도신 약물과 상당한 차이는 보이지 않았다. 120분에서 실로도신 약물 용해도 대비 1.8배(124.8 μg/mL vs 227.2 μg/mL) 향상되었으며 240분에서 271.0 μg/mL 용해되었다(Fig. 8B). 이는 SEM 결과와 PXRD결과로 확인 시, SA 고체분산체에는 약물의 결정형태를 유지하고 있기 때문에 상대적으로 천천히 용해되어 용해속도가 느릴 뿐만 아니라, 240분 시점에서도 다른 고체분산체 보다 낮은 용해도를 보인 것으로 사료된다. SW-SD는 SE-SD와 상당히 동일한 용해도 증가 양상을 보였다. 정제수와 pH 6.8용액에서 모두 초반 10분에서 30분까지 급격하게 용해되다가 이후에는 서서히 용해도가 증가하는 현상을 관찰할 수 있었다. 정제수에서 SW-SD와 SE-SD는 120분까지 동일하게 용해되다가 180분에 SW-SD 301.6 μg/mL, SE-SD 328.6 μg/mL으로 SE-SD가 높아졌으며(Fig. 8A), pH 6.8 용액에서는 초반 10분부터 240분까지 모두 SW-SD보다 SE-SD가 더 개선된 용해능을 보인 것으로 사료되었다(Fig. 8B). 이는 SW-SD의 SEM과 PXRD결과로 확인했을 때 실로도신이 친수성 고분자 PVA표면에 실과 같은 가느다란 무정형으로 존재함으로써 원료에 비하여 용해도가 유의적으로 증가하였지만, SE-SD에 비하여 입자크기의 감소, 표면적 향상 및 용해도 향상을 위해 첨가한 고분자와 약물의 접촉면적이 적기 때문에 SE-SD보다 낮은 용해능을 가진 것으로 사료되었다. 최종시점인 240분 시점을 기준으로, 정제수에서 SA-SD는 226.4 μg/mL, SW-SD는 295.1 μg/mL, SE-SD는 325.1 μg/mL으로 실로도신 원료(108.8 μg/mL) 대비 2.1배, 2.7배, 3배 향상된 용해도를 보였으며 pH 6.8용액에서는 SA-SD는 271.0 μg/mL, SW-SD 311.5 μg/mL, SE-SD 329.8 μg/mL으로 원료(134.7 μg/mL)와 비교하여 2배, 2.3배, 2.5배 향상됐으며, 정제수와 pH 6.8용액에서 모두 SE-SD, SW-SD, SA-SD 순으로 SE-SD가 가장 용해도가 개선되었다.
- 이와 같은 용해도 증가 현상은 FT-IR분석 결과 상, 실로도신과 PVA간의 수소 결합 상호작용과도 관련이 있을 것으로 사료되었다. FT-IR 분석에서 N-H stretching과 O-H stretching 피크의 완만해짐은 실로도신과 PVA 간의 강력한 수소 결합 상호작용을 나타내며, 이는 약물의 결정 구조를 무정형으로 변화시키는 주요 요인으로 판단하였다. 무정형 상태의 약물은 결정성 약물보다 더 높은 용해도를 가지므로, 이러한 구조 변화가 용해도 증가의 핵심으로 작용하였다. SW-SD와 SE-SD는 정제수와 pH 6.8 용액 모두에서 SA-SD보다 더 높은 용해도를 보였으며, 특히 SE-SD는 가장 높은 용해도를 나타냈다. 이는 FT-IR 분석에서 실로도신이 PVA와 강력한 수소 결합을 형성함으로 무정형 상태로 존재함을 시사하며, 무정형 상태로의 전이와 이에 따른 결정성 감소가 용해도 증가에 크게 기여했음을 의미한다. 특히, SE-SD의 경우 입자 크기 감소와 표면적 증가로 인해 더 높은 용해도를 보였음으로 사료되었다.
3. Results and discussion
- 본 연구에서는 다양한 고분자용액을 스크리닝하여 확인된 실로도신 용해도 향상능이 가장 우수한 고분자를 이용하여 세 가지 서로 다른 방법으로 제조한 실로도신 함유 고체분산체의 물리•화학적 특성 차이를 확인하여 보았다. 다양한 고분자 존재 하에 실로도신의 용해도 변화를 확인한 결과, 용해도 향상 값이 가장 우수한PVA를 고분자로 선정하였으며, 실로도신과 PVA가 함유된 고체분산체를 분무건조기술을 이용하여 제조하였다. 표면부착(SA), 용매 습윤(SW), 용매증발(SE)의 각기 다른 방법으로 제조된 고체분산체에 대하여 SEM을 통해 표면형태학적 특성을 확인했으며, PXRD를 통해 결정성을 확인하고, FT-IR을 이용해 제조된 고체분산체내 실로도신과 PVA 간 상호작용을 확인하였다. 최종적으로 포화용해도 시험 및 동적 용해도 시험을 진행하여 제조된 고체분산체의 용해도를 평가하였다. 제조된 고체분산체는 SE-SD, SW-SD, SA-SD 순으로 포화용해도가 향상되었으며, 동적 용해도 시험결과도 동일한 순서로 용해도 개선정도가 확인되었기 때문에, 세 가지 방법 중 용매증발(SE)법이 가장 우수한 가용화 기술임을 알 수 있었다. 따라서 이러한 고체분산체 제조방법을 이용한다면 공결정 형성, 염형성, 사이클로덱스트린 복합체화, SNEDDS 및 나노 파티클 방법보다 단순한 제조공정과 비용 효율적인 기술로서 실로도신 뿐만 아니라 다양한 난용성 약물의 생체이용률을 개선시킬 수 있을 것으로 판단되며, 이러한 가용화 기술이 환자의 복약 순응도가 개선된 경구 투여 제형의 개발에 활용될 수 있을 것으로 사료되었다.
4. Conclusion
-
Conflict of Interest Declaration
저자들은 이해상충관련 해당사항 없음을 선언합니다.
-
Author Information and Contribution
이수만, 송다영: 학생, 김경수: 교수
-
Acknowledgement
이 연구는 2024년도 경상국립대학교 발전기금재단 재원으로 수행되었음.
Article information
Fig. 2.Screening of polymer for enhancing silodosin solubility. Each value represents the mean ± S.D. (n=3).


Fig. 3.Appearance of silodosin-loaded solid dispersions: (A) silodosin, (B) surface-attached solid dispersion, (C) solvent-wetted solid dispersion, (D) solvent-evaporated solid dispersion.


Fig. 4.Scanning electron microscope images: (A) silodosin-API (× 10,000), (B) polyvinyl alcohol (× 1,000), (C) surface-attached (× 1,000), (D) surface-attached (× 5,000), (E) solvent-wetted (× 500), (F) solvent wetted (× 3,000), (G) solvent-evaporated (× 1,000), (H) solvent-evaporated (× 3,000).


Table 1.Solubility results of silodosin in 1 %(w/v) Polymer solutions.
Table 2.Formulation of silodosin-loaded solid dispersion.
| Formulation | SA-SD | SW-SD | SE-SD |
|---|---|---|---|
| Silodosin | 8 mg | 8 mg | 8 mg |
| PVA | 8 mg | 8 mg | 8 mg |
| (Water) | 600 g | - | 400 g |
| (Acetone) | - | - | 200 g |
| (Ethanol) | - | 600 g | - |
| Assay (%) | 105.6 | 68.6 | 95.9 |
Table 3.Solubility results in pH 6.8 solution and water.
- 1. B. Chughtai, J. C. Forde, D. D. M. Thomas, L. Laor, T. Hossack, H. H. Woo, A. E. Te and S. A. Kaplan: Nat. Rev. Dis. Primers., 2 (2016) 1.
- 2. M. Rossi and T. Roumeguère: Drug Des. Devel Ther., 4 (2010) 291.
- 3. S. Dhiman, B. D. Kurmi and V. Asati: Sep. Sci. Plus., 6 (2023) 2200117.
- 4. A. Alhayali, P. R. Vuddanda and S. Velaga: J. Drug Delivery Sci. Technol., 53 (2019) 101122.Article
- 5. Y. N. Gavhane and A. V. Yadav: Saudi Pharm J., 20 (2012) 331.Article
- 6. V. R. Vemula, V. Lagishetty and S. Lingala: Int. J. Pharm. Sci. Rev. Res., 5 (2010) 41.
- 7. K. Sekiguchi and N. Obi: Chem. Pharm. Bull. (Tokyo)., 9 (1961) 866.Article
- 8. P. Pandi, R. Bulusu, N. Kommineni, W. Khan and M. Singh: Int. J. Pharm., 586 (2020) 119560.Article
- 9. K. B. Mir and N. A. Khan: Int. J. Pharm. Sci. Res., 8 (2017) 2378.
- 10. M. A. Alam, R. Ali, F.I. Al-Jenoobi and A. M. Al-Mohizea: Expert Opin. Drug Deliv., 9 (2012) 1419.Article
- 11. Y.-J. Park, D.-H. Oh, Y.-D. Yan, Y.-G. Seo, S.-N. Lee, H.-G. Choi and C.-S. Yong: J. Pharm. Invest., 40 (2010) 97.Article
- 12. E.-J. Kim, M.-K. Chun, J.-S. Jang, I.-H. Lee, K.-R. Lee and H.-K. Choi: Eur. J. Pharm. Biopharm., 64 (2006) 200.Article
- 13. J.-S. Choi, S.-E. Lee, W.S. Jang, J.C. Byeon and J.-S. Park: Mater Sci Eng C., 90 (2018) 387.Article
- 14. M.-J. Choi, M. R. Woo, K. Baek, J. H. Park, S. Joung, Y. S. Choi, H.-G. Choi and S. G. Jin: Mol. Pharmaceutics., 20 (2023) 4153.ArticlePDF
- 15. H. J. Choi and K. S. Kim: J. Life Sci., 31 (2021) 502.
- 16. H.-J. Choi, J.-G. Lee and K.S. Kim: JKAIS., 22 (2021) 323.
- 17. J.-G. Lee, Development of novel Enzalutamide tablet formulation With enhanced solubility and bioavailability. Graduate School of Gyeongsang National University, Jinju (2022) 5.
- 18. Y. Umemoto, S. Uchida, T. Yoshida, K. Shimada, H. Kojima, A. Takagi, S. Tanaka, Y. Kashiwagura and N. Namiki: J. Drug Delivery Sci. Technol., 55 (2020) 101401.Article
- 19. R. Nagarkar and J. Patel: Acta Sci. Pharm. Sci., 3 (2019) 34.
- 20. A. Paudel, Z. A. Worku, J. Meeus, S. Guns and G. Van den Mooter: Int. J. Pharm., 453 (2013) 253.Article
- 21. B. Supriya, N. Babu, B. Sai and G. Pavani: YMER., 21 (2021) 344.Article
- 22. V. Tantishaiyakul, N. Kaewnopparat and S. Ingkatawornwong: Int. J. Pharm., 181 (1999) 143.Article
References
Figure & Data
References
Citations
Citations to this article as recorded by 

Comparison and Characterization of Silodosin-loaded Solid Dispersions Prepared by Various Solid Dispersion Preparation Methods
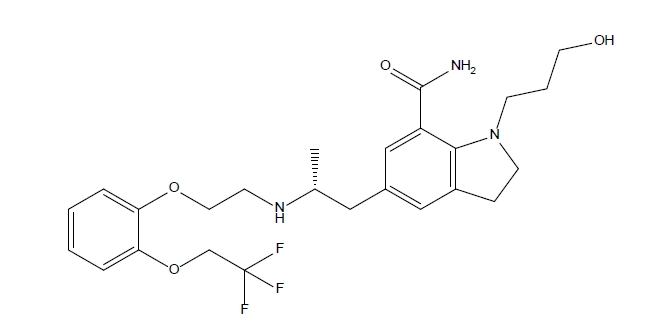




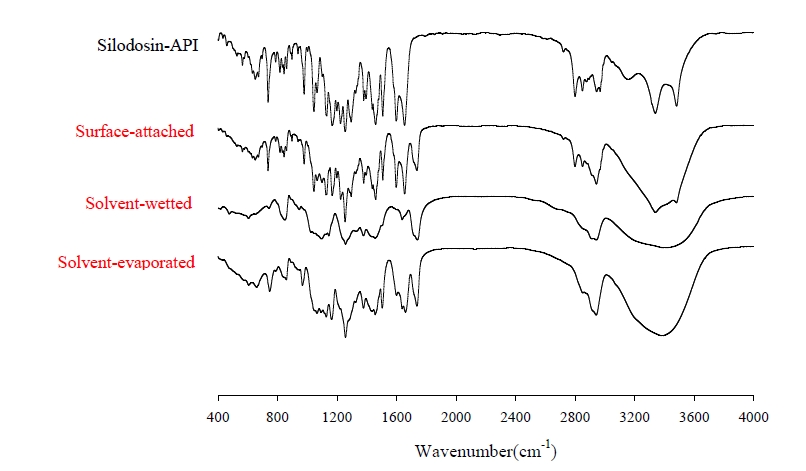


Fig. 1. Structure of silodosin.
Fig. 2. Screening of polymer for enhancing silodosin solubility. Each value represents the mean ± S.D. (n=3).
Fig. 3. Appearance of silodosin-loaded solid dispersions: (A) silodosin, (B) surface-attached solid dispersion, (C) solvent-wetted solid dispersion, (D) solvent-evaporated solid dispersion.
Fig. 4. Scanning electron microscope images: (A) silodosin-API (× 10,000), (B) polyvinyl alcohol (× 1,000), (C) surface-attached (× 1,000), (D) surface-attached (× 5,000), (E) solvent-wetted (× 500), (F) solvent wetted (× 3,000), (G) solvent-evaporated (× 1,000), (H) solvent-evaporated (× 3,000).
Fig. 5. Powder X-ray diffraction patterns of silodosin, solid dispersions and polyvinyl alcohol.
Fig. 6. Fourier transform infrared spectra of silodosin and solid dispersions.
Fig. 7. Saturated solubility in (A) water and (B) pH 6.8 solution.
Fig. 8. Kinetic solubility in (A) water and (B) pH 6.8 solution.
Fig. 1.
Fig. 2.
Fig. 3.
Fig. 4.
Fig. 5.
Fig. 6.
Fig. 7.
Fig. 8.
Comparison and Characterization of Silodosin-loaded Solid Dispersions Prepared by Various Solid Dispersion Preparation Methods
| 1 %(w/v) Polymer | Concentration.(μg/mL) | |
|---|---|---|
| Mean | ±SD | |
| Water | 264.1 | 0.6 |
| Na-alginate | 114.8 | 3.9 |
| Dextran | 180.2 | 12.4 |
| HPC-L | 214.2 | 12.9 |
| Na-CMC | 215.1 | 36.8 |
| HPMC 2910 P-603 | 252.0 | 36.0 |
| HPMC 2910 P-645 | 254.7 | 7.1 |
| PVP K30 | 316.5 | 50.4 |
| β -Cyclodextrin | 496.1 | 13.3 |
| Carbopol 934 | 576.4 | 42.9 |
| Gelatin | 605.0 | 5.7 |
| Kollidon VA64 | 679.0 | 7.7 |
| Carbopol 941 | 866.1 | 59.5 |
| PVA | 1063.7 | 16.6 |
| Formulation | SA-SD | SW-SD | SE-SD |
|---|---|---|---|
| Silodosin | 8 mg | 8 mg | 8 mg |
| PVA | 8 mg | 8 mg | 8 mg |
| (Water) | 600 g | - | 400 g |
| (Acetone) | - | - | 200 g |
| (Ethanol) | - | 600 g | - |
| Assay (%) | 105.6 | 68.6 | 95.9 |
| Concentration.(μg/mL) |
||||
|---|---|---|---|---|
| Silodosin |
SA-SD |
SW-SD |
SE-SD |
|
| Mean ± SD | Mean ± SD | Mean ± SD | Mean ± SD | |
| Water | 264.1 ± 0.6 | 1099.6 ± 36.7 | 1593.4 ± 16.7 | 2059.9 ± 185.1 |
| pH 6.8 | 1398.3 ± 42.7 | 4181.8 ± 32.2 | 6537.8 ± 230.7 | 7246.9 ± 292.2 |
Table 1. Solubility results of silodosin in 1 %(w/v) Polymer solutions.
Table 2. Formulation of silodosin-loaded solid dispersion.
Table 3. Solubility results in pH 6.8 solution and water.
Table 1.
Table 2.
Table 3.
TOP
 KPMI
KPMI



 ePub Link
ePub Link Cite this Article
Cite this Article








