Articles
- Page Path
- HOME > J Powder Mater > Volume 32(5); 2025 > Article
-
Research Article
백운석으로부터 침상형 513 MHSH 및 Mg(OH)2 합성 및 형상제어 - 김지연1,2, 심현승1, 황성주2, 김유진1,*
- Synthesis and Morphology Control of Needle Type 513 MHSH and Mg(OH)2 from Dolomite
- Jiyeon Kim1,2, HyunSeung Shim1, Seong-Ju Hwang2, YooJin Kim1,*
-
Journal of Powder Materials 2025;32(5):399-405.
DOI: https://doi.org/10.4150/jpm.2025.00227
Published online: October 31, 2025
1한국세라믹기술원 엔지니어링 소재 센터
2연세대학교 배터리공학과
1Engineering Materials Center, Korea Institute of Ceramic Engineering and Technology, Icheon 17303, Republic of Korea
2Department of Battery Engineering, Yonsei University, Seoul 03722, Republic of Korea
- *Corresponding author: YooJin Kim E-mail: yjkim@kicet.re.kr
© The Korean Powder Metallurgy & Materials Institute
This is an Open Access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/4.0/) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
- 371 Views
- 7 Download
Abstract
- 513 magnesium hydroxide sulfate hydrate (MHSH) and Mg(OH)₂ were synthesized by controlling the pH and concentration using a domestic resource, dolomite (CaMg(CO3)2), as the raw material. The MgSO₄ was extracted by treating dolomite with sulfuric acid under various conditions. Hexagonal plate-shaped Mg(OH)₂ and needle-like 513 MHSH were synthesized under the hydrothermal condition. The morphology of the synthesized materials was controlled by adjusting the pH (SO42-/OH- ratio) and hydrothermal reaction time. As the pH of the solution increased, the formation of plate-like structures became dominant, whereas lower pH values (higher SO42- concentration) led to needle-like forms. The results of the 513 MHSH, which was synthesized using reagents and sea bittern, are consistent with the synthesis conditions, and we observed changes in the length and aspect ratio of the needle-shaped structure in response to adjusting the hydrothermal reaction time.
- 마그네슘(Mg)은 경량소재로, 금속 Mg 및 세라믹 소재(산화마그네슘 (MgO), 수산화마그네슘 (Mg(OH)2) 등)으로 다양하게 사용되고 있다[1]. 마그네슘 성분은 자연에 풍부하게 존재하는 광물 Magnesite (MgCO3)과 해(간)수로 부터 추출하며[2-4] 다른 원료 중 하나인 백운석은 한국에 많이 매장되어 가격적으로 이점이 존재하지만, Ca 와 Mg 비율이 1:1로 이루어져 있기 때문에, 효율적인 Ca2+이온의 분리가 필요하다. Ca2+와 Mg2+의 화학적 특성이 유사함에도 불구하고 이온 크기와 전기음성도의 차이로 발생하는 반응성의 차이로 인해 염산(HCl) 또는 sucrose (C12H22O11)을 이용해 백운석으로부터 Mg을 추출할 수 있다[5-7]. 간수 및 백운석에 포함되어 있는 Ca2+ 이온을 제거하기 위해 황산 (H2SO4), 황산마그네슘 (MgSO4)을 활용하여 용해도 차이를 이용해 황산칼슘 (CaSO4)를 분리제거 후 MgSO4용액을 얻을 수 있다[8]. 추출한 MgSO4용액에 염기성 침전제를 첨가하여 Mg(OH)₂을 얻을 수 있다[8]. Mg(OH)₂ 은 다양한 산업에서 널리 사용되는 Mg계 물질 중 하나로, 높은 열분해온도로 난연제로서 사용되며[9-11], 판상 형태일 경우 우수한 기계적 물성도 갖는다[12].
- 기능성 화합물인 침상형 수산화 마그네슘 황산염 수화물[약칭 MHSH, xMg(OH)2•yMgSO4•zH2O (x-y-z 상;)]은 낮은 비중 (2.3g/cc)을 가지고 있기 때문에 수지, 필러, 섬유 복합재 및 보강재로 사용되는 등 실용적인 응용분야에서 주목받고 있다[13-15]. Mg(OH)2 층상 구조 사이의 SO42- 이온 결합 구조로 인해 513 MHSH는 일반적인 탈수 온도보다 높은 온도에서 물 분자가 방출되어 난연제로 사용할 수 있다[9, 11, 16]. 고순도로 기능성소재인 513 MHSH (5Mg(OH)₂•MgSO₄•3H₂O) 합성하기 위해서는 MgSO4 과 암모니아를 이용해 SO42-/OH-의 농도 및 비율 조절과 pH 제어가 필요하며 이방성을 높이기 위한 수열반응조건은 고가이기 때문에[17-23], 백운석, 간수 등의 국내자원을 활용해 Mg 추출 및 수산화마그네슘을 생산하는 것이 필요하다. 백운석에 포함되어 있는 Ca2+ 이온을 효과적으로 분리하고 남은 MgSO4 용액을 평가하고, 암모니아의 양 및 다양한 조건을 변경하여 513 MHSH 합성조건을 찾고, 저가의 광석원료로부터 기능성소재의 합성을 통해 소재의 응용범위를 넓힐 수 있다.
1. Introduction
- 2.1 재료 및 분석기기
- 백운석은 K사에서 공급받아 실험에 사용하였다. H2SO4 (대정화금, 10 wt%)은 증류수로 희석해 원하는 농도로 제조하여 사용하였다. 513 MHSH 합성에 이용한 시약은 NH4OH (덕산화학, 28 %)를 사용하였다. 원료와 합성된 결과물은 XRD (X-ray powder diffraction, Model D/Max 2500, Rigaku, 일본), XRF (X-ray fluorescence, Model S1 TITAN, Bruker, 미국) 와 ICP-OES (Inductively Coupled Plasma Optical Emission Spectrometry, Model SPECTRO ARCOS, SPECTRO Analytical Instruments, 독일)로 결정상 및 성분을 분석하고, SEM (Scanning Electron Microscope, Model JSM-6390, JEOL, 일본)으로 형상 및 침상길이를 분석하였다.
- 2.2 백운석으로부터 MgSO4 용액 추출
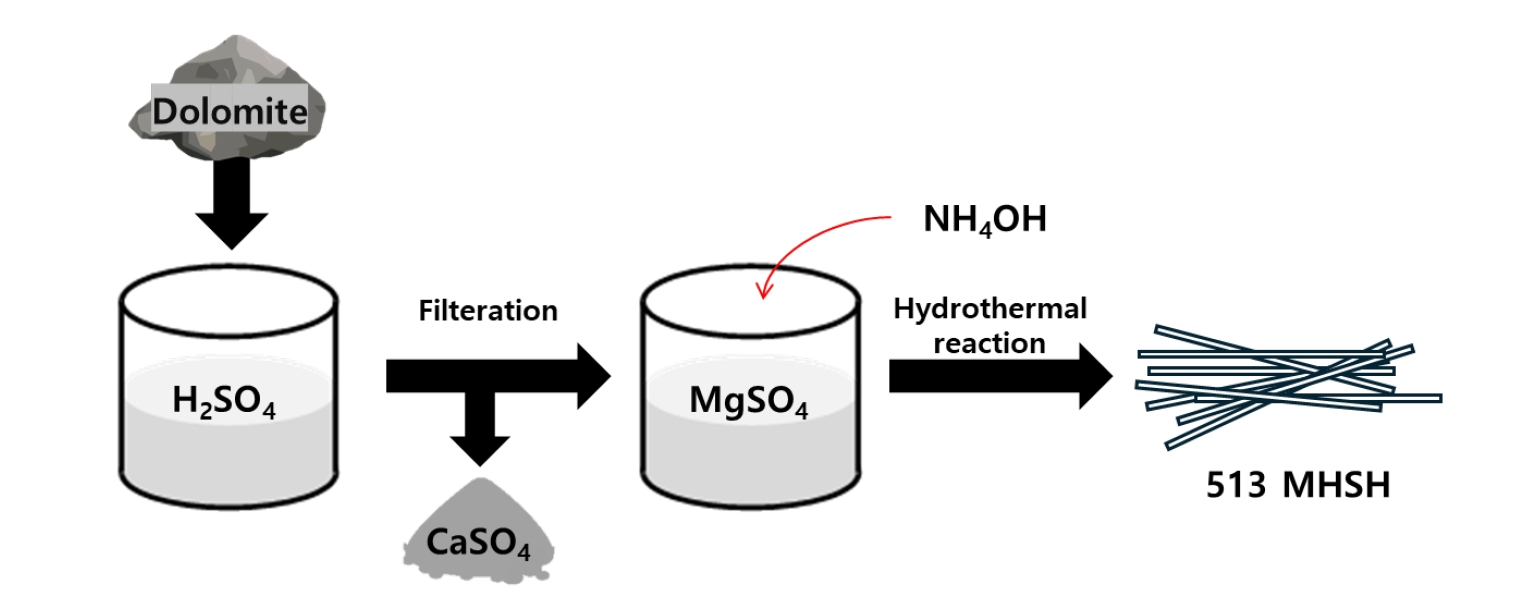
- 백운석 (CaMg(CO3)2)을 Mg 전구체로 이용하기 위해서는 백운석 내에 존재하는 Mg을 제외한 불순물 성분을 최소화하는 것이 필요하며, 백운석 내 Mg 다음으로 많은 성분인 Ca2+이온을 분리하고 제거하기 위해 황산을 첨가하여 Ca와 Mg의 용해도 차이를 이용하여 분리제거 하였다. 용해도가 높은 MgSO4는 용액에서 이온의 형태로 존재하는 반면 용해도가 낮은 CaSO4는 침전되어 용액으로부터 분리가 가능하다.
- CaMg(CO3)2 + 2H2SO4 → CaSO4↓ + MgSO4 + 2CO2 ↑ + 2H2O
- CO32− + H2O → CO2 ↑ + 2OH−
- 백운석에 황산을 첨가할 때 기포가 발생하는 것을 눈으로 확인할 수 있었다. 발생하는 기체는 이산화탄소 (CO2)로 충분한 반응시간을 확보해 CO2가 용액에 용존 되지 않고 기체형태로 제거될 수 있도록 하는 것이 필요하다. 용해성이 적은 탄산염은 MHSH 성장에 지속적으로 OH-를 제공할 수 있기 때문에 CO2를 제거함으로써 반응은 평형에 도달하지 못하고 1차원 MHSH 성장을 계속 할 수 있다[24]. 백운석의 양(g)과 첨가하는 황산의 농도(wt%) 및 양(ml)을 조절하여 다양한 조건에서 MgSO4 용액을 추출하였다[8]. 백운석으로부터 Mg 전구체를 얻기 위해 백운석에 황산을 첨가한 후 magnetic stirrer를 이용하여 4시간 동안 교반 하였다. 거름종이를 이용하여 CaSO4 침전물과 MgSO4 용액을 분리하고, 분리한 MgSO4 용액을 XRF로 분석하였다. Table 1은 다양한 조건에서 백운석과 황산을 반응하여 합성된 MgSO4 용액 추출조건을 나타낸 표이다[25]. 513 MHSH 합성에서는 MgSO4 와 OH-농도 비율이 중요하며[17-23], 특히 MgSO4의 농도가 중요하다. 낮은 MgSO4 농도는 product를 얻을 수 없기 때문에 MgSO4 농도를 백운석과 황산의 양을 통해 조절해야 한다. 다음은 최적의 MgSO4 농도를 얻기 위해 황산농도와 양을 조절한 실험조건이다. Condition Ⅰ, Ⅱ은 백운석 10g에 각각 10% 황산 100ml와 5% 황산 200ml를 첨가해 MgSO4 용액을 추출하였다. Condition Ⅰ과 Ⅱ는 백운석내 Mg2+이온과 황산의 SO42- 이온의 반응비가 1:2인 조건이며, 일반적으로 Ca의 반응성이 Mg보다 높기 때문에 백운석 내 Mg2+이온과 SO42- 이온이 반응하여 MgSO4가 충분히 생성될 수 있도록 하는 적절한 농도를 선정했다[26]. Condition Ⅲ, Ⅳ는 백운석 10g에 각각5% 황산 100ml, 50ml를 가해 MgSO4 용액을 추출하였으며, 이는 다양한 황산농도와 양에 따른 백운석에 함유되어있는 Ca2+이온을 효율적으로 분리하여 제거하기 위한 실험이다.
- Fig. 1은 백운석을 이용하여 513 MHSH를 합성하는 과정을 나타낸 모식도이다. 513 MHSH를 합성하는 과정은 두 단계로 구분된다. 첫번째 단계는 백운석으로부터 Ca성분을 제거하여 MgSO4 용액을 만드는 과정이며, 두 번째 단계는 전과정에서 얻은 MgSO4 용액에 염기성 촉매를 첨가하고, 수열반응을 통해 513 MHSH 분말을 얻는 과정이다. 이때 수열반응은 180 ℃로 고정시켰다[17-23].
- 2.3 염기성 침전제의 양에 따른 513 MHSH 합성
- 우리는 과거 513 MHSH 합성 연구결과를 바탕으로 MgSO4와 염기성 침전제의 양을 조절하여 513 MHSH 합성조건을 찾을 수 있었다. 황산과 백운석과의 반응을 통해 얻은 MgSO4 용액 20ml에 암모니아를 첨가하여 300rpm에서 magnetic stirrer를 이용하여 30분간 교반을 진행하였다. 용액을 테프론 용기에 옮겨 180 ℃에서 수열반응을 진행하였다. 반응이 끝나고 8000 rpm에서 10분간 원심분리하여 얻은 분말을 증류수를 이용해 2회 세척한 후 건조시켰다. 합성한 513 MHSH는 XRD를 통해 분석하고, SEM을 통해 합성 물질의 형상을 확인하였다. Table 2은 다양한 염기성 침전제의 첨가량을 조절하여 513 MHSH의 합성조건을 나타낸 표이다.
- 2.4 수열합성 시간에 따른 513 MHSH 관찰
- 백운석으로부터 추출한 MgSO4 용액 20ml에 4M NH4OH 13ml를 가하고 magnetic stirrer를 이용하여 30분간 교반을 진행하였다. 용액을 테프론 용기에 옮겨 180 ℃에서 반응시간 (12-72h)을 다르게 진행하여 수열반응을 진행하였다. 반응이 끝나고 8000 rpm에서 10분간 원심분리하여 얻은 분말을 증류수를 이용해 2회 세척한 후 건조시켰다. 수득한 513 MHSH는 XRD를 통해 물질을 확인하고, SEM을 통해 합성 물질의 길이 및 형상을 확인하였다. Table 3은 수열반응시간에 따른 513 MHSH의 합성조건을 나타낸 표이다.
2. Experimental Section
- 3.1 백운석 성분 분석결과
- 실험에 사용된 백운석은 K사 제품으로 가장 불순물 함량(특히 Si)이 적었다. 공급받은 K사 제품(1-5 μm)은 로터리밀을 이용하여 1 ㎛ 이하로 분쇄하여 분말 형태로 실험에 사용하였다. Table 4은 실험에 사용된 백운석의 ICP 데이터이다. CaO는 30.5 wt%, MgO는 21.7 wt%로 백운석의 이론적 화학 조성인 CaCO3와 MgCO3 비율이 약 1대 1 존재하고 있음을 확인하였다. 백운석을 Mg 전구체로 이용하기 위해서는 Ca 성분과 Mg 성분을 분리하는 과정이 필요하다. 이외에도 백운석 내에는 소량의 금속 불순물 (SiO2, Al2O3, Fe2O3)이 존재하였다.
- 3.2 다양한 조건으로부터 추출한 MgSO4 용액
- 다음은 백운석에 산을 첨가하여 얻은 화학반응식을 나타낸 것이다.
- CaMg(CO3)2(s) + H+ → Mg2+ + HCO3–
- MgCO3(s) + H+ → Mg2+ + HCO3–
- CaMg(CO3)2(s) + Mg2+ → Ca2+ + 2MgCO3(s)
- Ca가 충분히 제거되기 위해서는 백운석과 수소이온의 충분한 반응 시간이 필요하기 때문에 magnetic stirrer를 사용하여 용액을 균일하게 혼합하였으며, 교반 시간은 4시간으로 설정하였다. 4시간 교반 하는 경우, 백운석이 황산과 모두 반응하는 것을 확인할 수 있었다[8].
- Table 5는 백운석의 양을 고정하고 다양한 농도의 황산을 이용해 얻은 MgSO4 용액의 결과를 XRF로 분석한 결과를 나타낸 표이다. 백운석에 첨가한 황산의 양이 감소할수록 (Condition Ⅱ - Ⅳ) Mg 비율은 증가하는 경향성을 보이나 유사한 값을 보이고, Ca의 비율은 감소하는 경향성을 보였다. 이는 Mg/Ca 비를 증가시켜 고순도 물질 합성에 더 유리한 환경을 제공할 것이다. 동일 범위에서 백운석 MgSO4 용액 내에서 SO42- 이온의 비율은 일시적으로 증가하다가 감소하는 경향을 보였다. 물의 이온화의 영향으로 MgSO4 용액에 H2SO4를 많이 첨가하면, 백운석 표면에 흡착된 SO42- 이온이 물 분자와 백운석 표면의 Ca 사이트 간의 상호 작용을 방해하기 때문이다[27, 28]. Condition Ⅱ 와 Ⅲ 에서는 과량의 SO42- 이온이 백운석내 금속 이온 추출을 방해하여 발생한 결과라고 해석할 수 있다. 또한 513 MHSH 합성시 MgSO4 용액의 농도가 매우 중요하기 때문에 [17-23] MgSO4 농도조건을 비슷하게 하기 위해서 백운석 10g과 5 wt% 황산 50ml를 반응시켜 제조한 용액 (Condition Ⅳ)을 제조하였다. 따라서 백운석을 이용한 513 MHSH 합성 전구물질로 사용되는 MgSO4 용액 제조 시 Condition Ⅳ를 이용하는 것이 적합하다고 판단하였다.
- 3.3 513 MHSH 합성
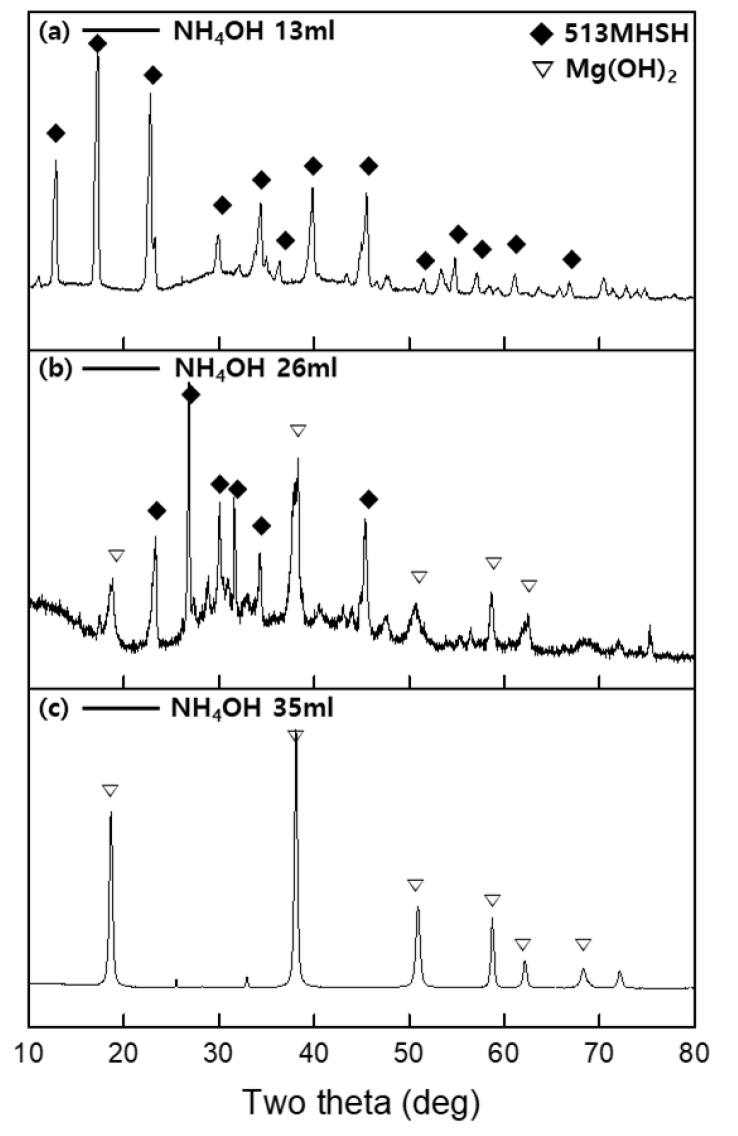
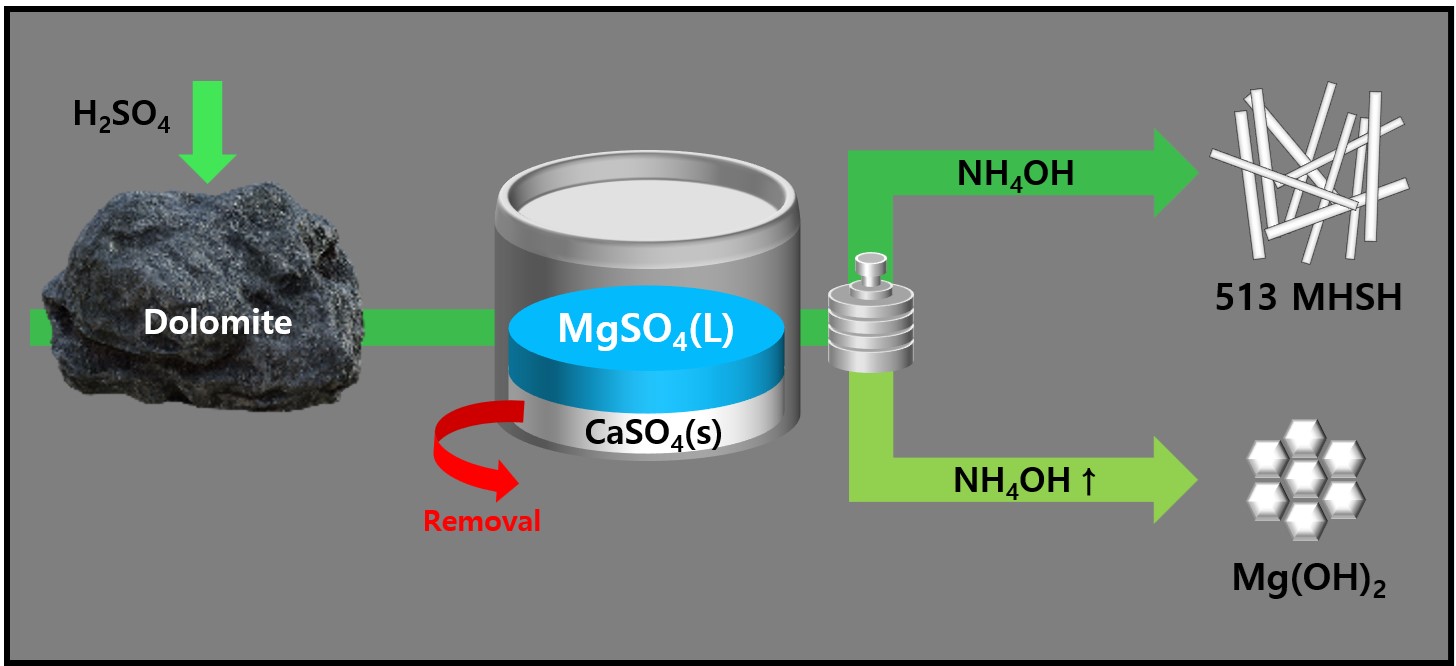
- Condition Ⅳ 조건으로 추출한 MgSO4 용액에 4M NH4OH의 양을 다르게 하여 가하면서 513 MHSH의 합성여부를 관찰하였다. Fig. 2와 Fig. 3은 백운석에서 추출한 MgSO4와 NH4OH를 사용하여 얻은 제품의 SEM 이미지와 XRD 데이터 이다. Fig. 2에서 4M NH4OH 용액 13ml를 첨가한 제품에서 직경 약 3μm, 길이 약 200-300 μm의 바늘 모양 513 MHSH 구조가 관찰 되었다(Fig. 2a). 이는 시약 및 간수를 이용하여 513 MHSH를 합성하는 경우 관찰가능한 물질의 스펙과 유사한 값이다[29]. 4M NH4OH 용액 26ml를 첨가한 샘플에서는 Mg(OH)2와 513 MHSH가 혼합되어 존재하였으며, 기존 합성연구와 비슷한 결과를 보였다(Fig. 2b). 4M NH4OH용액 35ml를 첨가한 제품에서 약 400nm 크기의 판상형태의 Mg(OH)2가 확인되었다(Fig. 2c). 400nm 급 Mg(OH)₂ 간수를 활용해서 50 nm Mg(OH)₂을 얻고 다시 수열반응을 통해 입자 성장 시킨 400nm Mg(OH)₂ 크기 및 형상이 유사함을 확인하였다[17]. 적절한 비율의 MgSO4 용액에 암모니아를 첨가하고, 수열반응 진행 시 400 nm 육각판상 물질이 합성됨을 알 수 있었다. Fig. 3의 XRD 데이터를 통해 MgSO4 용액과 반응하는 NH4OH의 양이 증가함에 따라 Mg(OH)2의 비율이 증가하고 513 MHSH의 비율은 감소됨을 XRD를 통해 확인할 수 있다. Fig. 3a의 생성물 회절 피크는 513 MHSH (PDF# 00-011-0069)의 표준 회절 패턴과 일치했으며, 다른 불순물 피크는 관찰되지 않았다. 2θ = 12.95°, 17.32°, 22.86°에서 3개의 강한 회절 피크를 보였으며, 이는 513 MHSH XRD peak에서 각각 [2,0,1], [2,0,2], [2,0,3] 평면에 기인하는 값이다. b - 축에 수직인 결정면 (예. [h,0,l]) 의 peak가 강한 intensity를 보이므로 침상 구조이며, XRD 패턴에서 513 MHSH peak만이 관찰되었으므로 Mg(OH)₂ 없이 고순도 513 MHSH가 합성된 것을 확인할 수 있었다. 반면 Fig. 3c에서는 Mg(OH)2 peak의 표준 회절 피크(JCPDS 44–1482)만을 확인하였다. 2θ = 18.59°, 37.97°, 50.81°, 58.56°에서 4개의 강한 회절 피크를 보였으며, 이는 Mg(OH)2 XRD peak에서 각각 [0,0,1], [1,0,1], [1,0,2], [1,1,0] 평면에 기인하는 값이다. Fig. 3b에서는 513 MHSH peak와 Mg(OH)2 peak가 비슷한 비율로 관찰되었다. MgSO4 용액에 첨가된 암모니아의 양이 증가할수록 용액 내 OH-이온의 농도가 증가하면서 중간생성물인 Mg2, MgOH+가 SO42− 이온과 반응하기보다는 OH− 이온과 반응하여 쉽게 Mg(OH)2가 형성되기 때문이다[20].
- 3.4 수열합성 시간에 따른 513 MHSH 형상 변화 연구
- Condition Ⅳ 조건으로 추출한 MgSO4 용액 20 ml에 4M NH4OH 13ml를 가한 후 수열 합성시간을 다르게 하면서 513 MHSH의 합성 및 형상을 관찰하였다. Fig. 4는 백운석을 통해서 MgSO4와 NH4OH를 사용하여 합성된 물질의 SEM 이미지를 보여준다. 12시간 수열합성을 진행한 샘플에서 직경 약 2~3μm, 길이 40 μm의 침상형 물질이 관찰되었으며, 24시간동안 수열합성을 진행한 경우에서는 직경 약 3μm, 길이 70-90 μm의 침상형 물질이 관찰되었다(Fig. 4a, 4b). 72시간동안 수열합성을 진행한 샘플에서는 지름 약 3μm, 길이 200-300 μm 의 침상형 물질이 관찰되었다(Fig. 4c). 이는 48시간 수열반응을 진행했을 때와 유사한 스펙으로 수열 합성시간이 길수록 합성된 합성 된 물질의 침상길이는 증가하는 것을 확인할 수 있었다. 수열반응시간이 48시간을 초과하는 경우, 길이 증가에는 큰 영향을 주지 않는 것을 확인하였다. 수열 합성시간이 12시간에서 72시간으로 증가함에 따라 종횡비(Aspect ratio)도 15에서 50으로 증가하였다. 첨가제의 종횡비가 높아지면, 난연첨가제로 적용 시 단열막 효과를 강화시켜, 열과 산소로부터 보호하고 연소속도를 늦추는데 도움을 준다고 알려져 있다[30-33]. 과거 연구로부터 얻은 침상물질보다 본 연구를 통해 합성한 침상물질의 길이가 더 길었으며, 유사한 종횡비를 보였다. (과거 연구 결과: 10-100 μm)[34] 난연첨가제의 종횡비가 높아지는 경우, 낮은 농도의 충진량에서도 난연성에 도움을 준다고 알려져 있으며, 이는 재료 비용 절감과 가공성 향상에 기여할 것이다[35]. 수지적용 테스트를 통해 종횡비에 따른 난연성 개선효과를 현재 연구 중에 있다.
3. Results and Discussion
- 본 연구에서는 국내 자원인 백운석을 이용하여 Mg(OH)2와 513 MHSH 합성과 형상제어를 하였다. Mg 공급원인 백운석에는 Ca 또한 존재하므로, 황산을 첨가해 CaSO4 와 MgSO4의 용해도 차이를 이용하여 Ca2+이 제거된 MgSO4 용액을 제조하였다. Mg2+이온 대비 과하거나 너무 적은 SO42- 이온 비율은 513 MHSH의 합성을 방해하는 요인으로 작용할 수 있다. 백운석 10g 당 5wt% 황산 50ml를 가한 후 300rpm에서 4시간 교반 시켜서 MgSO4 용액을 제조하고, 암모니아를 이용하여 OH- 와 SO42- 비율을 조절한 후 수열조건에서 513 MHSH를 얻을 수 있었다. 용액의 pH에 따라 합성된 Mg(OH)₂ 과 513 MHSH의 고순도 화합물을 얻을 수 있으며, 이는 간수를 이용해 합성된 Mg(OH)₂ 과 513 MHSH과 비슷한 결과이다. MgSO4 용액에 암모니아를 가한 용액을 수열반응 12시간 이후부터 침상형 물질이 관찰되었으며, 수열반응시간을 오래할수록 침상길이가 증가하는 경향성을 보이나 48시간 이후 비슷한 결과를 나타내었다. 특히 백운석으로 합성한 513 MHSH의 지름 및 두께는 지름 3 μm, 길이 약200–300 μm의 침상구조를 갖는 물질을 합성하였으며, 시약으로부터 합성한 물질 및 시제품의 지름 및 두께보다 두꺼운 것을 확인하였으나 종횡비 값(약 50)은 유사하였다.
- 이번 연구에서는 국내자원인 백운석으로부터 얻은 MgSO4 원료의 분말 정제/건조 과정 없이 용액상태에서 pH를 조절함으로써 513 MHSH를 합성할 수 있었으며, 이는 저가의 공정과정개발을 통해 고부가치 기능성 소재를 합성하고, 국내원료 자립화에 기여하며 내화재용, 난연재용 원료 산업에 기여할 수 있을 것으로 기대된다.
4. Conclusion
-
Funding
This work was supported by a grant from “A pilot project for domestic production of magnesium based ceramic raw material” (20016812) funded by the Ministry of Trade, Industry and Energy (MOTIE), Republic of Korea.
-
Conflict of Interest
The authors have no conflicts of interest to declare.
-
Data Availability Statement
The datasets used during the current study available from the corresponding author on reasonable request.
-
Author Information and Contribution
Jiyeon Kim: Ms.D candidate; writing–review & editing, writing–original experiment
HyunSeung Shim: Intern researcher; writing–review & editing & draft
Seong-Ju Hwang: Professor; supervision
YooJin Kim: PhD; writing–original draft, funding acquisition, project administration, supervision
-
Acknowledgments
None.
Article information


| Condition | Dolomite (g) | H2SO4 (wt%) | H2SO4 (mL) |
|---|---|---|---|
| Ⅰ | 10 | 10 | 100 |
| Ⅱ | 10 | 5 | 200 |
| Ⅲ | 10 | 5 | 100 |
| Ⅳ | 10 | 5 | 50 |
| Sample | Dolomite(g) | H2SO4 (wt%) | H2SO4 (mL) | MgSO4 (mL) | 4M NH4OH | Reaction time (h) | Reaction temperature (℃) |
|---|---|---|---|---|---|---|---|
| 1 | 10 | 5 | 50 | 20 | 13 | 48 | 180 |
| 2 | 10 | 5 | 50 | 20 | 26 | 48 | 180 |
| 3 | 10 | 5 | 50 | 20 | 35 | 48 | 180 |
| Sample | MgSO4 (mL) | 4M NH4OH (mL) | Reaction time (h) | Reaction Temperature (℃) |
|---|---|---|---|---|
| 4 | 20 | 13 | 12 | 180 |
| 5 | 20 | 13 | 24 | 180 |
| 6 | 20 | 13 | 72 | 180 |
| Component (wt %) | |||||
|---|---|---|---|---|---|
| CaO | MgO | SiO2 | Al2O3 | Fe2O3 | Total (Except for Mg, Ca) |
| 30.5 | 21.7 | 0.22 | 0.12 | 0.09 | 0.43 |
- 1. S. Dühnen and J. Betz: Small Methods, 4 (2020) 2000039.Article
- 2. J. Chen, L. Lin, Y Song and L Shao: J. Cryst. Growth, 311 (2009) 2405.Article
- 3. N. I. Um and T. Hirato: Hydrometallurgy, 146 (2014) 144.
- 4. T. Y. Cho and M. J. Kim: Resour. Recycl., 25 (2016) 32.
- 5. Y. Abali and S. U. Bayca: Physicochem. Probl. Miner. Process., 46 (2011) 253.
- 6. M.R. Abeywardena and R.K.W.H.M.K. Elkaduwe: Adv. Powder Technol., 31 (2020) 269.Article
- 7. H. Yoon and S. Yoon: Chem. Eng. J., 469 (2023) 143684.Article
- 8. H. Shim, J. Kim, A. Choi, N. Oh and Y. Kim: J. Powder Mater., 32 (2025) 122.Article
- 9. H. Gui, X. Zhang, W. Dong, Q. Wang, J. Gao, Z. Song, J. Lai, Y. Liu, F. Huang and J. Qiao: Polymer, 48 (2007) 2537.Article
- 10. A. Bhatti, D. Dollimore and A. Dyer: Clay Miner., 19 (1984) 865.Article
- 11. L. Qiu, R. Xie, P. Ding and B. Qu: Compos. Struct., 62 (2003) 391.Article
- 12. P. A. Klonos and R. D. Bikiaris: Polymer, 296 (2024) 126841.Article
- 13. E. Kim, Y. Kim and J. Nam: J. Materiomics., 4 (2018) 149.Article
- 14. H. Iwanaga, M. Kawaguchi and S. Motojima: J. Appl. Phys., 75 (1992) 1297.
- 15. H. Lu, Y. Hu, J. Xiao, Z. Wang, Z. Chen and W. Fan: J. Mater. Sci., 41 (2006) 363.ArticlePDF
- 16. S. Rafael, M. Miotto, E. Elisangela, S. Raquel and M. B. Sonia: J. Appl. Polym. Sci., 101 (2006) 1799.Article
- 17. J. Kim, H. Shim, Y. Yun, S. Hwang and Y. Kim: J. Ceram. Process. Res., 26 (2025) 672.
- 18. A. Choi, N. Oh and Y. Kim: J. Korean Powder Metall. Inst., 27 (2020) 401.Article
- 19. A. Choi, N. Oh and Y. Kim: J. Korean Ceram. Soc., 59 (2022) 224.ArticlePDF
- 20. R. Yu, J. H. Pee, H. T. Kim, K. J. Kim, Y. W. Kim, W. Kim and Y. Kim: J. Korean Powder Metall. Inst., 18 (2011) 283.Article
- 21. R. Yu, J. H. Pee, H. T. Kim and Y. Kim: J. Korean Ceram. Soc., 50 (2013) 201.Article
- 22. R. Yu and Y. Kim: J. Korean Powder Metall. Inst., 26 (2019) 195.Article
- 23. M. Park, A. Choi, S. Kim, W. Shim and Y. Kim: J. Korean Ceram. Soc., 59 (2022) 869.ArticlePDF
- 24. Z. Zhou and Y. Deng: J. Colloid Interf. Sci., 316 (2007) 183.Article
- 25. C. Bouchekrit and M. Kolli: J. Min. Metall. Sect. B-Metall., 59 (2023) 5.
- 26. G. Saldi and C. Causserand: Chem. Geol., 584 (2021) 120521.Article
- 27. A. Chen and X. Wang: Minerals, 13 (2023) 1517.Article
- 28. R. Zhang and S. Hu: Aquat. Geochem., 13 (2007) 309.ArticlePDF
- 29. X. Sun, W. Shi, L. Xiang and W. Zhu: Nanoscale Res. Lett., 3 (2008) 386.
- 30. S. Nie and W. Zhai: RSC Adv., 42 (2023).
- 31. J. Móczó and B. Pukánszky: J. Ind. Eng. Chem., 14 (2008) 535.Article
- 32. A. Bledzki and A. Jaszkiewicz: Compos. Part A: Appl. Sci. Manuf., 40 (2009) 404.Article
- 33. Y. Ding and G. Zhang: Chem. Mater., 12 (2000) 2845.Article
- 34. T. Fan and D. Han: J. Chem. Eng. Jpn., 53 (2020) 646.Article
- 35. X. Yan, D. Xu and D. Xue: Acta Mater., 55 (2007) 5747.Article
References
Figure & Data
References
Citations

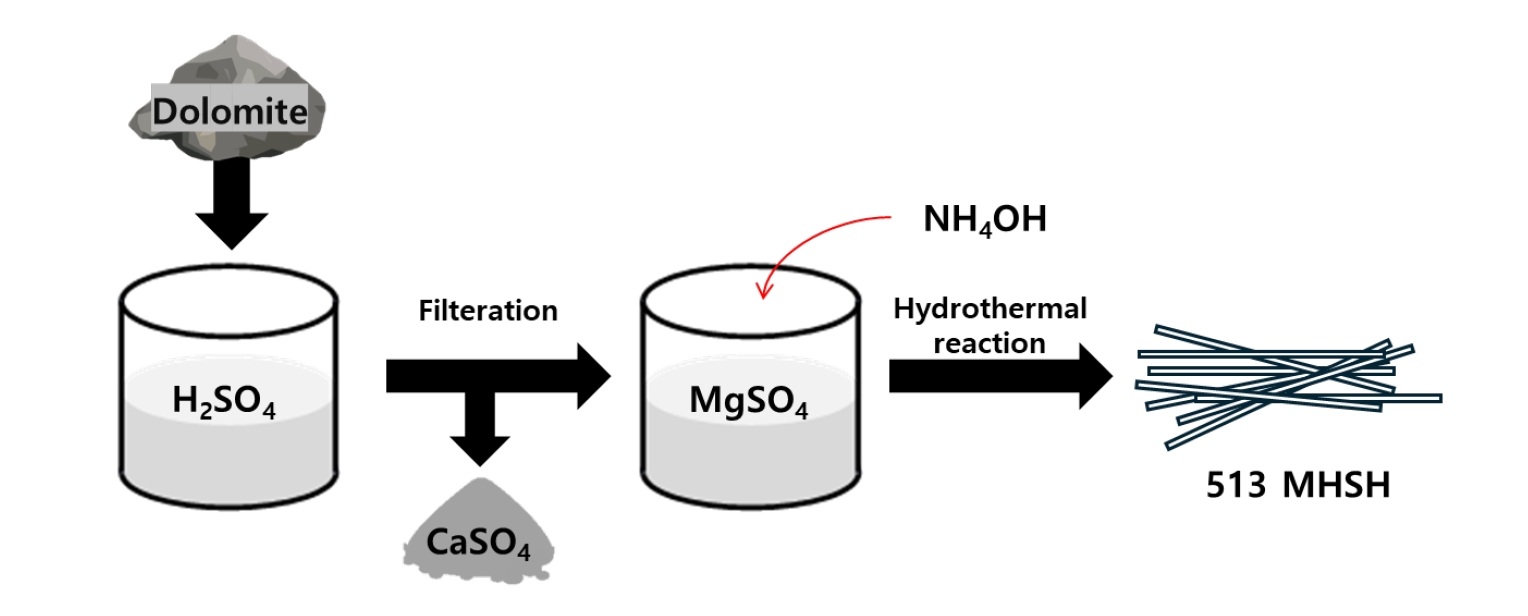

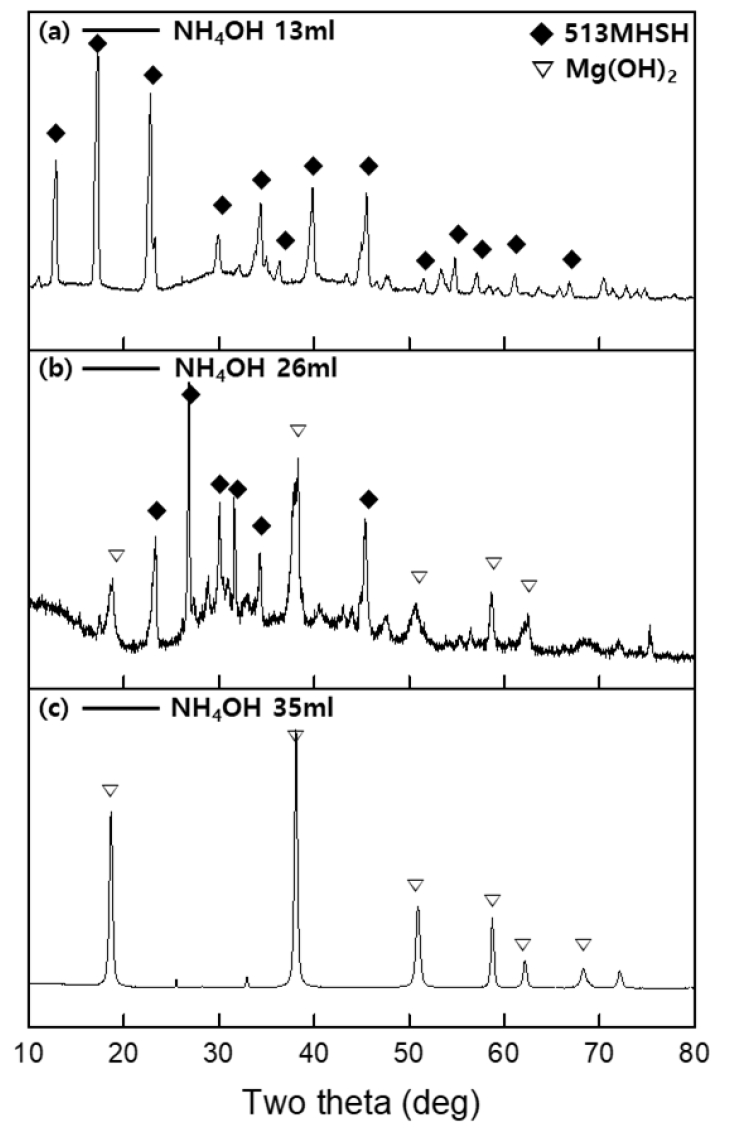

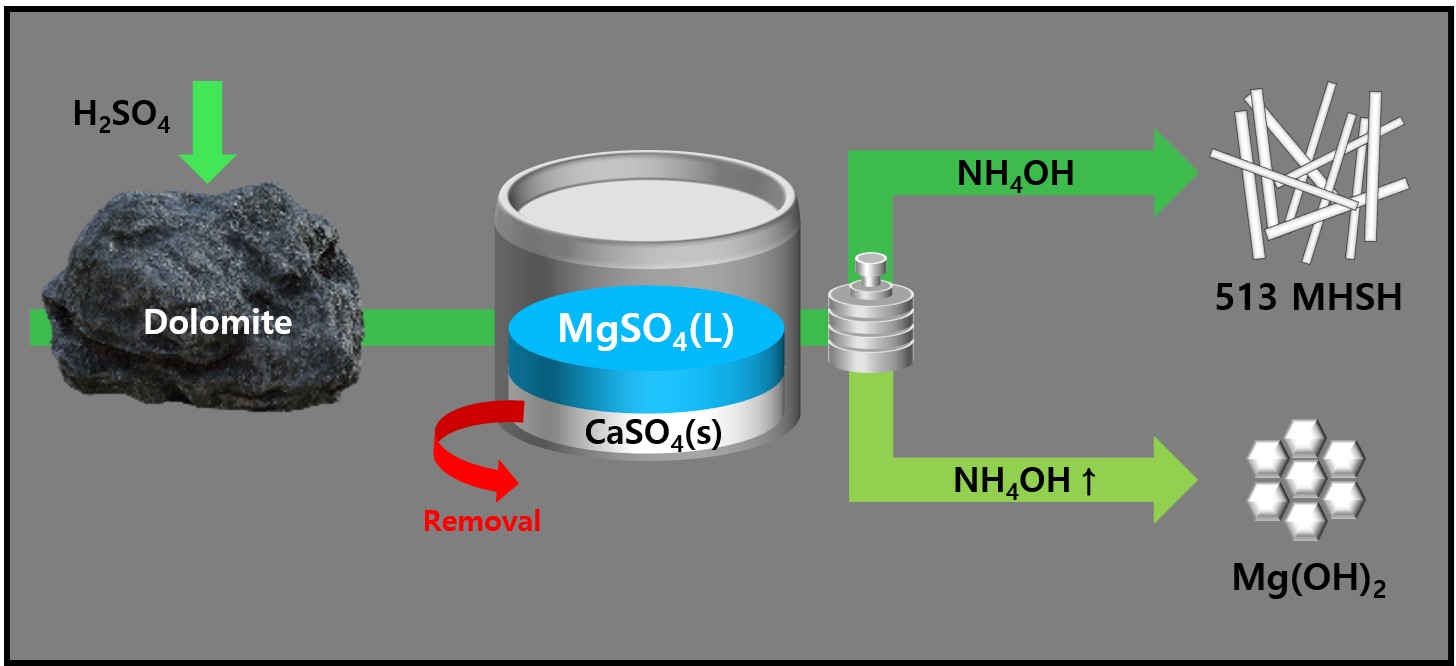
Fig. 1.
Fig. 2.
Fig. 3.
Fig. 4.
Graphical abstract
| Condition | Dolomite (g) | H2SO4 (wt%) | H2SO4 (mL) |
|---|---|---|---|
| Ⅰ | 10 | 10 | 100 |
| Ⅱ | 10 | 5 | 200 |
| Ⅲ | 10 | 5 | 100 |
| Ⅳ | 10 | 5 | 50 |
| Sample | Dolomite(g) | H2SO4 (wt%) | H2SO4 (mL) | MgSO4 (mL) | 4M NH4OH | Reaction time (h) | Reaction temperature (℃) |
|---|---|---|---|---|---|---|---|
| 1 | 10 | 5 | 50 | 20 | 13 | 48 | 180 |
| 2 | 10 | 5 | 50 | 20 | 26 | 48 | 180 |
| 3 | 10 | 5 | 50 | 20 | 35 | 48 | 180 |
| Sample | MgSO4 (mL) | 4M NH4OH (mL) | Reaction time (h) | Reaction Temperature (℃) |
|---|---|---|---|---|
| 4 | 20 | 13 | 12 | 180 |
| 5 | 20 | 13 | 24 | 180 |
| 6 | 20 | 13 | 72 | 180 |
| Component (wt %) | |||||
|---|---|---|---|---|---|
| CaO | MgO | SiO2 | Al2O3 | Fe2O3 | Total (Except for Mg, Ca) |
| 30.5 | 21.7 | 0.22 | 0.12 | 0.09 | 0.43 |
| Condition | Dolomite MgSO4 component (wt %) | Mg leaching rate (%) | |||||
|---|---|---|---|---|---|---|---|
| Mg | S | Ca | Si | Al | Fe | ||
| Ⅰ | 12.45 | 46.7 | 9.71 | 0.2 | 1.29 | - | 57.37 |
| Ⅱ | 18.05 | 50.61 | 6.99 | 0.12 | 1.39 | - | 83.18 |
| Ⅲ | 20.74 | 54.89 | 5.38 | 0.27 | 1.06 | - | 95.58 |
| Ⅳ | 21.4 | 42.23 | 2.71 | 0.12 | 0.8 | - | 98.62 |
Table 1.
Table 2.
Table 3.
Table 4.
Table 5.
TOP
 KPMI
KPMI

 ePub Link
ePub Link Cite this Article
Cite this Article





