Articles
- Page Path
- HOME > J Powder Mater > Volume 30(1); 2023 > Article
-
Article
용해도 개선을 위한 레보설피라이드 무정형 분무 건조 미세분말의 제조 및 평가 - 진성 규*
- Fabrication and Evaluation of Levosulpiride-loaded Amorphous Spray-dried Microparticle for Improved Solubility
- Sung Giu Jin*
-
Journal of Korean Powder Metallurgy Institute 2023;30(1):47-52.
DOI: https://doi.org/10.4150/KPMI.2023.30.1.47
Published online: January 31, 2023
단국대학교 제약공학과
Department of Pharmaceutical Engineering, Dankook University, Cheonan 31116, Republic of Korea
- * Corresponding Author: Sung Giu Jin, TEL: +82-31-400-4784, FAX: +82-31-400-5958, E-mail: sklover777@dankook.ac.kr
- - 진성규: 교수
• Received: February 16, 2023 • Revised: February 21, 2023 • Accepted: February 22, 2023
© The Korean Powder Metallurgy Institute. All rights reserved.
- 835 Views
- 6 Download
Abstract
- The purpose of this study is to develop and evaluate amorphous spray-dried microparticles (SDM) containing levosulpiride to increase its solubility. SDM are prepared via solvent evaporation using polyvinylpyrrolidone (PVP) as the water-soluble polymer and Cremophor RH40 as the surfactant. The SDM is prepared by varying the amounts of PVP and Cremophor RH40, and its physicochemical properties, solubility, and dissolution are confirmed. All levosulpiride-loaded SDMs converted the crystalline drug into an amorphous form, significantly improving drug solubility and dissolution compared with the drug alone. SDM consisting of drug/PVP/Cremophor RH40 in a weight ratio of 5:10:3, with increased solubility (720 ± 36 vs. 1822 ± 51 μg/mL) and dissolution rate (10.3 ± 2.2 vs. 92.6 ± 6.0%) compared with drug alone, shows potential as a commercial drug for improved oral bioavailability of levosulpiride.
- 레보설피라이드는 설피라이드의 좌선성 광학이성질체 로 중추 및 말초 신경계 모두에서 작용하는 도파민 수용 체 길항제인 벤즈아미드 유도체이다. 레보설피라이드는 정신병, 우울증, 신체형 장애 등의 정신신경계와 구토, 소 화불량, 위궤양, 십이지장궤양 등의 소화기계 증상치료에 사용되는 약물이다[1]. 물에 거의 녹지 않고 투과성이 낮 기 때문에 20-30% 낮은 경구 생체이용률을 나타낸다. 레 보설피라이드의 경구 흡수를 증가시키기 위해서는 수용해 도 및 위장관 흡수의 개선이 이루어져야 한다[2]. 용해도 개선을 위해서 리포솜 시스템, 자가 미세 유화 약물 전달 시스템, 나노입자 시스템 및 고체 지질 나노입자와 같이 용해도와 위장 흡수를 증가시키기 위한 다양한 전략이 연 구되고 있다[3-5]. 낮은 경구 흡수를 위한 전략 중 고체분 산체를 이용한 마이크로 분말화는 용해도와 생체 내 흡수 향상을 이루며 대량 생산이 가능한 방법이다[6]. 일반적으 로 약물, 고분자, 계면활성제로 구성된 고체분산체는 무정 형 형태의 미세한 입자 크기를 가지고 있어 수용성과 경 구 생체이용률을 증대시키기 위한 방법으로 사용된다[7]. 고체분산체 방법은 압출/구형화, 용융, 동결 건조, 초임계 및 전기분무 방법 등으로 제조가 가능하다[8].
- 본 연구는 레보설피라이드의 경구 흡수 개선과 용해도 와 용출을 증가시키기 위하여 분무건조법으로 무정형 분 무건조 미세분말을 제조하는 것이다. 폴리비닐피롤리돈 (Polyvinyl pyrrolidone; PVP)과 크로모포어 RH40(Cremophor RH40)을 이용하여 다양한 비율로 분무건조 미세분 말을 제조하였다. 주사 전자 현미경, 시차 주사 열량계 및 분말 X-선 회절을 이용하여 물리화학적 특성을 확인하였 다. 또한, 제조된 분무건조 미세분말을 통해 수용해도 평 가 및 용출 평가를 통해서 약물 단독과 용해 속도를 비교 하였다.
1. Introduction
- 레보설피라이드(Levosulpiride)는 한미약품(Korea)에서 제공하였다. 폴리비닐피롤리돈(PVP K30) 및 Cremophor RH40은 BASF(Germany)에서 구입하였다. 다른 모든 화학 물질 및 용매는 시약 등급이었고 추가 정제 없이 사용되 었다. 모든 시약은 대한약전 규격에 적합한 순도 및 규격 을 사용하였다. 기기로는 분무건조기(Model 290, Buchi mini-spray dryer, Switzerland)와 용출기(Dissolution tester, DT 6, ERWEKA, Germany), Scanning Electron Microscope (SEM, SIGMA 500, CARL ZEISS, Germany)를 사용하였다.
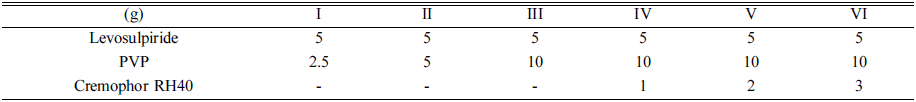
- 수용성 고분자 PVP, HPMC, HPC, 및 Dextran 그리고 계면활성제 Cremophor RH40, Tween 20, Tween 80, 및 poloxamer 188을 이용한 용해도 탐색 예비 시험을 수행하 였으며 이를 통해 약물과의 친화성이 가장 우수한 것으로 확인된 PVP를 수용성 고분자로, Cremophor RH40을 계면 활성제로 각각 사용하였다. 레보설피라이드가 함유된 미 세분말은 노즐형 분무건조기(B-290; Büchi Co., Flawil, Switzerland)를 사용하여 용매 증발법으로 제조하였다. 약 물, PVP 및 Cremophor RH40(표 1)의 다양한 중량비를 에 탄올과 물(1:1) 100 mL에 용해하였다. 생성된 투명한 용액 을 20mL/분의 유속으로 연동 펌프에 의해 노즐(직경 0.7 mm)을 통해 분무건조하였다. 분무건조의 상세한 조건은 다음과 같다. 흡입기 100%로 고정하였으며 분무 공기압 은 4 kg/cm2로 설정하였으며 흡기 및 배기 온도는 각각 130°C 및 65°C로 설정하였다[9].
- 용해도 평가 및 용출 평가에서 레보설피라이드의 농도 를 분석하기 위하여 고성능 액체크로마토그래피법(HPLC) 을 이용하여 분석하였다. Innertsil Sil-100 컬럼(4.6 mm I.D. × 150 mm, 5 μm; GL Sciences Inc., Japan)이 장착된 HPLC 시스템(Agilent 1220 Infinity; Agilent Technologies, USA)을 사용하였다. 인산으로 pH를 3.5로 조정한 메탄올: 20 mM KH2PO4의 혼합물(4:6, v/v)을 이동상으로 사용하 였으며 유속은 0.75 mL/분, 주입 부피는 10 μL이고, 파장 은 216 nm에서 관찰하였다[2].
- 제조된 약물함유 분무건조 미세분말의 수용해도와 용출 평가를 수행하였다. 과량의 레보설피라이드 분말(약물로 서 5 mg 해당량)을 1mL의 증류수를 넣은 2mL 마이크로 튜브에 첨가하고 혼합하였다. 그런 다음 튜브를 수조 (25°C)의 기계식 진탕기에 고정하고 7일 동안 100 rpm으 로 교반하였다. 그 후, 10분 동안 10,000 g에서 원심분리 (Smart 15; Hanil Science Industrial Co., Korea) 하였다. 상 등액을 여과하고 샘플을 HPLC 이동상으로 적절하게 희석 하여 여액 내 레보설피라이드의 농도는 앞에서 언급한 HPLC 분석법에 따라 평가하였다[10]. 또한, 각각 25mg 레보설피라이드에 해당하는 레보설피라이드가 함유된 분 무건조 미세분말의 용출 평가는 대한약전 용출 장치 제 2 법(패들 장치)(Dissolution tester, DT 6, ERWEKA, Germany) 를 통해 900 mL의 증류수에서 평가하였다. 50 rpm 의 패들 회전을 사용하여 37 ± 0.5°C에서 용출 시험을 수 행하였다[11]. 미리 정해진 시간 간격으로 샘플링(5 mL)하 고 여과하였다. 여액(10 μL)의 레보설피라이드 농도는 위 에서 언급한 HPLC 방법으로 분석하였다.
- 분무건조 미세분말의 물리화학적 평가를 위해 레보설피 라이드 분말, 레보설피라이드 함유 미세분말, 물리적 혼합 물 및 PVP의 표면 형태학적 측면을 주사 전자 현미경(S- 4800; Hitachi, Japan)을 사용하여 평가하였다. EMI Teck 이온 스퍼터(K575K)를 사용하여 진공(8 × 10-3mbar)에서 15 mA의 전류 및 100% 속도로 4분 동안 백금으로 스퍼 터 코팅하여 전기 전도성으로 만들어 평가하였다[12]. 또 한 시차 주사 열량계(DSC Q20; TA Instruments, USA)를 사용하여 레보설피라이드 분말 및 레보설피라이드 함유 미세분말, 물리적 혼합물, PVP 및 Cremophor RH40의 열 적 특성을 평가하였다. 각 샘플 약 5 mg을 알루미늄 팬에 넣고 밀봉하고 50 mL/분의 질소 흐름 하에서 50-300°C 범 위에 걸쳐 10°C/분의 속도로 가열하였다[13]. 마지막으로 레보설피라이드 분말 및 레보설피라이드 함유 미세분말, 물리적 혼합물, PVP 및 Cremophor RH40의 결정화도는 Miniflex 고니오미터가 장착된 X-선 회절계(D/MAX-2500 PC; Rigaku Co., Japan)에 의해 평가하였다. 분석은 100 mA 전류 및 40 kV 전압에서 Cu/Kα1 단색 방사선 소스를 사용하여 평가하였다. 2θ 스캐닝 모드, 2°/초의 스텝 크기 및 4°/분의 스캔 속도로 3-50° 범위에서 X선 회절 패턴을 얻었다[14].
2. Experimental
- 이 연구에서는 레보설피라이드의 경구 생체이용률을 증 가시키기 위해 약물, 수용성 고분자 및 계면활성제를 사용 하여 다양한 분무건조 미세분말을 준비하여 용해도와 용 출율 변화를 평가하였다. 레보설피라이드는 수용성이 낮 고 P-당단백질 유출로 인해 위장관에서 경구 흡수율이 낮 다[1]. 고체분산체를 통해 용해도를 증가시키기 위해서는 적절한 수용성 고분자와 계면활성제를 선택하는 것이 중 요하다. 예비 평가를 통해 레보설피라이드의 수용해도를 증가시키는 수용성 고분자로 PVP를 선정하였으며 계면활 성제로 Cremophor RH40을 선정하였다. PVP는 고체분산 체 제조에 많이 사용되는 수용성 고분자로 무정형, 생체 적합성, 수용성 특성 때문에 제약분야에서 자주 사용되는 첨가제이다[15]. 또한, Cremophor RH40은 계면활성제로 의 용해도 개선뿐만 아니라 세포막의 부분 용해 등의 메 커니즘을 통해 생체막 투과성을 증가시키는 역할도 수행 한다[16].
- 적정량의 PVP를 결정하기 위해 분무건조기를 이용하여 용매 증발법을 통해 5 g의 약물과 2.5-10 g의 PVP로 다양 한 분무건조 미세분말을 제조하고(표 1, 제형 I-III), 약물 의 용해도를 평가하였다(그림 2A). PVP 양이 제제 I에서 II 및 III으로 증가함에 따라 분무건조 미세분말에서 약물 의 용해도가 증가하였다[17]. 그러나 증가하는 정도가 크 지 않았다. 제제 III에서 수용성 고분자의 양이 약물대비 1:2 비율에서 용해도는 약물 단독 대비(720 ± 36 vs. 811 ± 27 μg/mL) 증가하였으나 그 정도가 크지 않고 수용성 고 분자 양이 더 증가하였을 경우 최종 제형의 양이 증가함 에 따라 환자의 복용 편의성이 감소할 수 있다. 따라서 PVP의 양은 약물대비 1:2의 비율로 고정하였다(제제 III). 다음으로, 적절한 농도의 계면활성제의 비율을 정하기 위 해 Cremophor RH40의 비율을 변경하여 분무건조 미세분 말을 약물 5 g, PVP 10 g 및 Cremophor RH40 1-3 g으로 제조하였다(표 1, 제제 VI-VI). Cremophor RH40은 반고형 형태로 3 g 이상 첨가하였을 때는 분무건조 후에 미세입 자를 제조하기 어려워 Cremophor RH40은 약물 5 g 대비 최대 3 g까지 제조하여 용해도를 평가하였다(그림 2B) . 계 면활성제인 Cremophor RH40에 따른 용해도 평가 결과 Cremophor RH40이 증가함에 따라서 약물의 용해도도 선 형적으로 증가하였다. Cremophor RH가 각각 0, 1, 2 및 3 g인 제제 III, IV, V 및 VI에서 약물의 용해도는 각각 811 ± 27, 1211 ± 61, 1585 ± 54 및 1822 ± 51 μg/mL를 나 타냈다. 모든 분무건조 미세분말은 약물 단독(720 ± 36 μg/mL)에 비해 약물 용해도를 증가시켰다. 이러한 결과는 Cremophor RH40이 분무건조 미세분말에서 수용성 고분 자에 비해 약물 용해도에 큰 영향을 미친다는 것을 시사 한다[18].
- 분무건조 미세분말로부터 레보설피라이드의 용출 거동 을 그림 3에 나타내었다. 약물 양은 시판제품과 동일하게 25 mg으로 수행하였으며 샘플링 시간은 분무건조 미세분 말 제형이 포화가 이뤄지는 시점으로 정하여 시험하였다. 모든 약물 함유 분무건조 미세분말은 레보설피라이드 단 독 분말에 비해 현저하게 높은 용출률을 나타내었다[19]. 30분까지, Cremophor RH40(제제 IV-VI)를 포함하는 분무 건조 미세분말은 Cremophor RH40을 포함하지 않는 제제 (제제 III)보다 더 높은 초기 용출 속도를 나타내었다. 그 러나, Cremophor RH40를 포함하는 제제 IV-VI 사이에서 의 용출속도는 큰 차이는 없었으나 15분까지 Cremphor RH40 3 g을 함유하는 제제 VI는 다른 제제에 비해 증가 된 초기 용출률을 나타내었다. 15분에서 약물 단독, 제제 III, IV, V 및 VI의 용출율은 각각 10.3 ± 2.2, 65.2 ± 8.5, 86.8 ± 4.5, 88.7 ± 4.6, 92.6 ± 6.0%였다.
- DSC에 의한 레보설피라이드 함유 분무건조 미세분말의 열적 거동을 그림 4A에 나타내었다. 레보설피라이드(4Aa) 는 녹는점인 약 190°C에서 흡열 피크를 보여 결정질 특 성을 나타낸다[2]. PVP(4A-b)와 Cremophor RH40(4A-c) 는 테스트 영역에서 고유한 피크를 나타내지 않았다. 또한, 물리적 혼합물(4A-d)은 약물에서 나타나는 흡열 피크를 나타내었다. 물리적 혼합물은 제제 VI를 분무건조 방법이 아닌 단순 혼합하여 제조하였다. 그러나 분무건조 미세분 말인 제제 VI는 약물에서 나타나는 흡열 피크를 나타내지 않았다(그림 4A-e)[20]. 한편, 분말 X선 회절(PXRD) 패턴 은 그림 4B에 나타내었다. 레보설피라이드 분말(4B-a)은 고유의 결정 패턴을 나타내었다[2]. PVP(4B-b)와 Cremophor RH40(4B-c)는 미미하고 뚜렷하지 않은 상대적으로 약한 피크를 나타내었다. DSC의 결과와 마찬가지로 약물 에 나타난 모든 구별되는 결정 피크는 물리적 혼합물(4Bd) 에서 검출되었다. 그러나 분무건조 미세분말인 제제 VI 에서 뚜렷한 약물 피크를 나타내지 않았다(그림 4B-e). 이 상의 결과는 약물함유 미세분말에서 약물이 완전히 무정 형 상태로 존재함을 시사한다[21, 22].
- 그림 5는 약물함유 미세분말의 주사 전자 현미경 사진 을 나타내었다. 레보설피라이드 단독(그림 5A)은 평평한 판상 결정을 보여주고 있다. PVP(그림 5B)는 형태가 편형 된 구형입자 형태를 보여주며 물리적 혼합물(그림 5C)은 약물과 PVP가 혼합된 모습을 보여준다. 약물함유 분무건 조 미세분말은 상대적으로 매끄러운 표면을 갖는 구체를 제공하였다; 또한, 제형 VI의 분무건조 미세분말은 상대적 으로 균질하며 약물 결정크기보다 작은 3 μm 이하의 입자 크기를 나타내었다. 분무건조 과정을 통해서 약물 결정입 자 약 100 μm의 입자크기가 미세분말로 제조됨을 확인할 수 있었다[23].
- PVP와 Cremophor RH40을 사용하여 분무건조법으로 제조한 미세분말은 DSC, PXRD와 주사 전자 현미경 사진 결과를 통해 결정형 약물의 무정형 상태로의 전환 및 입 자 감소가 되었음을 확인할 수 있었다. 약물함유 분무건조 미세분말은 계면활성제와 수용성 고분자 함유에 따른 습 윤작용, 입자 크기 감소 및 결정성 약물의 무정형 상태로 의 전환으로 인해 난용성 약물인 레보설피라이드의 용해 도 및 용출을 향상시킬 수 있었다.
3. Results and Discussion
Fig. 2

Drug solubility of levosulpiride-loaded SDMs as an amounts (A) PVP and (B) Cremophor RH40. Each value represents the mean ± SD (n = 3). *P < 0.05 when compared with drug only.

Fig. 3
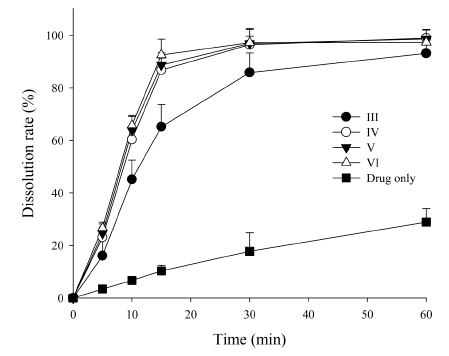
Dissolution profile of levosulpiride-loaded SDMs. Each value represents the mean ± SD (n = 3).

Fig. 4

DSC thermograms (A) and PXRD patterns (B): (a) levosulpiride powder; (b) PVP; (c) Cremophor RH40; (d) physical mixture; (e) formulation VI.

Fig. 5

Scanning electron micrographs: (A) levosulpiride powder (×500); (B) PVP (×500); (C) physical mixture (×500); (D) formulation VI (×10,000).

- PVP와 Cremophor RH40으로 구성된 레보설피라이드가 포함된 분무건조 미세분말은 약물의 용해도와 용출률을 현저하게 개선하였다. 특히, Cremophor RH40은 비율이 증가할수록 약물의 용해도가 더 향상되었다. 또한, 분무건 조 미세분말에서 약물은 결정형에서 무정형으로 변환되고 약물의 입자 크기가 작아져 약물의 용해도 증가가 입자크 기 감소 및 무정형에 따른 결과로 사료된다. 이 분무건조 미세분말은 레보설피라이드의 경구 생체이용률 향상을 위 한 상업용 의약품으로 가능성을 보여주었다.
4. Conclusion
- 1. D. S. Kim, J. S. Choi, D. W. Kim, K. S. Kim, Y. G. Seo, K. H. Cho, J. O. Kim, C. S. Yong, Y. S. Youn, S. J. Lim, S. G. Jin and H. G. Choi: Int. J. Pharm., 511 (2016) 351..ArticlePubMed
- 2. D. S. Kim, D. W. Kim, K. S. Kim, J. S. Choi, Y. G. Seo, Y. S. Youn, K. T. Oh, C. S. Yong, J. O. Kim, S. G. Jin and H. G. Choi: Colloids Surf. B Biointerfaces, 147 (2016) 250..ArticlePubMed
- 3. S. T. Arif, S. U. Zaman, M. A. Khan, T. A. Tabish, M. F. Sohail, R. Arshad, J. K. Kim and A. Zeb: Pharmaceutics, 14 (2022) 2347..ArticlePubMedPMC
- 4. N. Khaleeq, F. U. Din, A. S. Khan, S. Rabia, J. Dar and G. M. Khan: J. Microencapsul., 37 (2020) 1600. .ArticlePubMed
- 5. F. Din and G. M. Khan: Pharm. Dev. Technol., 24 (2019) 63..ArticlePubMed
- 6. D. S. Kim, H. G. Choi and S. G. Jin: Bull. Korean Chem. Soc., 39 (2018) 778..Article
- 7. M. J. Choi, M. R. Woo, H. G. Choi and S. G. Jin: Int. J. Mol. Sci., 23 (2022) 9491..ArticlePubMedPMC
- 8. P. Pandi, R. Bulusu, N. Kommineni, W. Khan and M. Singh: Int. J. Pharm., 586 (2020) 119560..ArticlePubMedPMC
- 9. J. S. Kim, Y. J. Choi, M. R. Woo, S. Cheon, S. H. Ji, D. Im, F. un Din, J. O. Kim, Y. S. Youn, K. T. Oh, S. J. Lim, S. G. Jin and H. G. Choi: Carbohydr. Polym., 271 (2021) 118433..ArticlePubMed
- 10. J. S. Kim, F. ud Din, S. M. Lee, D. S. Kim, M. R. Woo, S. Cheon, S. H. Ji, J. O. Kim, Y. S. Youn, K. T. Oh, S. J. Lim, S. G. Jin and H. G. Choi: Int. J. Nanomedicine, 16 (2021) 5797..ArticlePubMedPMC
- 11. J. E. Choi, J. S. Kim, M. J. Choi, K. Baek, M. R. Woo, J. O. Kim, H. G. Choi and S. G. Jin: Int. J. Pharm., 597 (2021) 120377..ArticlePubMed
- 12. M. J. Choi, J. S. Kim, H. Yu, M. R. Woo, J. E. Choi, K. Baek, J. O. Kim, Y. S. Choi, H. G. Choi and S. G. Jin: J. Mol. Liq., 346 (2021) 117057..Article
- 13. A. S. Han, J. Kim, J. W. Park and S. G. Jin: J. Drug Deliv. Sci. Technol., 70 (2022) 103213..Article
- 14. W. Kim, J. S. Kim, H. G. Choi, S. G. Jin and C. W. Cho: J. Drug Deliv. Sci. Technol., 66 (2021) 102877..Article
- 15. M. M. Ghobashy, D. M. Alshangiti, S. A. Alkhursani, S. A. Al-Gahtany, F. S. Shokr and M. Madani: ACS Omega, 5 (2020) 21476..ArticlePubMedPMC
- 16. S. A. Helmy, H. M. El-Bedaiwy and S. M. El-Masry: Ther. Deliv., 11 (2020) 447..ArticlePubMed
- 17. F. Febriyenti, S. Rahmi and A. Halim: J. Pharm. Bioallied Sci., 11 (2019) 262..ArticlePubMedPMC
- 18. H. Yin, H. Shao, J. Liu, Y. Qin and W. Deng: Plos One, 17 (2022) e0263692..ArticlePubMedPMC
- 19. J. E. Choi, J. S. Kim, J. Kim, M. J. Choi, K. Baek, J. O. Kim, H. G. Choi and S. G. Jin: J. Drug Deliv. Sci. Technol., 76 (2022) 103803..Article
- 20. S. Dedroog, T. Pas, B. Vergauwen, C. Huygens and G. Van den Mooter: J. Pharm. Biomed. Anal., 178 (2020) 112937..ArticlePubMed
- 21. X. Ma and R. O. Williams III: J. Drug Deliv. Sci. Technol., 50 (2019) 113..Article
- 22. S. Saboo, U. S. Kestur, D. P. Flaherty and L. S. Taylor: Mol. Pharm., 17 (2020) 1261..ArticlePubMed
- 23. A. B. Anane-Adjei, E. Jacobs, S. C. Nash, S. Askin, R. Soundararajan, M. Kyobula, J. Booth and A. Campbell: Int. J. Pharm., 614 (2022) 121387..ArticlePubMed
Figure & Data
References
Citations
Citations to this article as recorded by 

Fabrication and Evaluation of Levosulpiride-loaded Amorphous Spray-dried Microparticle for Improved Solubility
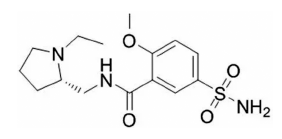
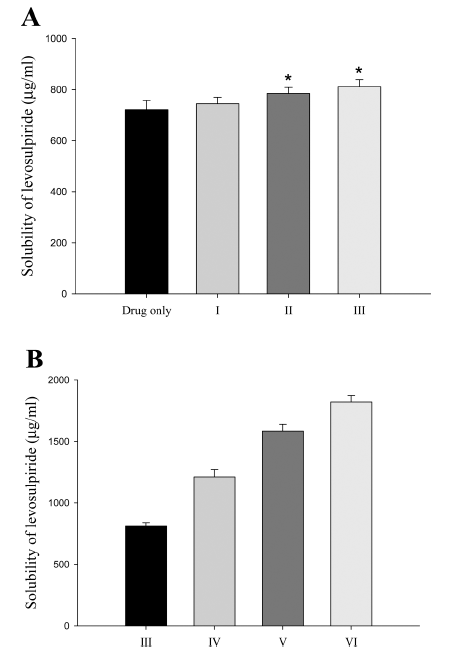



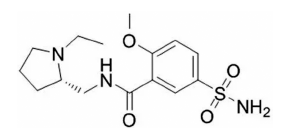
Fig. 1
Structure of levosulpiride.
Fig. 2
Drug solubility of levosulpiride-loaded SDMs as an amounts (A) PVP and (B) Cremophor RH40. Each value represents the mean ± SD (n = 3). *P < 0.05 when compared with drug only.
Fig. 3
Dissolution profile of levosulpiride-loaded SDMs. Each value represents the mean ± SD (n = 3).
Fig. 4
DSC thermograms (A) and PXRD patterns (B): (a) levosulpiride powder; (b) PVP; (c) Cremophor RH40; (d) physical mixture; (e) formulation VI.
Fig. 5
Scanning electron micrographs: (A) levosulpiride powder (×500); (B) PVP (×500); (C) physical mixture (×500); (D) formulation VI (×10,000).
Fig. 1
Fig. 2
Fig. 3
Fig. 4
Fig. 5
Fabrication and Evaluation of Levosulpiride-loaded Amorphous Spray-dried Microparticle for Improved Solubility
Table 1
Composition of levosulpiride-loaded spray-dried microparticles (SDMs)
Table 1
TOP
 KPMI
KPMI

 Cite this Article
Cite this Article





