Articles
- Page Path
- HOME > J Korean Powder Metall Inst > Volume 23(3); 2016 > Article
-
ARTICLE
화학적 환원법에 의한 구리 나노분말 합성 - 최민우, 배민환, 안중호*
- Synthesis of Copper Nanoparticles by a Chemical Reduction Method
- Min Woo Choi, Min Hwan Bae, Jung-Ho Ahn*
-
Journal of Korean Powder Metallurgy Institute 2016;23(3):228-234.
DOI: https://doi.org/10.4150/KPMI.2016.23.3.228
Published online: May 31, 2016
안동대학교 신소재공학부
School of Advanced Materials Engineering, Andong National University, 1375 Gyeongdong-ro, Andong, Gyeongbuk 36729, Korea
- *Corresponding Author: Jung-Ho Ahn, +82-54-820-5648, +82-54-820-6126, jhahn@andong.ac.kr
• Received: March 22, 2016 • Revised: April 12, 2016 • Accepted: April 15, 2016
© The Korean Powder Metallurgy Institute. All rights reserved
- 2,021 Views
- 40 Download
- 3 Crossref
Abstract
- Copper nanoparticles attract much attention as substitutes of noble metals such as silver and can help reduce the manufacturing cost of electronic products due to their lower cost and good conductivity. In the present work, the chemical reduction is examined to optimize the synthesis of nano-sized copper particles from copper sulfate. Sodium borohydride and ascorbic acid are used as reducing and antioxidant agents, respectively. Polyethylene glycol (PEG) is used as a size-control and capping agent. An appropriate dose of PEG inhibits the abnormal growth of copper nanoparticles, maintaining chemical stability. The addition of ascorbic acid prevents the oxidation of nanoparticles during synthesis and storage. Transmission electron microscopy (TEM) and Fourier transform infrared spectroscopy (FTIR) are used to investigate the size of the synthesized nanoparticles and the coordination between copper nanoparticles and PEG. For chemical reduction, copper nanoparticles less than 100 nm in size without oxidized layers are successfully obtained by the present method.
- 최근 나노 입자(nanoparticle)에 대한 관심이 높아지고, 특히 금속 나노 입자의 제조에 관한 연구가 활발히 진행 되고 있다[1]. 물질의 크기가 나노미터로 작아지면 벌크 상태에서는 볼 수 없었던 새로운 물리적 특성들이 나타나 고, 이러한 나노물질들의 크기와 모양이 변화하면 거기에 따라 새로운 특성들도 변화한다는 사실 때문이다. 따라서 나노 물질과 관련된 연구는 크기와 모양이 다양한 새로운 나노입자들의 합성에 특히 집중되고 있다. 즉, 나노입자들 의 고유한 특성을 이용해서 센서, 의학 진단, 촉매, 전자광 학 등 광범위한 분야에 응용을 목표로 우리나라를 포함해 서 전 세계 선진국들이 대단히 활발한 연구 경쟁을 벌이 고 있는 실정이다. 하지만 금속 나노 분말에 대한 연구들 은 주로 산화가 어려운 귀금속 재료에 집중되어왔다. 그러 나 금(Au), 은(Ag) 등의 귀금속 나노 입자는 고가이기 때 문에 경제성의 문제가 뒤따랐다. 반면 구리(Cu) 나노 입자 는 금이나 은에 비해 염가이면서 열적, 전기적 전도도가 크게 뒤 떨어지지 않아 전기, 전자 분야에서 귀금속을 대 체할 수 있는 좋은 후보 재료로 각광을 받고 있다. 문제는 구리 나노 입자는 합성 시 표면에 산화구리층을 형성하기 때문에 어려움이 따른다. 이를 해결하기 위해 유기물과 같 은 첨가물을 사용하여 복합하는 방법이 이용된다. 본 연구 에서는 화학적 환원법을 이용한 구리 나노 분말의 합성 조건을 조사했으며, 비교를 위해 역 미셀법과 수열합성법 도 병행해 입도 분포가 균일 하면서 산화구리 층을 형성 시키지 않는 조건을 찾기 위한 실험을 실시하였다. 화학적 환원법은 금속염을 환원 반응을 통해 순 금속으로 분말을 합성하는 방법이다[2]. 그러나 통상적인 화학적 환원법을 이용한 합성은 분말의 입도가 크고, 분포도 불균일하여 나 노 입자화 하기가 어렵다. 따라서 본 연구에서는 환원법을 이용하되 캐핑(capping)제로 PEG(polyethylene glycol)를 사용함으로써 이들이 환원된 금속 입자 사이의 결합을 지 연 시켜 미세하고 균일한 입도분포의 입자가 제조 되도록 시도하였으며 산화 구리 층 형성을 방지 하기 위해 아스 코르빈산 (ascorbic acid; 비타민 C)을 이용하였고, 환원제 로는 수소화붕소나트륨 (sodium borohydride)을 사용하였 다. 역 미셀 법(Reverse micelle)과 수열합성법의 추가 실 험은 비교를 위해 실시하였다.
서 론
- 먼저, 금속염인 황산구리(II) 오수화물(CuSO4·5H2O, KANTO CHEMICAL)을 증류수와 섞어 교반기를 이용하 여 완전 용해시킨 후 입자의 크기를 조절하기 위한 캐핑 제인 PEG(H(CH2CH2O)nOH, ALDRICH)를 넣고 노란색으로 변할 때까지 교반을 실시하였다. 합성 및 저장 과정 중의 산 화를 방지 하기 위해 아스코르빈산(C6H8O6, ALDRICH)을 첨가하였으며 동시에 용액의 PH조절과 환원 반응을 가속 화 하기 위해 수산화나트륨(NaOH)을 첨가하였다. 그리고 주 환원제인 수소화붕소나트륨(NaBH4, ALDRICH)을 넣 고 30분간 격렬하게 교반 시켰다. 위와 같은 실험을 통해 얻어진 용액에서 목적 분말 이외의 잔류물을 제거 하기 위해 에탄올(C2H5OH)과 증류수를 1:1로 혼합한 용액으로 10회 반복 세척한 후 원심분리 하였다. 원심분리 된 목적 분말은 공기 중에서 오븐을 이용하여 80°C로 6시간 동안 건조 하였다. 본 연구에서는 케핑제인 PEG가 구리 나노 입자의 합성에 어떤 영향을 주는지 알아보기 위해 농도를 0.04M, 0.05M, 0.06M으로 변화시켜 실험을 진행하였고 환원제의 양 또한 구리 나노 입자 합성에 어떤 영향을 끼 치는지 알아보기 위해 수소화붕소나트륨의 농도를 각각 0.02M, 0.04M, 0.06M으로 달리하여 실험을 진행하였다. 마지막으로 아스코르빈산의 유무에 따른 산화 방지를 알 아보기 위한 실험을 행하였다. 비교를 위한 역 미셀 법의 경우 금속염을 포함한 역 미셀 용액과 환원제를 포함한 역 미셀 용액을 제조한 뒤 교반기를 이용해 15분간 빠르 게 교반 하였다. 그리고 원심분리기로 나노 분말과 이물질 을 침전 여과시키고 분리된 나노 분말을 세척액(Alcohol: Chloroform = 1:1)을 통해 세척 후 원심분리기로 다시 침 전 여과하는 작업을 수차례 반복하였다. 이렇게 하여 얻은 분말을 로(Furnace)에 넣고 80°C 6시간 동안 건조하였다. 두 번째 비교 공정인 수열 합성은 금속염과 환원제 및 기 타 화학물질을 통해 용액을 만들어 교반기를 통해 빠르게 교반 시킨 후 Teflonlined stainless steel autocalve에 10 mL (충진률 50%)를 넣고 로에서 180°C로 5시간 동안 수열 합 성하였다. 수열 합성된 용액을 위 실험과 동일한 세척액을 통해 세척 후 원심분리기로 다시 침전 여과하는 작업을 수차례 반복하였고, 얻은 분말을 가열로에 넣고 80°C로 6 시간 동안 건조하였다. 본 연구에서 시도한 용액의 성분 과 조성은 표 1과 표 2 그리고 표 3에 기술하였다. 최종적 으로 얻어진 분말 시료들은 XRD (X-ray diffraction), TEM (transmission electron microscopy), FE-SEM (fieldemission scanning electron microscope)를 이용하여 입자의 상 성분, 크기 및 특성을 분석하고 적외선 분광기(Fourier- Transform Infrared Spectrophotometer)를 통해 캐핑제의 영향을 알아 보았다.
실험 방법
Table 1
Composition of examined samples in chemical reduction method
- 그림 1은 본 연구에서 실시한 화학적 환원 반응 실험의 단계별 용액 외형 변화를 보여준다. 사진에서 보듯이 증류 수에 용해된 황산구리(II) 오수화물은 푸른색의 용액을 띄 고 있으며 여기에 흰색 용액을 띄는 PEG와 산화 방지를 위한 아스코르빈산, PH조절과 환원 반응을 가속시키기 위 한 수산화나트륨을 첨가하면 노란 빛을 띄는 용액으로 변 화는 것을 볼 수 있었다. 또한 환원제인 수소화붕소나트륨 을 첨가하면 붉은색이 되었다가 검정색으로 급격히 변화 하면서 거품을 일으키며 격렬하게 반응하였다. 이때, 노란 색에서 검정색으로 변하는 것이 환원반응이 완료 되었음 을 의미한다. 또한 수산화붕소나트륨을 첨가 후 시간이 지 남에 따라 미세한 입자들이 생성되어 침전되는 것을 확인 하였다. 이후 에탄올과 증류수를 1:1 비율로 혼합하여 세 척을 실시하였고 그림 2를 통해 순 구리의 회절 선 이외 의 회절 선이 나타나지 않은 것으로 보아 이는 세척이 되 었음을 의미한다.
- 그림 2는 캐핑제의 양에 따른 X-선 회절 패턴의 결과이 다. 표 1에 있는 시편 No. 1, 2, 3을 비교해본 결과 캐핑 제의 농도와 무관하게 순 구리의 회절 선만 나타났으며, 산화물은 생성되지 않았다. 또한, 아스코르빈산을 첨가함 으로써 반응 중 쉽게 생성 될 수 있는 산화물이 전혀 생 성 되지 않았으며 반응 후 세척 과정에서도 산소가 포함 된 에탄올과 증류수를 사용하였지만 산화되지 않았다.
- 그림 3은 환원제 양에 따른 X-선 회절 패턴의 결과이다. 표 1에 있는 시편 No. 4, 5, 6을 비교해본 결과 환원제인 수소화붕소나트륨의 농도가 0.04M일 때 까지는 순수한 구리 회절 선만 나타났지만, 0.05M 이상으로 증가 시에는 산화물상(Cu2O)이 나타났다. 산화방지제인 아스코르빈산 을 적정 농도 사용할 경우 오히려 구리가 산화되는 결과 를 얻을 수 있었다. 다음 그림 4는 시편 No. 4, 5의 아스 코르빈산 첨가 유무에 따른 X-선 회절 패턴의 결과이다. 아스코르빈산을 첨가하지 않은 경우 산화물 상이 나타났 지만 아스코르빈산을 첨가 한 경우는 반응 도중 산화가 일어나지 않고 반응 후에도 순수한 구리 회절 선 만이 나 타난 것을 확인 할 수 있었다. 그러나 그림 3에서 보듯이 환원제 양의 변화에 따라 상대적으로 아스코르빈산의 양 이 변하지 않으면 산화가 일어 난다는 것을 알 수 있었다.
- 그림 5는 합성된 입자의 모양을 확인하기 위해 조사한 TEM 형상이 예시되어 있다. 사진에서 볼 수 있는 바와 같 이, PEG의 농도 변화에 따른 합성 분말의 형상을 보면 70 nm 이하 크기의 구리 나노 입자가 형성되었음을 알 수 있다. PEG농도가 0.04M일 때는 구리 나노 입자의 입도가 균일 하였으나 포도 줄기 같이 응집되는 현상이 보였다. 입도는 200 nm 이상이었다. 이는 캐핑을 하였음에도 불구 하고 나노 입자의 핵 생성과 동시에 캐핑 되어야 할 핵들 이 짧은 시간에 동시에 생성되며 응집된 것으로 보인다. PEG농도가 0.05M일 때 응집 되기 전의 입자의 입도 분포 는 다소 불균일 하였으나, 응집된 입자들이 100 nm 정도 의 크기를 보였다. PEG농도가 0.06M일때는 응집된 입자 들이 100 nm 이하였으며, 이는 PEG 농도가 증가 할수록 입자들의 응집을 억제 할 수 있음을 보였다. 캐핑제인 PEG는 TEM 회절 패턴으로 비정질상으로 존재함을 알 수 있었으며, 결정성 구리와 구분할 수가 있었다. PEG농도에 따른 응집 되기 전의 입자의 크기는 70 nm 이하로 차이 를 찾아 볼 수 없었으나, 입자들의 응집된 크기는 감소하 는 것을 알 수 있다.
- 그림 6는 PEG 농도에 따른 적외선 분광기 분석 결과이 다. 도표에서 보듯이 건조된 시료의 최대 분해 피크는 563 cm−1이었며, PEG농도가 0.05M에서 0.06M으로 증가 함에 따라 최대 분해 피크가 458 cm−1에서 436 cm−1로 짧 아짐을 보였다. 이는 PEG의 양이 증가 함에 따라 환원 중 구리 나노 입자가 보다 효과적으로 캐핑하여 더 안정화 시키기 때문으로 생각된다. 이 또한 그림 5과 같이 PEG농 도가 증가 할수록 균일하게 입자들이 응집 된다는 것을 보 여준다. 그러나 세척 시 PEG가 잔류하는 문제가 있었다.
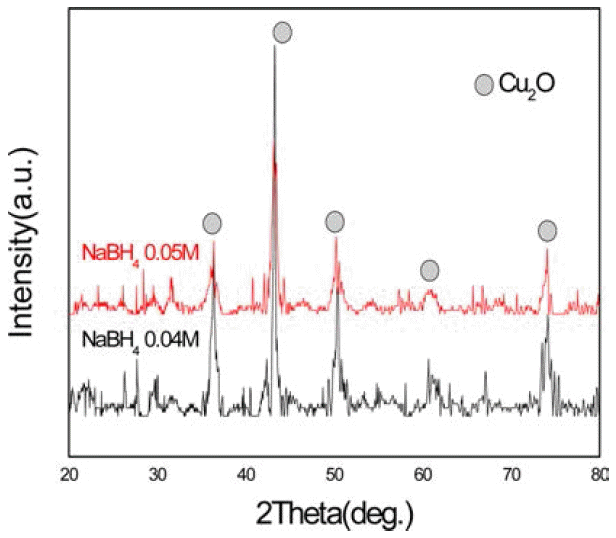
- 다음으로 화학적 환원법을 역 미셀 법에 이용하여 얻은 실험 결과이다. 그림 7은 환원제의 양에 따른 X-선 회절 선의 변화이다. 도표 2에서 보듯이 환원제인 수소화붕소 나트륨의 농도가 0.04M일 때보다 0.05M일 때 구리나노입 자인 Cu2O상이 더 많이 나타난 것으로 보아 환원제의 양 이 많을수록 구리 나노 입자의 수가 증가 한다는 것을 알 수 있었다. 그림 8은 아스코르빈산의 첨가 유무에 따른 X- 선 회절 선의 변화 결과이다. 아스코르빈산을 첨가하지 않 은 경우 산화물 상이 나타났지만 아스코르빈산을 첨가 한 경우엔 반응 중에 산화가 일어나지 않았고 반응 후에도 순수한 구리 회절 만이 나타났다. 하지만 환원제 양의 변 화에 따라 상대적으로 아스코르빈산의 양이 변하지 않으 면 산화가 일어나는 것을 확인하였다. 그리고 Fe-SEM으 로 구리 나노 입자의 형상을 관찰하였다. 그림 9에서 볼 수 있듯이 입자들의 크기는 평균 적으로 100 nm 이하의 구리 나노 입자가 형성 된 것을 알 수 있지만 입자들의 입 도가 비교적 불균일하게 나타났고 입자들이 서로 뭉쳐지 는 현상이 보이는데 이것은 캐핑제의 역할이 제대로 이루 어지지 않은 것으로 볼 수 있으며 캐핑제 양의 조절이나 기타 캐핑제의 역할을 방해하는 불순물 등을 제거 하는 방안의 연구가 더 필요하다.
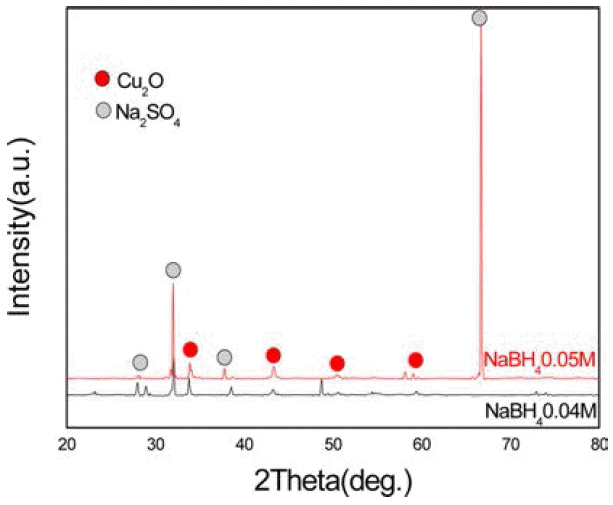
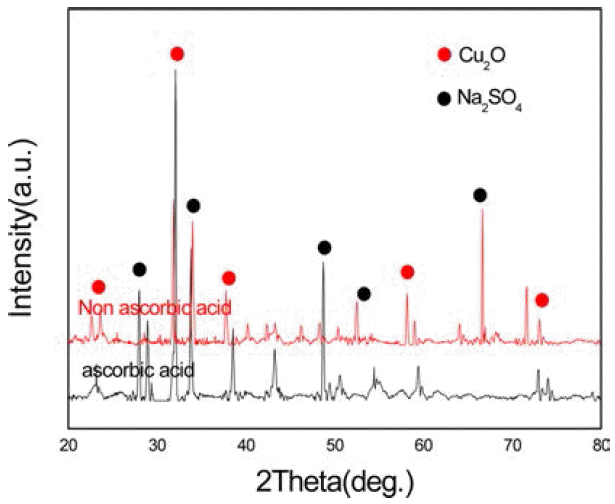
- 마지막으로 화학적 환원법을 수열합성법에 적용하여 비 교한 실험 결과이다. 그림 10은 환원제의 양에 따른 X-선 회절 선이다. 도표 3에서 보듯이 환원제인 수소화붕소나 트륨의 농도가 0.04M일 때보다 0.05M일 때 구리나노입자 인 Cu2O상이 더 많이 나타났다. 따라서 환원제의 양이 많 을수록 구리 나노 입자의 수가 증가 한다는 것을 알 수 있 다. 하지만 구리 나노 입자를 합성 중 NaCl과 CuSO4에서 이온화 된 Na+, SO4−2 이온이 Na2SO4로 합성되었다. 구리 나노 입자가 성장을 방해 하여 균일한 입자를 합성하는 방안과 수열 합성 후 Na2SO4를 제거 할 수 있는 방안의 연구가 필요하다. 그림 11은 아스코르빈산의 첨가 유무에 따른 X-선 회절 선의 변화 결과이다. 이전의 실험 결과에 서는 아스코르빈산을 첨가하지 않은 경우 산화물 상이 나 타났다. 하지만 이 실험에서는 아스코르빈산을 첨가한 경 우에도 산화물 상이 나타났는데 이는 수열 합성의 경우 고온의 가열로에서 실험을 하여야 하기 때문에 열에 약한 아스코르빈산이 고온에서 제대로 역할을 하지 않아서 아 스코르빈산을 첨가한 후 에도 산화물 상이 나타난 것으로 보인다. 그림 12는 Fe-SEM으로 구리 나노 입자의 형상을 관찰한 것이다. 역 미셀 법과 마찬가지로 입자들의 크기는 평균 적으로 100 nm 이하의 구리 나노 입자를 가졌지만 입자들의 입도가 비교적 불균일하게 나타났고 입자들이 서로 뭉쳐지는 현상이 보였다. 이것은 열에 취약한 아스코 르빈산에 의해 산화가 방지 되지 않아서 생긴 Cu2O상 등 의 존재에 의해 균일한 입자를 합성하는 것을 방해했기 때문이다. 이 또한 황산화물과 산화물 상과 같은 불순물을 제거하여 균일한 입자를 형성할 수 있는 방안의 연구가 더 필요하다.
결과 및 고찰
Fig. 1

Color changes during the present reduction method: the starting solution of distilled water (1), after the addition of metallic salts, capping agent and antioxidant (2), after the addition of alkalinity control agent (3), and the final solution with reducing agent (4).

Fig. 2
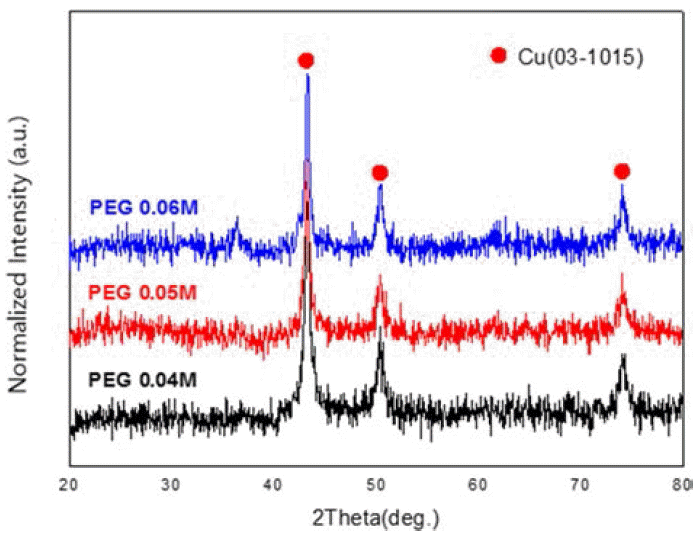
Change in XRD patterns with increasing the content of PEG: sample (PEG 0.04), (PEG0.05), (PEG0.06).

Fig. 3

Changes in X-ray diffraction patterns with increasing the amount of reducing agent: sample (NaBH4 0.02M), (NaBH4 0.04M), (NaBH4 0.06M).

Fig. 4
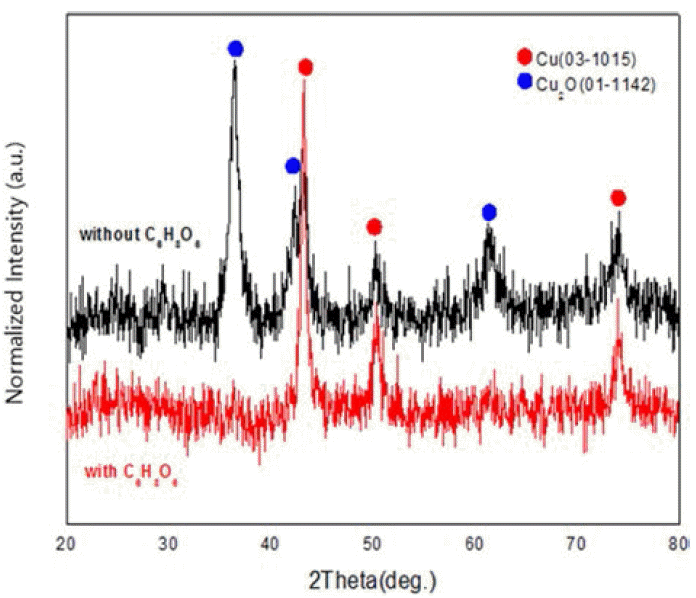
Changes in X-ray diffraction patterns before and after the addition of ascorbic acid (C6H8O6): sample (with ascorbic acid), and (without ascorbic acid).

Fig. 5

Transmission electron microscopy morphology of synthesized Cu particles: (a) sample (PEG 0.04M), (b) sample (PEG 0.05M), and (c) sample (PEG 0.06M).

Fig. 6
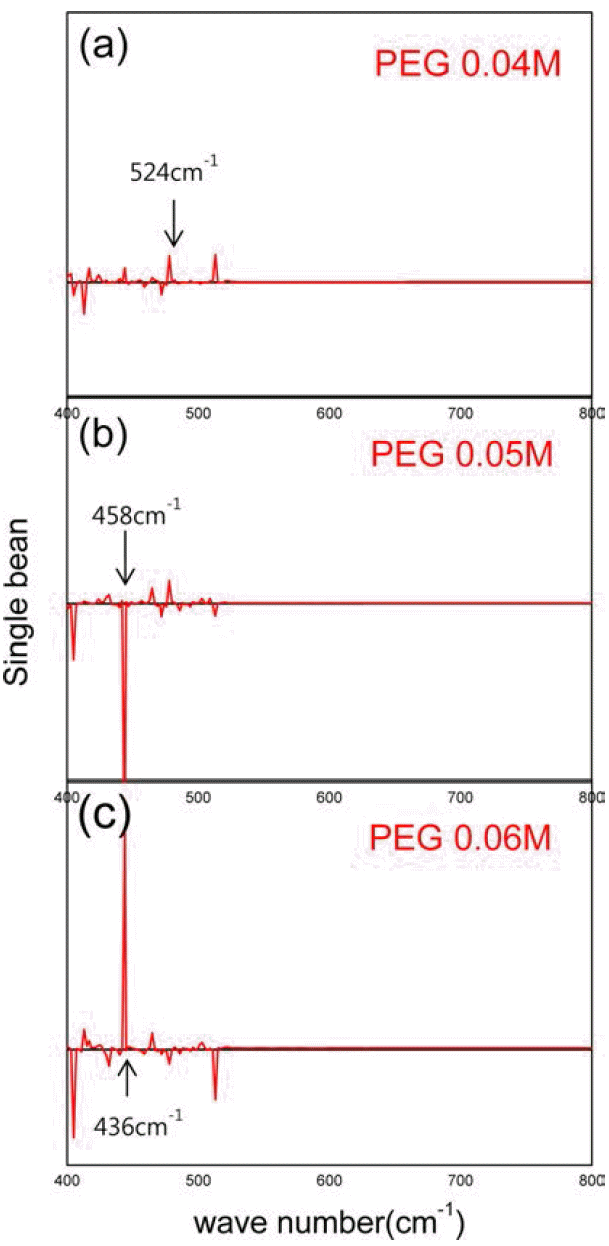
Results of Fourier transform infrared spectroscopy with increasing the content of PEG: (a) sample (PEG0.04M), (b) sample (PEG0.05M), and (c) sample (PEG0.06M).

Table 2
Composition of examined samples in reverse micelle method
Fig. 8
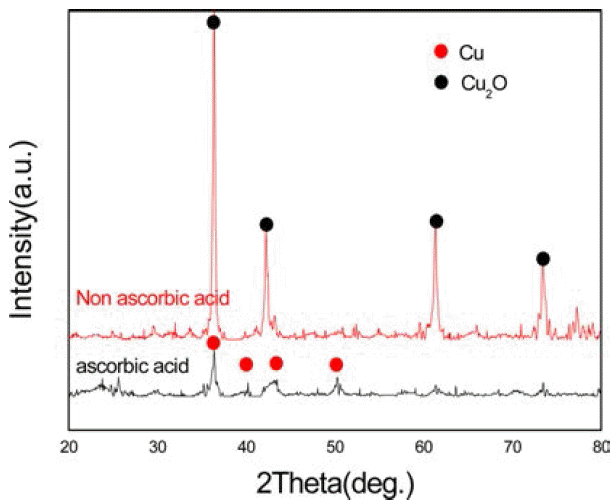
Changes in X-ray diffraction patterns before and after the addition of ascorbic acid (C6H8O6).

Table 3
Composition of examined samples in hydrothermal method
| Sample No. | Copper(II)sulfate pentahydrate salt | Ascorbic acid | Sodium hydroxide | Sodium borohydride |
|---|---|---|---|---|
|
|
||||
| 1 | 0.02M | 0.1 | 0.1 | 0.04 |
| 2 | 0.02M | X | 0.1 | 0.04 |
| 3 | 0.02M | 0.1 | 0.1 | 0.05 |
| 4 | 0.02M | 0.1 | 0.1 | 0.06 |
- 본 연구에서는 화학적 환원법에 의한 구리 나노 입자의 합성을 조사하였다. 사용된 금속염은 황산구리(II) 오수화 물 이였으며, 환원제는 수소화붕소나트륨, 캐핑제는 PEG 를 사용하였다. 특히 환원제와 캐핑제의 농도에 따른 입자 특성과 형상을 연구하였다.
- 합성된 구리 나노 입자의 크기는 PEG농도가 변화 하여 도 70 nm 이하로 차이를 볼 수 없었다. 그러나 PEG농도 가 0.04M 이상 증가 할수록 입자들은 응집되지만 크기가 균일 해지고 감소 하였다. 반면, PEG를 0.04M 이상 첨가 할 경우 세척 후에도 잔류물이 완전히 제거 되지 않는 문 제가 있었다. 이는 구리 나노 입자가 PEG에 두껍게 층을 이루며 갇혀 버리는 현상 때문이었다. 캐핑제는 첨가량이 증가할수록 환원 중 구리 나노 입자의 입자 성장을 억제 하여 안정화 시켜주었다. 다만 PEG 농도가 증가 할수록 세척 후에도 캐핑제의 잔류물이 완전히 제거 되지 않는 문제점이 있었으나 농도를 조절함으로써 해결할 수 있었 다. 환원제의 양이 0.06M 이상으로 증가하면 구리 나노 입자가 쉽게 산화 되었다. 구리 나노 입자의 산화 문제는 아스코르빈산을 적정량 이용하여 방지 할 수 있었다.
- 이러한 환원법을 역 미셀 법에 적용하여 보았다. 그 결 과 환원제의 양이 증가함에 따라 구리 나노 분말의 입자 수가 증가하였다. 그러나 역 미셀 법의 경우 화학적 환원 법에 사용되었던 캐핑제는 없었기 때문에 입자의 분포가 불균일 하였고 아스코르빈산을 첨가함으로써 산화가 방지 되었다. 성공적으로 구리 나노 입자를 합성하였지만 입자 의 크기가 25~200 nm로 불균일 하였으며, 입자들이 뭉쳐 지는 형상을 보였다.
- 마지막으로 환원법을 수열합성법에 적용한 경우, 환원 제인 수소화붕소나트륨의 농도가 0.04M일 때보다 0.05M 일 때 구리 나노 입자인 Cu2O상이 더 많이 나타났다. 따 라서 환원제의 양이 많을수록 구리 나노 입자의 수가 증 가 한다는 것을 알 수 있다. 하지만 구리나노입자를 합성 중 NaCl과 CuSO4에서 이온화 된 Na+, SO4−2 이온이 Na2SO4로 합성되었다. 이것이 구리 나노 입자가 성장을 방해 하여 균일한 입자를 합성하는 것을 방해하였다. 따라 서 균일한 입자를 형성하는 방안과 수열 합성 후 Na2SO4 를 제거 할 수 있는 방안의 연구가 필요하다. 아스코르빈 산을 첨가 하여 산화를 방지 하려 하였으나, 열에 취약한 아스코르빈산의 의해 산화가 방지 되지 않았다. 성공적으 로 구리 나노 입자를 합성하였으나 입자의 크기가 25~200 nm로 불균일 하였으며, 입자들이 뭉쳐지는 형상을 보였다.
- 결론적으로 본 연구의 환원 방법을 통해 산화가 억제된 100 nm 이하의 구리 나노 입자를 효과적으로 합성 할 수 있다. 화학적 환원법을 역미셀법이나 수열 합금에 적용할 경우 불균일한 입도분포, 과도한 불순 잔류물 등의 이유로 단순 환원법으로 합성한 분말에 비해 미흡하였다. 향후 후 속연구를 통해 환원 중 응집된 구리 나노 입자의 균일화 와 세척 시 캐핑제의 잔류 문제를 위한 캐핑제의 농도와 환원제의 농도비에 대한 최적화 연구가 필요하다. 또한 환 원 후 잔류하는 불순물에 대한 처리 연구가 필요하다.
결 론
-
Acknowledgements
- 이 논문은 ‘2015년도 안동대학교 학술연구조성사업’에 의하여 연구되었음.
감사의 글
- 1. Y Kobayashi, T Shirochi, Y Yasuda and T Morita: J. Min. Metall. Sect. B., (2013) 49 65.Article
- 2. K S Chou and C Y Ren: Mater. Chem. Phys., (2000) 64 241.Article
- 3. Q L Zhang, Z M Yang, X Z Lan, Y J Guo and B J Ding: Trans. Nonferrous Met. Soc., (2010) 20 242.
- 4. H Khalid, S Shamaila, N Zafar and S Shahzadi: Sci. Int., (2015) 27 3085.
- 5. S Magdassi, M Grouchko and A Kamyshny: Materials., (2010) 3 4626.Article
References
Figure & Data
References
Citations
Citations to this article as recorded by 

- Correlation between electrical conductivity and antibacterial activity of chitosan-stabilized copper and silver nanoparticles
C.Raja Mohan, Ruckmani Kandasamy, J. Kabiriyel
Carbohydrate Polymer Technologies and Applications.2024; 7: 100503. CrossRef - Green Synthesis and Characterization of Natural Magnetic Particles/Chitosan Composite Material Impregnated with Copper Nanoparticles
Defia Indah Permatasari, Bambang Rusdiarso, Nuryono Nuryono
Solid State Phenomena.2022; 339: 19. CrossRef - Copper Nanoparticle(CuNP’s)Synthesis: A review of the various ways with Photocatalytic and Antibacterial Activity
Israfil Alam Tito, Sahab Uddin, Shafiul Islam, Snahasish Bhowmik
Oriental Journal Of Chemistry.2021; 37(5): 1030. CrossRef
Synthesis of Copper Nanoparticles by a Chemical Reduction Method

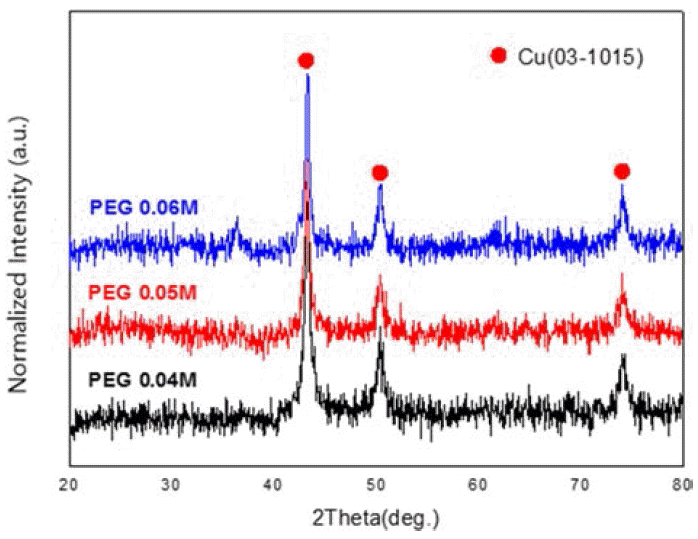
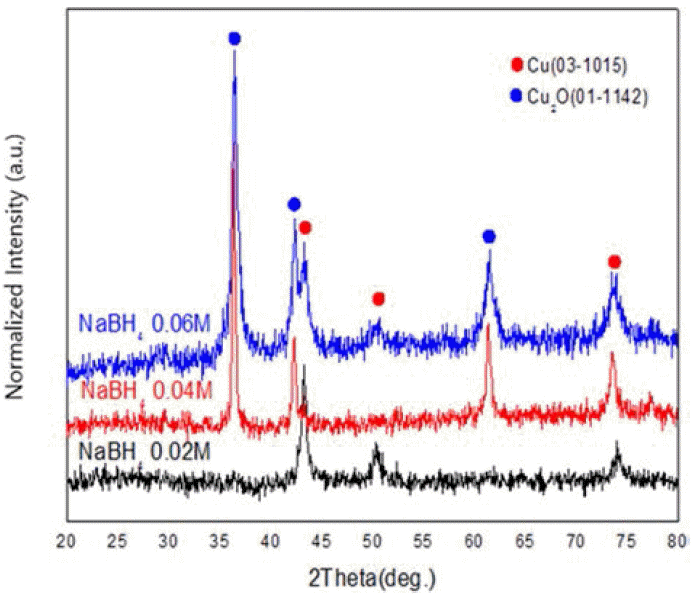


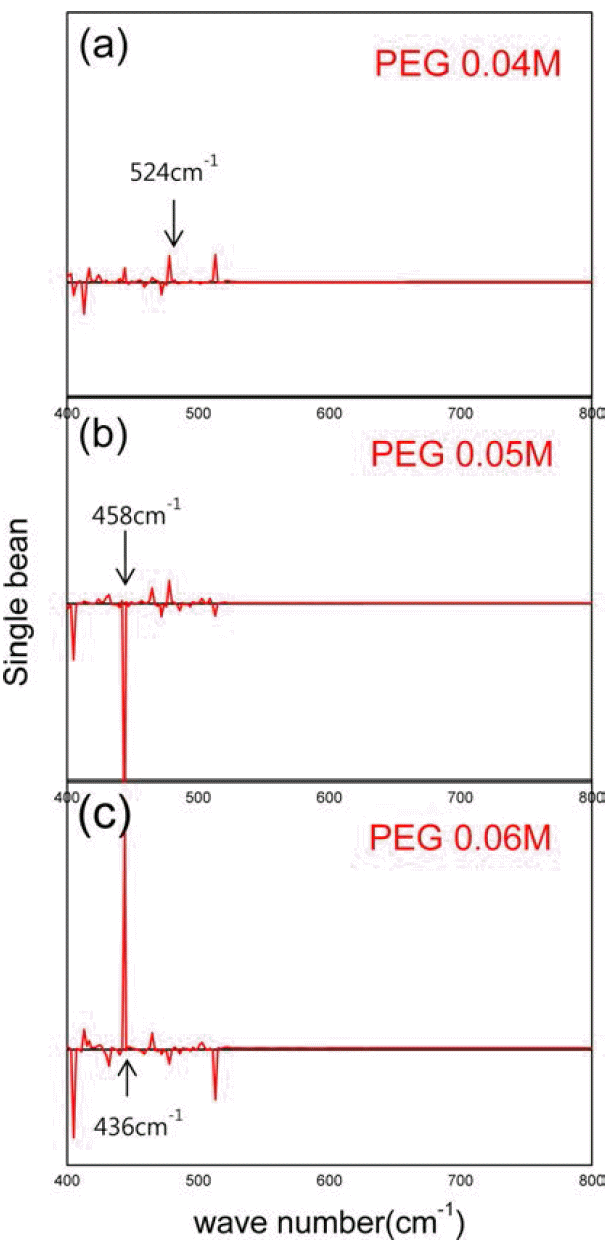
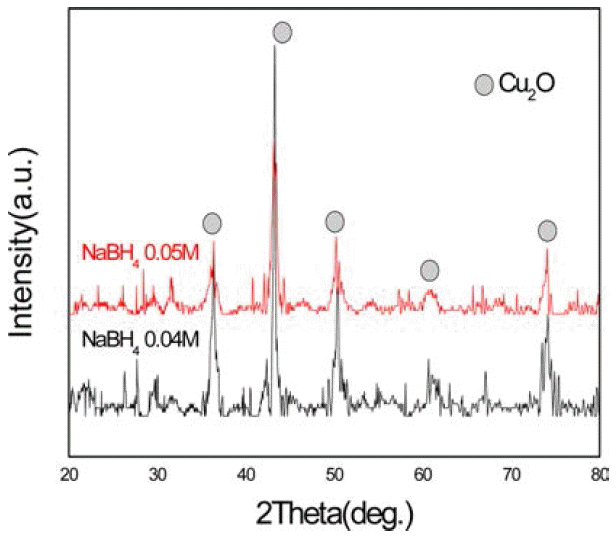





Fig. 1
Color changes during the present reduction method: the starting solution of distilled water (1), after the addition of metallic salts, capping agent and antioxidant (2), after the addition of alkalinity control agent (3), and the final solution with reducing agent (4).
Fig. 2
Change in XRD patterns with increasing the content of PEG: sample (PEG 0.04), (PEG0.05), (PEG0.06).
Fig. 3
Changes in X-ray diffraction patterns with increasing the amount of reducing agent: sample (NaBH4 0.02M), (NaBH4 0.04M), (NaBH4 0.06M).
Fig. 4
Changes in X-ray diffraction patterns before and after the addition of ascorbic acid (C6H8O6): sample (with ascorbic acid), and (without ascorbic acid).
Fig. 5
Transmission electron microscopy morphology of synthesized Cu particles: (a) sample (PEG 0.04M), (b) sample (PEG 0.05M), and (c) sample (PEG 0.06M).
Fig. 6
Results of Fourier transform infrared spectroscopy with increasing the content of PEG: (a) sample (PEG0.04M), (b) sample (PEG0.05M), and (c) sample (PEG0.06M).
Fig. 7
Changes in X-ray diffraction patterns with increasing the amount of reducing agent.
Fig. 8
Changes in X-ray diffraction patterns before and after the addition of ascorbic acid (C6H8O6).
Fig. 9
FE-SEM of the copper particles synthesized in reverse micelle method.
Fig. 10
Changes in X-ray diffraction patterns with increasing the amount of reducing agent.
Fig. 11
Changes in X-ray diffraction patterns before and after the addition of ascorbic acid (C6H8O6).
Fig. 12
FE-SEM of the copper particles synthesized in hydrothermal.
Fig. 1
Fig. 2
Fig. 3
Fig. 4
Fig. 5
Fig. 6
Fig. 7
Fig. 8
Fig. 9
Fig. 10
Fig. 11
Fig. 12
Synthesis of Copper Nanoparticles by a Chemical Reduction Method
| Sample No. | Metallic salts (copper(II) sulfate pentahydrate salt) | Reducing agent (sodium borohydride) | Capping agent (polyethylene glycol) | Antioxdant (ascorbic acid) | Alkalinity control agent (sodium hydroxide) |
|---|---|---|---|---|---|
|
|
|||||
| 1 | 0.02M | 0.02M | 0.04M | 0.1M | 0.1M |
| 2 | 0.02M | 0.02M | 0.05M | 0.1M | 0.1M |
| 3 | 0.02M | 0.02M | 0.06M | 0.1M | 0.1M |
| 4 | 0.02M | 0.02M | 0.04M | X | 0.1M |
| 5 | 0.02M | 0.04M | 0.04M | 0.1M | 0.1M |
| 6 | 0.02M | 0.06M | 0.04M | 0.1M | 0.1M |
| Sample No. | A solution (included metal salt) | B solution (included reducing agent) | Surfactant | Cosurfactant | Matricx |
|---|---|---|---|---|---|
|
|
|||||
| 1 | 0.02M CuSo4 | 0.02M NaBH4 | CTAB (C19H42BrN) | 1-Butanol | Octane |
| 2 | 0.02M CuSo4 | 0.04M NaBH4 | CTAB (C19H42BrN) | 1-Butanol | Octane |
| 3 | 0.02M CuSo4 | 0.06M NaBH4 | CTAB (C19H42BrN) | 1-Butanol | Octane |
| Sample No. | Copper(II)sulfate pentahydrate salt | Ascorbic acid | Sodium hydroxide | Sodium borohydride |
|---|---|---|---|---|
|
|
||||
| 1 | 0.02M | 0.1 | 0.1 | 0.04 |
| 2 | 0.02M | X | 0.1 | 0.04 |
| 3 | 0.02M | 0.1 | 0.1 | 0.05 |
| 4 | 0.02M | 0.1 | 0.1 | 0.06 |
Table 1
Composition of examined samples in chemical reduction method
Table 2
Composition of examined samples in reverse micelle method
Table 3
Composition of examined samples in hydrothermal method
Table 1
Table 2
Table 3
TOP
 KPMI
KPMI



 Cite this Article
Cite this Article












