Articles
- Page Path
- HOME > J Korean Powder Metall Inst > Volume 23(6); 2016 > Article
-
ARTICLE
졸-겔법에 의한 단분산 실리카 나노입자 합성에 미치는 반응변수의 영향 - 임영현, 김도경a, 정영근b,*
- Effect of Reaction Parameters on Silica Nanoparticles Synthesized by Sol-gel Method
- Young-Hyun Lim, Do Kyung Kima, Young-Keun Jeongb,*
-
Journal of Korean Powder Metallurgy Institute 2016;23(6):442-446.
DOI: https://doi.org/10.4150/KPMI.2016.23.6.442
Published online: November 30, 2016
부산대학교 재료공학부
건양대학교 의과학과
b 부산대학교 융합학부
Department of Material Engineering, Pusan National University, Busan 46241, Korea
a Department of Medical Science, Konyang University, Daejeon 32992, Korea
b Graduate School of Convergence Science, Pusan National University, Busan 46241, Korea
- *Corresponding author : Young-Keun Jeong, +82-51-510-2483, +82-51-581-2991, nano@pusan.ac.kr
• Received: November 22, 2016 • Revised: December 1, 2016 • Accepted: December 3, 2016
© The Korean Powder Metallurgy Institute. All rights reserved.
- 2,872 Views
- 46 Download
- 2 Crossref
Abstract
- The sol-gel method is the simplest method for synthesizing monodispersed silica particles. The purpose of this study is to synthesize uniform, monodisperse spherical silica nanoparticles using tetraethylorthosilicate (TEOS) as the silica precursor, ethanol, and deionized water in the presence of ammonia as a catalyst. The reaction time and temperature and the concentration of the reactants are controlled to investigate the effect of the reaction parameters on the size of the synthesized particles. The size and morphology of the obtained silica particles are investigated using transmission electron microscopy and particle size analysis. The results show that monodispersed silica particles over a size range of 54-504 nm are successfully synthesized by the sol-gel method without using any additional process. The nanosized silica particles can be synthesized at higher TEOS/H2O ratios, lower ammonia concentrations, and especially, higher reaction temperatures.
- 단분산 실리카 입자는 간단한 제조 과정과 다양한 용도 로 인해 산업 분야 및 과학 분야에 많이 쓰이고 있다. 실 리카 입자는 기계적, 전기적, 열적 성능을 향상시키기 때 문에 얇은 박막, 열적/전기적 단열재, 유화제, 촉매, 색소 등에 사용된다[1]. 최근에는 신체 안정성과 다공성 구조 등의 특징으로 인해 조영제나 생체 의약에 관한 적용으로 도 연구되고 있다[2]. 나노 실리카 입자를 만들 때 주로 졸- 겔 방법을 사용하는데, 그 이유는 균일 크기의 단분산 입 자를 만들 수 있고 입자를 제어한 상태에서 구형을 잘 유 지하기 때문이다[3]. 실리카 입자의 물성을 제어하기 위해 서는 입자의 크기 및 분포가 주된 요소이다.
- 졸-겔 방법은 Stöber에 의하여 개발된 방법으로 물과 알 코올의 혼합용액 속에서 tetraethylorthosilicate(TEOS)를 가수분해 시키는 것이다. 이때 일어나는 가수 분해와 축합 반응은 다음과 같다[4, 5].
- 짧은 시간 차이로 가수분해가 먼저 일어난 뒤 축합반응 이 뒤따르게 된다[6]. 여기에서 필요한 물의 양은 실리콘 알콕사이드 1몰에 대하여 4몰이 필요하며, 축합반응이 완 전히 일어난다면 결과적으로 2몰의 물이 필요하게 된다. 그러나, 실제 반응에서는 TEOS에 대한 물의 비는 5배 이 상이 되어야 합성반응이 진행되며, pH도 높아야만 축합반 응이 촉진된다[4].
- Bogush 등에 의하면 실리카 입자 크기와 크기분포의 핵 심 변수는 5가지로써, TEOS의 농도, 암모니아의 농도, 물 의 농도, 알코올의 농도, 반응 온도이다[7]. TEOS의 농도 가 커지게 되면 입도 분포가 커지며, 구형에서 벗어나게 된다[5]. 일반적으로 입자가 작고 입도분포가 좁게 하기 위해서는 적은 양의 알코올을 사용하여야 하고, 빠른 반응 과 작은 입자를 위해서는 적은 양의 알콕사이드를 사용한 다. 이 외에도 반응 시간이나 건조 온도의 영향에 대한 연 구가 이루어지고 있다[8].
- 기존의 졸-겔 방법으로는 용액들의 농도를 조절하여 주 로 200~700 nm의 실리카를 만드는데 사용되어왔다. 또한 다양한 크기의 단분산 실리카 입자를 합성하기 위하여 변 형된 졸-겔 방법들이 연구되었다. NaI, NH4Br나 계면활성 제와 같은 특정 재료를 첨가하거나[3, 4, 9, 10], 초음파, Small Angle X-Ray Scattering(SAXS)와 같이 공정을 추가 하는 방식이다[11]. 변형된 방식들로 100 nm 이하의 단분 산 나노 실리카 입자를 만드는 연구는 최근까지도 이루어 지고 있다.
- 본 연구에서는 불순물로 작용할 수 있는 첨가제를 사용 하지 않으면서, 또한 공정 단계를 최소화하기 위해 추가적 인 공정을 도입하지 않고 나노크기의 단분산 실리카 입자 를 합성하고자 하였다. 이를 위하여 졸-겔법의 다양한 반 응변수에 대한 실험을 실시하여 각 변수가 실리카 입자의 크기에 미치는 영향을 조사하였다.
서 론
- 실험에 사용된 용액은 에탄올(99.8%), 암모니아수(25%, Aldrich), TEOS(99.99%, Aldrich), Milli Q 초순수를 사용 하였다. 정해진 양의 에탄올, 암모니아수, 초순수의 혼합 용액에 TEOS를 첨가하여 반응을 시켰다. 혼합 용액은 비 커에서 마그네틱 교반기를 이용하여 정해진 시간 동안 교 반한 후에, 잔류 물질들을 제거하기 위해 에탄올과 초순수 를 사용하여 3회 세척하였다[12]. 반응에서 사용되는 에탄 올은 반응과는 직접 관계가 없으나 TEOS와 물의 혼합을 위하여 첨가된다.
- 실리카 입자를 합성하기 위해 실험에서 사용된 합성 조 건을 표 1에 나타내었다. TEOS, H2O, NH3의 농도 및 반 응 온도를 변화시켜 가면서 합성된 입자크기에 미치는 영 향을 조사하였다. H2O의 양은 25% 암모니아수에서 첨가 되는 H2O 양을 고려하여 최종적으로 표 1과 같은 조건이 되도록 하였다. 합성 조건은 합성된 실리카의 크기가 100 nm 이하가 되고 단분산으로 이루어지는 것을 목표로 하였으며, 병행하여 반응 시간에 따른 영향을 조사하였다. 반응 시간은 최대 24시간까지 관찰하였다. 입도 분석을 위 해서는 5 nm- 3 μm 크기의 입자 측정이 가능한 레이저 입 도분석기(Brookhaven Instrument, BI-90)를 사용하였고, 입 자의 크기 및 형상의 관찰은 TEM(Transmission Electron Microscope, JEOL, 2000EX)을 이용하였다.
실험방법
- 3.1. 반응 시간의 영향
- 에탄올, H2O, NH4OH의 혼합 용액에 TEOS를 첨가하게 되면, MS1의 조건과 같이 물의 농도가 높을 경우에는 약 1분 정도 후에 반응 용액 내에서 입자가 형성되어 반투명 의 용액이 되어 반응이 일어났음을 알 수 있었다. 그러나 물의 양이 적을 경우(MS2~MS5)에는 반응이 늦어 30분 이상이 되어야 반응이 진행되는 것이 확인되었다.
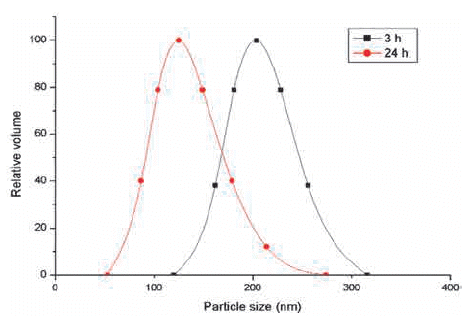
- 육안으로 반응이 일어난 것으로 확인이 되어도 그림 1 (a)의 TEM 사진 상에 나타낸 바와 같이 반응 시작 후 3시 간이 되어도 반응이 완전히 끝나지 않고, 입자 주위에 미 반응 물질이 남아있는 것을 알 수 있다. 또한 반응이 진행 중일 때에는 미 반응 물질들에 의하여 입자들 간에 응집 이 되어 있는 것을 알 수 있으며, 그림 2에 나타낸 바와 같이 입도 측정 결과도 동일한 양상을 나타내고 있다.
- 한편 그림 1 (b)의 사진에서 알 수 있듯이, 반응시간을 충분히 한 후에는 미 반응 물질이 없으며, 크기가 균일하 고 구형의 실리카 입자를 얻을 수 있었다. 따라서 반응 시 간이 충분하지 않을 경우에는 입자들 간의 응집으로 인하 여 입도측정기에서 측정되는 입자의 크기는 실리카 1차 입자의 크기가 아니고, 응집된 2차 입자의 크기가 된다. 결론적으로 물의 양이 적고 pH가 낮을 경우에는 반응에 필요한 시간이 조건에 따라서 최소 12시간에서 24시간 이 상이 되어야 하는 것으로 확인되었다.
- 3.2. 반응 용액 농도의 영향
- 각각의 반응조건으로 충분한 시간동안 반응시켜 합성된 실리카 입자의 평균 크기를 입도분석기로 측정한 결과를 표 2에 나타내었다. 졸-겔법에 의한 실리카의 합성은 가수 분해와 축합반응에 의하여 진행된다. 따라서 가수분해를 위해서는 물의 양이 충분해야하고, 축합반응의 촉진을 위 해서는 높은 pH가 필요하므로 촉매역할을 하는 암모니아 도 많은 양이 필요하다[13]. 이러한 일반적인 실리카 합성 조건(MS1)에서 합성한 실리카 입자를 그림 3에 나타내었 다. 이 조건에서는 충분한 물과 암모니아가 반응속도를 촉 진시켜, 입자의 핵생성 속도보다 입자의 성장속도가 빠르 게 되어 504 nm의 큰 실리카 입자가 합성되었다[5, 10, 14]. 따라서 본 연구에서는 물과 암모니아의 양을 최소화하여 나노크기의 실리카 입자가 합성될 수 있도록 하였다.
- 그림 4에는 암모니아와 물의 농도를 최소화하고 그 농 도를 변화시켜 합성한 실리카 입자를 나타내었다. TEOS 의 양을 일정하게 하고 물과 암모니아의 양을 변화시킨 MS2와 MS3 조건에서 입자의 크기가 각각 131 nm(그림 4(a))와 71 nm(그림 4(b))로 많은 차이를 보이고 있다. 그 러나 그림 4(b)와 (c)에 나타낸 바와 같이 물과 암모니아 의 농도는 일정하게 하고 TEOS의 농도를 0.4 mol%와 0.3 mol%로 하였을 때, TEOS의 농도는 입자 크기에 많은 영향을 미치지 않았다. Rahman 등에 의하면 암모니아 양 이 불충분한 경우 TEOS가 증가할수록 입자 크기가 감소 한다고 보고한 바가 있다[5]. 본 연구에서도 TEOS 양이 0.3 mol%에서 0.4 mol%로 증가하였을 경우, 평균 입자 크 기가 77 nm에서 71 nm로 감소하였다(MS3, MS4). 이와 같은 입자 크기의 감소는 촉매제인 암모니아 양의 결핍으 로 반응량이 감소하여 비교적 작은 크기가 되었다고 판단 된다. 즉 TEOS는 암모니아의 반응 한계량과 밀접한 관련 이 있다고 할 수 있다.
- 3.3. 반응온도의 영향
- 실리카 입자의 크기를 최소화하기 위하여 용액의 농도 조건을 MS2와 동일하게 하고, 반응 온도만 상온에서 50°C로 변경하여 합성한 결과를 그림 5에 나타내었다. 상 온에서 합성된 입자는 약 131 nm의 크기를 나타내지만, 50°C에서 합성된 입자는 54 nm를 나타내고 있다. 즉, 반응 온도는 단분산 실리카 입자의 크기에 많은 영향을 미치는 것을 알 수 있다.
- 다음 식은 액상으로부터 균질 핵 생성 시 반응 온도가 핵 생성 속도에 미치는 영향을 나타낸 것이다[15].
- 여기에서 J는 핵생성 속도(unit/s), JO는 초기 핵생성 속 도(unit/s), ΔGD는 확산 활동 자유 에너지 변화(J), ΔG*는 임계 핵생성 자유 에너지 변화(J), k는 볼츠만 상수(J/K), T는 반응온도(K)이다. 온도가 증가할수록 핵생성 속도가 빠르게 되고, 핵생성이 많이 일어나게 되며, 입자 크기는 작아지게 된다.
- 그러나 계속해서 온도를 높일수록 입자 크기가 작아지 는 것은 아니고, 입자의 크기는 재료의 용해도에 의해서도 영향을 받기 때문에 이러한 경향은 바뀔 수가 있다. 온도 를 많이 올릴 경우 용해도가 점점 높아지기 때문에 응집 체가 많이 생성되어 전체적인 입자 크기가 증가한다. Rahman 등[5]에 의하면 온도를 50°C 이상으로 높일 경우 입자 크기는 오히려 증가할 가능성이 크다고 보고한 바 있다. 즉 본 연구에서의 반응온도인 50°C가 입자 크기를 최소화하기 위한 최대 온도에 가깝다고 할 수 있다.
- 일반적으로 100 nm 보다 작은 크기의 입자 합성 시에는 입도 분포가 커지며, 또한 입자의 형태도 구형에서 벗어나 게 된다. 그러나 본 연구에서 합성한 실리카 입자들은 그 림 5에서 알 수 있듯이 좁은 입도 분포를 유지하면서, 50 nm의 크기까지 줄일 수 있는 것을 확인할 수 있었다.
결과 및 고찰
Table 2
Average particle sizes of synthesized silica
| Specimen | Average size (nm) |
|---|---|
|
|
|
| MS1 | 504 |
| MS2 | 131 |
| MS3 | 71 |
| MS4 | 77 |
| MS5 | 54 |
Fig. 4

TEM micrographs of silica particles synthesized under different synthetic conditions: (a) MS2, (b) MS3, and (c) MS4.

- 기존의 단분산 실리카를 합성하기 위한 졸-겔 방법에서 새로운 공정을 추가하지 않고, 반응 온도와 반응 용액의 농도를 변화시켜 나노 크기의 실리카 입자를 합성하였다. 용액의 농도에 따라 실리카 입자가 합성되기 위해 필요한 반응시간은 빠를 경우 1분 이내에 반응이 되지만, 나노 크 기의 작은 입자를 합성하기 위해서는 최소 12시간 이상이 필요하였다. 그리고 각 반응 물질의 농도를 줄이더라도 상 온에서는 70 nm 이하의 크기를 얻을 수 없었으나, 합성온 도를 50°C로 높였을 경우에는 약 50 nm의 목표 크기의 입 자를 얻을 수 있었다. 따라서 반응 변수의 조절만으로 약 50 nm에서 500 nm 범위의 단분산 실리카 입자의 합성이 가능하다고 할 수 있다. 특히 추가적인 공정이 없이 졸-겔 반응 공정만으로 기존에는 합성하기 어려웠던 100 nm 이 하의 단분산 실리카를 합성함으로써, 다양한 분야의 소재 로 활용될 수 있을 것으로 기대된다.
결 론
-
Acknowledgements
- 이 논문은 부산대학교 기본연구지원사업(2년)에 의하여 연구되었음.
감사의 글
- 1. G Herbert: J. Eur. Ceram. Soc., (1994) 14 205.
- 2. N A Zainal, S R A Shukor, H A A Wab and K A Razak: Chem. Eng. Trans., (2013) 32 2245.
- 3. T Sugimoto, Fine Particles: Synthesis Characterization and Mechanisms of Growth, (2000) CRC Press, New York 126.
- 4. K S Rao, K El-Hami, T Kodaki, K Matsushige and K Makino: J. Colloid Interface Sci., (2005) 289 125.Article
- 5. I A Rahman, P Vejayakumaran, C S Sipaut, J Ismail, M A Bakar, R Adnan and C K Chee: Colloids Surf. A Physicochem. Eng. Asp., (2007) 294 102.Article
- 6. S Tabatabaei, A Shukohfar, R Aghababazadeh and A Mirhabibi: J. Phys. Conf. Ser., (2006) 26 371.Article
- 7. G H Bogush, M A Tracy and V C F ZukoskiI: J. Non Cryst. Solids., (1988) 104 95.Article
- 8. H N Azlina, J N Hasnidawani, H Norita and S N Surip: Acta Phys. Pol. B Proc. Suppl., (2016) 129 842.Article
- 9. I A Rahman, P Vejayakumaran, C S Sipaut, J Ismail, M A Bakar, R Adnan and C K Chee: Ceram. Int., (2006) 32 691.Article
- 10. L P Singh, S K Agarwal, S K Bhattacharyya, U Sharma and S Ahalawat: Nanomater. Nanotechnol., (2011) 1 44.
- 11. D L Green, J S Lin, Y F Lam, M Z C Hu, D W Schaefer and M T Harris: J. Colloid Interface Sci., (2003) 266 346.Article
- 12. I A M Ibrahim, A A F Zikry and M A Sharaf: J. Am. Sci., (2010) 6 985.
- 13. C J Brinker and G W Scherer, Sol-Gel Science: The Physics and Chemistry of Sol-Gel Processing, (1990) Academic Press, San Diego 97.
- 14. T Matsoukas and E Gulari: J. Colloid Interface Sci., (1988) 124 252.Article
- 15. S K Park, K D Kim and H T Kim: Colloids Surf. A Physicochem. Eng. Asp., (2002) 197 7.
References
Figure & Data
References
Citations
Citations to this article as recorded by 

- SYNTHESIS OF SILICA NANOPARTICLES FROM SUGARCANE WASTE: PRECIPITATION-BASED SIZE CONTROL AND CHARACTERIZATION
Mustapha Sulaiman, Naseer Inuwa Durumin Iya, Mamudu Aliyu
FUDMA JOURNAL OF SCIENCES.2024; 8(3): 222. CrossRef - Nanostructure Construction of SiO2@Au Core-Shell by In-situ Synthesis
Mu-Jae Pyeon, Do Kyung Kim, Young-Keun Jeong
Journal of Korean Powder Metallurgy Institute.2018; 25(5): 420. CrossRef
Effect of Reaction Parameters on Silica Nanoparticles Synthesized by Sol-gel Method




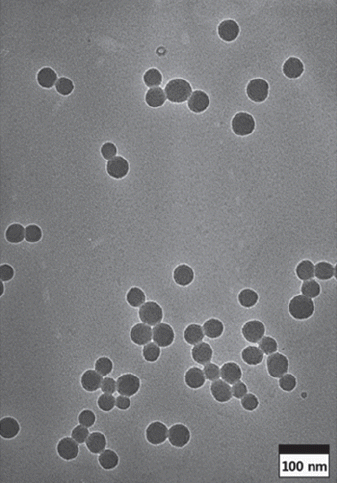
Fig. 1
TEM micrographs of silica particles (MS5) synthesized for (a) 3h and (b) 24h.
Fig. 2
Particle size distributions of silica (MS2) synthesized for different reaction time.
Fig. 3
TEM micrograph of silica particles synthesized under MS1 condition.
Fig. 4
TEM micrographs of silica particles synthesized under different synthetic conditions: (a) MS2, (b) MS3, and (c) MS4.
Fig. 5
TEM micrograph of silica nanoparticles (MS5) synthesized at reaction temperature of 50°C.
Fig. 1
Fig. 2
Fig. 3
Fig. 4
Fig. 5
Effect of Reaction Parameters on Silica Nanoparticles Synthesized by Sol-gel Method
| Specimen | TEOS | H2O | Ethyl Alcohol | NH3 | Temperature |
|---|---|---|---|---|---|
|
|
|||||
| MS1 | 0.6 | 66.4 | 22.0 | 12.0 | RT |
| MS2 | 0.4 | 5.8 | 92.0 | 1.8 | RT |
| MS3 | 0.4 | 3.0 | 95.6 | 1.0 | RT |
| MS4 | 0.3 | 3.0 | 95.7 | 1.0 | RT |
| MS5 | 0.4 | 5.8 | 92.0 | 1.8 | 50°C |
| Specimen | Average size (nm) |
|---|---|
|
|
|
| MS1 | 504 |
| MS2 | 131 |
| MS3 | 71 |
| MS4 | 77 |
| MS5 | 54 |
Table 1
Synthetic conditions for silica particles (mol%)
Table 2
Average particle sizes of synthesized silica
Table 1
Table 2
TOP
 KPMI
KPMI



 Cite this Article
Cite this Article





