Articles
- Page Path
- HOME > J Korean Powder Metall Inst > Volume 24(4); 2017 > Article
-
ARTICLE
P/M Fecralloy 성형체의 고온산화 및 전기저항 안정성에 미치는 SiO2 첨가 효과 - 박진우a, 옥진욱a, 정우영a, 박동규c, 안인섭a,b,*
- The Effect of SiO2 addition on Oxidation and Electrical Resistance Stability at High-temperature of P/M Fecralloy Compact
- Jin-Woo Parka, Jin-Uk Oka, Woo-young Junga, Dong-kyu Parkc, In-Shup Ahna,b,*
-
Journal of Korean Powder Metallurgy Institute 2017;24(4):292-297.
DOI: https://doi.org/10.4150/KPMI.2017.24.4.292
Published online: July 31, 2017
a 경상대학교 나노·신소재 공학부
b 경상대학교 그린에너지 융합연구소
c 경상대학교 링크 사업단
a School of Nano and Advanced Materials Science & Engineering, Gyeongsang National University, 501,Jinju-daero, Jinju-si, Gyeongsangnam-do 52828, Republic of Korea
b RIGET, Gyeongsang National University, 501, Jinju-daero, Jinju-si, Gyeongsangnam-do 52828, Republic of Korea
c LINC, Gyeongsang National University, 501, Jinju-daero, Jinju-si, Gyeongsangnam-do 52828, Republic of Korea
- *Corresponding Author: In-shup Ahn, +82-55-772-1662, +82-55-772-1670, ais@gnu.ac.kr
© The Korean Powder Metallurgy Institute. All rights reserved.
- 644 Views
- 2 Download
Abstract
- A metallic oxide layer of a heat-resistant element contributes to the high-temperature oxidation resistance by delaying the oxidation and has a positive effect on the increase in electrical resistivity. In this study, green compacts of Fecralloy powder mixed with amorphous and crystalline silica are oxidized at 950°C for up to 210 h in order to evaluate the effect of metal oxide on the oxidation and electrical resistivity. The weight change ratio increases as per a parabolic law, and the increase is larger than that observed for Fecralloy owing to the formation of Fe-Si, Fe-Cr composite oxide, and Al2O3 upon the addition of Si oxide. Si oxides promote the formation of Al2O3 and Cr oxide at the grain boundary, and obstruct neck formation and the growth of Fecralloy particles to ensure stable electrical resistivity.
- Fe-Cr계 합금에서 Cr 원소는 재료표면에 내산화성 Cr 산화물을 형성하기 때문에 Cr 함량이 많을수록 경도와 내 산화성이 우수하다는 것은 잘 알려져 있다[1]. 그러나 성 형성, 용접성 및 경제성 등의 실용적인 측면에서 17 wt.% Cr강이 가장 많이 사용되고 있다. Fe-Cr 합금은 오스테나 이트계 합금과 비교하여 취성이 크고 냉간가공이 어려운 재료이지만 고온에서 내산화성이 우수하고 전기저항밀도 가 높아서 고온 발열체로 주로 사용된다[2]. 기존 연구 결 과에서 보면 Fecralloy는 최고 사용온도가 1450°C로 매우 높으며, 고온에서 내산화성은 양호하지만 전기저항이 사 용시간이 길어짐에 따라 점차적으로 감소하면서 안정성을 잃어가는 결과를 보였다[15]. Fe-Cr-Al 합금은 Al2O3 형성 합금인 M-Cr-Al(M:Fe, Co, Ni)의 하나로 Al2O3 피막층을 형성하기 위하여 17% 이상의 높은 Al 함량을 필요로 하 는 Fe-Al계 합금에 비해 5% 정도의 낮은 Al 함량만으로 보호성 Al2O3 피막층을 형성하는데, 이러한 이유는 Cr이 합금 내에서 산소에 대한 제 2흡수제의 역할을 하여 내부 산화를 효과적으로 억제하고 표면쪽으로 확산한 Al이 산 소와 반응하여 Al2O3를 형성시키기 때문이다[3-6]. 이 합 금은 표면으로 Al의 공급속도가 빠르고 합금내에 비교적 낮은 산소 고용도와 확산계수에 기인하여 Al2O3 형성이 용이하다[7].
- 이와 같이 금속의 고온 내산화성을 향상 시키는 방법으 로는 Al 이나 Si 등의 금속원소를 합금원소로 첨가하는 방 법이 잘 알려져 있다. 이들 첨가원소는 산화 초기에 Al과 Si 산화물이 형성되어 모재 표면에서 Cr의 핵생성 site로 작용하면서 Cr 산화물의 성장을 촉진시키므로 표면 Cr2O3 층 형성에 필요한 Cr 임계농도를 줄이는 역할을 한다. 또 한 900°C 이상의 고온에서도 Cr2O3 산화층 아래의 계면에 안정한 산화물을 형성하면서 추가적인 내산화성을 제공하 기 때문에 Al 이나 Si를 첨가한 Fe-Cr 합금의 내산화성이 크게 향상되는 것으로 보고된 바 있다[8]. 또한 산화촉진 원소 및 희토류원소의 미량 첨가에 따라 Cr2O3 스케일이 나 Al2O3 스케일의 보호성이 향상되어 내산화 수명을 증 가시킨다는 보고도 있다[9, 10]. Al2O3는 고온에서의 안정 성이 뛰어난 보호 피막을 형성하지만, 산화피막 내부에서 새로운 Al2O3의 형성으로 인해 산화피막 형성이 소용돌이 (convolution) 모양을 나타내기 때문에 모재와의 접착력이 약하다는 단점이 있다. 이들 원소는 핵생성과 Cr 및 Al의 선택적 산화를 촉진시키고 연속적인 보호층을 발달시키며 산화물을 형성하는 양이온의 외부 확산을 억제하여 금속/ 산화피막 계면에서 피막을 성장시키고 공공의 형성을 감 소시켜 밀착성을 향상시키는데 효과가 있다[9, 10].
- 고온 발열체는 고온에서 내산화성이 우수하여야 하며, 고온에서 높은 전기저항이 요구되며, 또한 고온에서 장시 간 사용하여도 내산화성이나 전기저항이 감소되지 않는 안정성이 유지되어야 한다. 발열체는 일정한 온도에서 연 속적인 사용보다는 일정시간 동안의 사용 후에는 사용이 중단되므로 온도변화에 따른 모재와 산화피막간의 열팽창 계수 차이에 의한 열응력을 발생시킨다. 이러한 응력은 산 화피막의 균열, matrix 합금으로부터의 산화피막 박리 등 을 일으켜 파괴가 일어나면 matrix 합금에 함유되어 있던 보호막 형성원소가 표면으로 확산되어 보호막이 재생성 되어 재료를 보호할 수 있어야 한다. 그러나 분말야금제품 은 주조법으로 만들어진 소재보다 많은 기공 구조를 가지 며 이러한 넓은 기공면적이 galvanic couple을 형성하여 부식을 촉진시키는 원인이 된다[11, 12]. 또한 고온에서 기 공의 형상변화에 의해 산화저항 및 전기저항의 변화가 발 생하며, 다양한 산화물상이 생성될 뿐만 아니라 소재표면 과 개기공 표면에 생성되는 산화피막의 종류와 분포형태 등에 따라서 산화안정성 및 전기저항특성의 안정성이 크 게 달라진다. 따라서 분말야금법을 고온발열체 제조에 응 용할 경우 고려되어야 할 많은 문제점들을 가지고 있으나 아직까지 이에 대한 연구는 거의 수행된 바가 없는 실정 이다. 본 연구자들의 앞선 연구에서 Al2O3, SiO2, MgO 및 Y2O3를 STS 316L에 첨가하여 내산화 거동을 조사한 결과, Y2O3를 첨가한 경우가 가장 좋은 특성을 나타내었고, 나 머지 산화물들을 첨가한 경우는 비슷한 양상을 보였다 [16]. 그러나 실용적인 측면에서는 Al2O3 또는 SiO2와 같 은 비교적 저렴하고 산화 안정성이 큰 분말을 사용하는 것이 타당하다고 판단되었다.
- 따라서 본 연구에서는 Fecralloy에 비정질 실리카(a- SiO2) 및 결정질 실리카(c-SiO2)를 첨가하여 성형한 후 950°C의 대기 중에서 성형체의 고온 내산화성과 전기저항 의 안정성에 미치는 영향을 조사하였다.
서 론
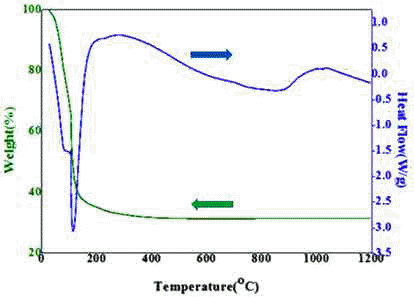
- 그림 1과 같이 본 연구에 사용된 Fecralloy 분말은 평균 입도가 30 μm 인 구형의 Sandvik Osprey Ltd 사(영국)의 제품이고, c-SiO2 분말은 평균입도가 10 μm 이고 순도가 99.9% 인 Junsei Chemical Co. LTD 사 (일본)의 제품을 사용하였다. a-SiO2를 얻기 위하여 규산나트륨(Sodium silicate)을 구입하여 curing 한 후 사용하였다. 표 1은 본 실험에서 사용한 규산나트륨 수용액의 성분표이다. 그림 2는 규산나트륨을 TGA로 온도에 따른 질량변화를 분석한 그래프로 200°C 까지 질량이 크게 감소하다가, 300°C 이 후부터는 거의 무게변화가 없었다. 따라서 수분을 완전히 제거하기 위해 350°C에서 3시간 동안 curing을 실시하였 다. Curing 이후 규산나트륨은 그림 1에서 보여주는 바와 같이 평균 입도가 30 μm인 판상형으로 고상의 a-SiO2 형 태로 존재하였다. 표 2는 Fecralloy의 조성을 나타낸다. Fecralloy 분말에 a-SiO2 1 wt.%를 첨가하고, c-SiO2를 2 wt.% 까지 추가로 첨가한 분말을 Spex Mill(Fritsch 사의 TH- 1080)을 이용하여 30분 동안 혼합하였다.
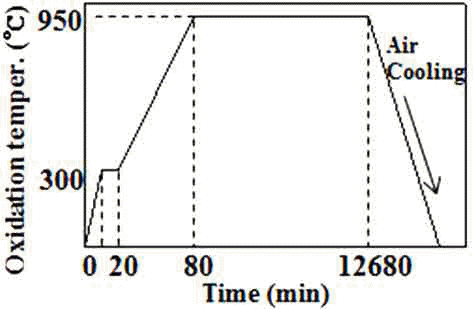
- 혼합한 분말은 유압식 성형프레스를 이용하여 성형하였 으며 성형체는 50 × 4 × 4 mm의 크기를 가지는 bar 형태로 제조하였다. 성형한 시편의 산화 시간에 따른 고온 산화 거동 및 전기적 특성을 알아보기 위해서 대기상태의 950°C에서 210시간 동안 산화시켜 산화시간에 따른 산화 거동을 조사하였다. 시간에 따른 산화실험공정을 그림 3 에 나타내었고 승온시간 30°C/min 으로 300°C까지 가열하 여 10분 예열을 한 다음, 승온 시간 15°C/min으로 목표 온 도까지 가열하였다. 일정시간 동안 산화시킨 시편은 각 시 간대별로 로에서 꺼내어 공냉한 후, 시편의 무게변화율을 측정하였다. 또한 고온 산화 시험 후 생성된 산화물들의 상변화를 X-선 회절기(X-ray diffraction meter)를 이용하 여 조사하였고, 성분분석을 위해 EDS(Energy Dispersive Spectroscopy)로 분석하였다. 또한 산화시간에 따른 전기 저항은 Hioki 3540 모델의 전기저항 측정장치를 이용하여 측정하였으며 표면 접촉저항을 최소화하기 위하여 표면 연삭 후 silver paste를 시편 양단에 바르고 측정하였다.
실험 방법
Composition of the used Sodium Silicate Solution.
| 물 불용 분 (%) | Na2O(%) | SiO2(%) | |
|---|---|---|---|
|
|
|||
| Sodium Sillcate Solution | 0.2 이하 | 6~7 | 23~25 |
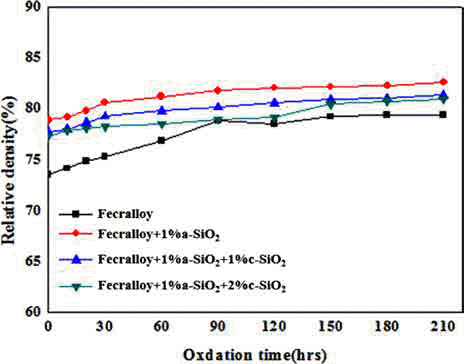
- 그림 4는 950°C에서 산화시간에 따른 밀도변화를 보여 주는 그래프로 Fecralloy에 a-SiO2 및 c-SiO2를 첨가하였을 경우 기존 Fecralloy의 성형체보다 더 높은 상대밀도를 나 타내었다. 이는 Fecralloy의 분말의 형상은 구형이기 때문에 성형성이 떨어지지만, a-SiO2을 첨가하게 되면 Fecralloy 입 자들 사이에 괴상 및 판상의 c-SiO2가 충진되어 오히려 밀 도가 증가한 것으로 사료된다.
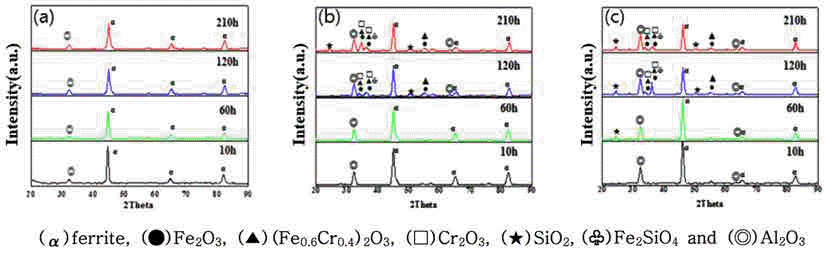
- 그림 5는 Fecralloy에 a-SiO2 및 c-SiO2를 혼합하여 제조 된 성형체를 950°C에서 210시간까지 산화시킨 시간에 따 른 산화물 증가량을 보여주는 그래프이다. 모든 시편에서 무게변화율이 20시간까지는 크게 증가하였는데, 이는 금 속입자 표면에 산화피막을 형성시켜 초기 산화에 의해 무 게가 증가되었기 때문이다[13]. 30시간 이후에는 무게증가 율 기울기가 감소하였는데, 이는 합금원소와 산소의 확산 에 의해서 형성된 산화피막이 보호막 역할을 하게 되고, 산 화층의 두께가 증가할수록 이온의 이동거리도 증가하여 포 물선 형태를 보이면서 증가한 것으로 생각된다. Fecralloy에 실리카가 첨가되면 대체로 산화에 의한 무게증가가 더 크 게 나타났다. Fecralloy에 a-SiO2만 첨가 되었을 경우, 순 수한 Fecralloy에 비해 무게변화율이 약 2% 정도 더 높았 으며, c-SiO2가 함께 첨가되었을 경우 c-SiO2 첨가량이 증 가하면 산화에 의한 무게변화율은 더 증가한다. 산화에 의 한 무게증가율은 성형체의 밀도에 의해서도 크게 좌우된 다. Fecralloy에 c-SiO2를 첨가하면 밀도가 더 높아졌음에 도 불구하고, 그림 5에서 보여주듯이 산화에 의한 무게변 화율이 증가했다. 이는 첨가된 산화물로 인해 모재 표면에 서 핵생성 site로 작용하면서 Cr 및 Al 산화물의 성장을 촉 진시켜 Fecralloy 입자 표면에 산화피막이 형성된 것으로 사료된다. 이를 확인하기 위하여 X-ray 회절패턴을 분석하 여 그림 6에 나타내었다.
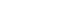
- 그림 6은 대기 중의 950°C에서 210시간 까지 산화시험 진행 후 a-SiO2 및 c-SiO2가 첨가된 Fecralloy 성형체의 외 부 산화층의 X선 회절 패턴이다.
- 그림 6(a) Fecralloy에서는 210시간 까지 Al2O3 peak를 제외하고 다른 산화물의 peak는 관찰되지 않았다. 하지만 a-SiO2 및 c-SiO2를 첨가하게 되면 전체적으로 산화시간에 따라 Fe, Cr 산화물의 생성량이 많아지게 되고 Al2O3 peak 의 강도가 강해지는 것을 관찰할 수 있다. 이는 a-SiO2 및 c-SiO2 첨가로 인해 Al 및 Cr 산화물의 핵생성 site로 작용 함으로써 산화물 형성이 촉진되어 Al2O3의 peak가 순수 Fecralloy보다 다소 높게 관찰되었고, Fe-Si 및 Fe-Cr 복합 산화물 등 안정적인 산화물이 형성되어 210시간 까지 α- Fe peak가 유지되었다고 판단되며, 또한 첨가된 c-SiO2가 산화물의 박리를 억제하고 안정한 Al2O3 산화물을 연속적 인 산화피막이 형성된 것으로 생각된다[7]. (b)와 (c)를 비 교해 보면 SiO2 peak이 관찰되는 시점이 다르다. (b)에서 는 120시간부터, (c)에서는 60시간부터 SiO2 peak이 처음 관찰된다. 이는 c-SiO2의 첨가량의 차이라고 판단된다.
- 그림 7은 대기 중 950°C에서 210시간 산화시험 후 Fecralloy에 a-SiO2 및 c-SiO2가 첨가된 성형체의 EDS 분석 결과이다. 그림 7(a)에서 보면, 산화시간 210시간 후에도 Fecralloy의 입계에 연속적인 Al 산화물 스케일이 형성된 것을 관찰할 수 있다. 이는 Al이 입계로 확산되어 Cr 산화 층을 형성하는 Cr의 임계농도를 줄여 Cr 이온의 결핍을 줄이고 선택적으로 Al 산화물을 형성하여 Fe 이온과 Cr 이온의 외부확산을 억제하여 Al 산화물 이외에 다른 산화 물의 형성을 방지한 것으로 생각된다[14]. 하지만 a-SiO2 및 c-SiO2를 첨가하였을 경우, Si 산화물은 입계에 존재하 였으며, 이것이 Cr 산화물의 핵생성 site로 작용하면서 Cr 산화물의 성장을 촉진시키므로 기지내의 Cr 이온 일부가 입계로 확산되어 Cr 산화물을 형성한 것으로 판단되며, Cr 이온이 입계에 집중되어 있지 않고 입내와 입계에 고 루 분포한 것으로 판단된다. 또한 c-SiO2가 첨가된 (b)와 (c)의 경우 (a)와는 달리 210시간 산화실험 후에도 구형의 모상 입자들의 neck 형성이 많이 일어나지 않은 것으로 보아서 c-SiO2가 입계에서 Fecralloy 입자간 neck 성장을 저해하는 요인으로 작용한 것으로 사료된다.
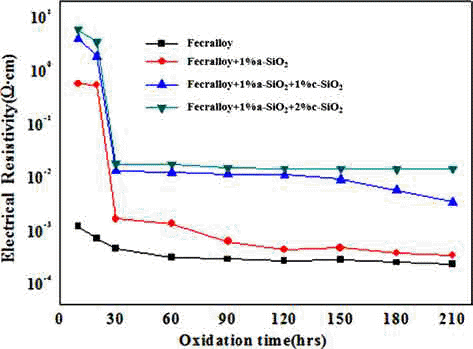
- 그림 8은 위의 시편을 950°C에서 각각의 산화시간별로 전기비저항을 측정한 그래프이다. 소결이 진행됨에 따라 입자간의 neck 형성으로 인해 전기저항의 감소가 일어나 므로 전기저항 안정성에 대한 검토를 하였다. 순수 Fecralloy 경우 초기산화 단계 이후 다소 저항이 감소하여 Fecralloy 비저항 고유 값인 10-4 Ω·cm로 비교적 안정된 값 을 유지하였다. Fecralloy에 a-SiO2 1 wt.%를 첨가하였을 때는 초기에는 높은 비저항 값을 나타내었지만 산화시간 30시간까지 전기저항 값이 10-3 Ω·cm 정도 값으로 지속적 으로 감소하였다. 하지만 1 wt.% c-SiO2를 첨가하면 산화 시간 30시간까지 전기저항이 10-2 Ω·cm 정도로 떨어지고 나서, 30시간 이후 120시간 까지 10-2 Ω·cm 정도로 유지가 되면서 210시간까지 서서히 감소하였다. c-SiO2 2 wt.%를 첨가하게 되면 산화시간 210시간 까지 10-2 Ω·cm로 일정 하게 유지되었다. 이는 Fecralloy 입자표면에 Al 산화스케 일이 균일하게 형성될 뿐만 아니라, c-SiO2가 입자간 neck 형성을 방해하게 되는데 그 양이 2%로 많아지면 210시간 까지 거의 일정한 전기비저항 값을 유지하는 것으로 판단 된다. a-SiO2 및 c-SiO2를 첨가하였을 경우는 산화 초기 30시간까지는 Fecralloy 입자 등의 소결에 의한 국부적인 neck 형성으로 밀도 증가에 따라 전기저항이 크게 감소하 는 것으로 생각되고, 30시간 이후 일정한 값을 유지하는 것은 첨가된 산화물이 산화물 형성을 촉진시켜서 연속적 인 Al 스케일과 Cr 및 Si 복합 산화물들의 형성으로 인해 고온 내산화성을 유지하면서 neck 형성 및 성장을 방해하 여 전기저항 안정성을 확보할 수 있었다고 판단된다.
실험결과 및 고찰
Weight change ratio of respective specimens after oxidation tests at 950°C for 210 hrs in air.

X-ray diffractograms corresponding to respective specimens after different periods of exposure at 950°C in air. (a) Fecralloy, (b) Fecralloy/1w/oa-SiO2/1w/oc-SiO2 and (c) Fecralloy/1w/oa-SiO2/2w/oc-SiO2.
EDS mapping results of respecive specimens after 210hr exposure at 950°C in air: (a) Fecralloy, (b) Fecralloy/1w/oa- SiO2/1w/oc-SiO2 and (c) Fecralloy/1w/oa-SiO2/2w/oc-SiO2.

- Fecralloy에 a-SiO2 및 c-SiO2를 첨가하여 950°C에서 210 시간까지 산화시험을 한 결과 다음과 같은 결론을 얻을 수 있었다.
- 산화물 첨가로 성형밀도는 Fecralloy보다 증가하였으나 산화에 의한 무게증가율도 증가하는 특성을 보였다. 이는 첨가된 산화물이 모재 표면에서 Cr 및 Al 산화물의 핵생 성을 촉진시켜서 입계에 산화층이 많이 생성되었기 때문 이었다. 또한 Si 산화물이 첨가될 경우, 산화 초기 30시간 이 지나면 균일한 Al 산화스케일이 형성되어 입자간의 neck 형성에 의한 소결을 방해하면서 안정적인 산화물의 성장을 촉진시켜 내산화성을 유지하면서 고온에서 전기저 항 안정성 또한 유지된 것으로 판단된다.
결 론
-
Acknowledgements
- 본 논문은 교육부와 한국연구재단의 지역혁신창의인력양 성사업(NRF-2015H1C1A1035901)의 지원으로 수행되었으 며 이에 감사드립니다.
감사의 글
- 1. A. Bautista, F. Velasco and J. Abenojar: Corros. Sci., (2002) 45 1343.Article
- 2. F.H. Stott, G.C. Wood and J. Stringer: Oxid. Met., (1995) 44 113.ArticlePDF
- 3. W. Howard and J. Pickering: J. Electrochem. Soc., (1972) 119 1309.
- 4. A. Rahmel and M. Schutz: Oxid. Met., (1992) 38 255.ArticlePDF
- 5. T. Takalo, N. Suutlal and T. Moisio: Metall. Trans., A, Phys. Metall. Mater. Sci., (1979) 10 1173.ArticlePDF
- 6. J.G. Smeggil, A.W. Funkenbusch and N.S. Bornstein: Metall. Trans., A, Phys. Metall. Mater. Sci., (1986) 17 923.ArticlePDF
- 7. S.J. Han, M. S. Thesis, Influence of Y element on the heat resistance of the Fe-Cr-Al alloy. (2015) Inha University.
- 8. J.H. Hong, M.S. Thesis, The High-Temperature Oxidation Behavior of Stainless Steel by Powder Metallurgy. (2015.
- 9. P.Y. Hou and J. Stringer: Oxid. Met., (1992) 29 323.
- 10. G. H. Meier, Introduction to High Temperature Oxidation of Metals, (1983).
- 11. A.V. Sobral, M.P. Hierro, F.J. Prez, W. Ristow Jr and C. V. Franco: Mater. Corros., (2000) 51 791.Article
- 12. I.S. Lee: Korean. J. Met. Mater., (2009) 47 716.
- 13. F. H. Stott and F. I. Wei: Oxide. Met., (1989) 31 369.
- 14. J. Stringer, B.A. Wilcox and R.I. Jaffee: Oxid. Met., (1972) 5 42.
- 15. J.W. Park, B.H. Ko, W.Y. Jung, D.K. Park and I.S. Ahn: J. Korean Powder Metall. Inst., (2016) 23 430.
- 16. J.P. Lee, J.H. Hong, D.K. Park and I.S. Ahn: J. Korean Powder Metall. Inst., (2016) 22 275.
Figure & Data
References
Citations





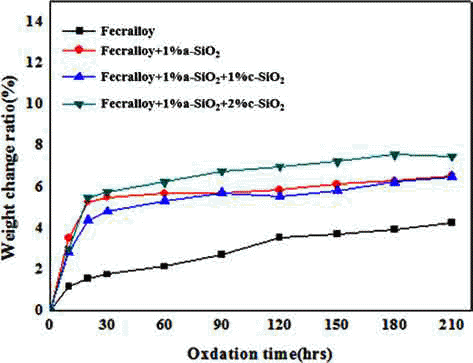


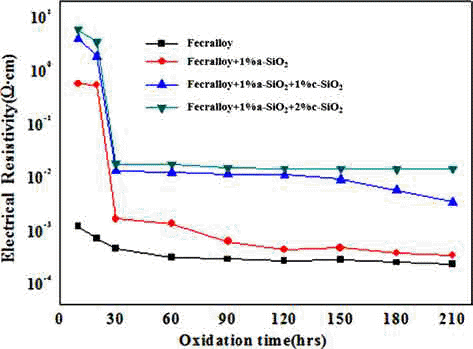
Fig. 1
Fig. 2
Fig. 3
Fig. 4
Fig. 5
Fig. 6
Fig. 7
Fig. 8
| 물 불용 분 (%) | Na2O(%) | SiO2(%) | |
|---|---|---|---|
|
|
|||
| Sodium Sillcate Solution | 0.2 이하 | 6~7 | 23~25 |
| C | Cr | Al | M0 | Si | Mn | Y | Fe | |
|---|---|---|---|---|---|---|---|---|
|
|
||||||||
| Fecralloy | 0.1 | 22.3 | 6.6 | - | - | 1 | 0.2 | Bal |
Table 1
Table 2
TOP
 KPMI
KPMI


 Cite this Article
Cite this Article