Articles
- Page Path
- HOME > J Korean Powder Metall Inst > Volume 24(4); 2017 > Article
-
ARTICLE
LTCC 전극공정부산물 침출 용액으로부터 은 회수 및 은 나노입자 제조 - 유주연, 강유빈, 박진주, 류호진a, 윤진호b, 이근재*
- Recovery and Synthesis of Silver Nanoparticles from Leaching Solution of LTCC Electrode By-Products
- Juyeon Yoo, Yubin Kang, Jinju Park, Hojin Ryua, Jin-Ho Yoonb, Kun-Jae Lee*
-
Journal of Korean Powder Metallurgy Institute 2017;24(4):315-320.
DOI: https://doi.org/10.4150/KPMI.2017.24.4.315
Published online: July 31, 2017
단국대학교 에너지공학과
㈜유천테크
b 고등기술연구원
Department of Energy Engineering, Dankook University, Cheonan 31116, Republic of Korea
a Yuchun Tech Co., Daejeon 34114, Republic of Korea
b Advanced Materials and Processing Center, Institute for Advanced Engineering, Yongin 17180, Republic of Korea
- *Corresponding Author: Kun-Jae Lee, +82-41-550-3684, +82-41-559-7945, kjlee@dankook.ac.kr
• Received: August 3, 2017 • Revised: August 18, 2017 • Accepted: August 21, 2017
© The Korean Powder Metallurgy Institute. All rights reserved.
- 368 Views
- 2 Download
Abstract
- There has been much interest in recycling electronic wastes in order to mitigate environmental problems and to recover the large amount of constituent metals. Silver recovery from electronic waste is extensively studied because of environmental and economic benefits and the use of silver in fabricating nanodevices. Hydrometallurgical processing is often used for silver recovery because it has the advantages of low cost and ease of control. Research on synthesis recovered silver into nanoparticles is needed for application to transistors and solar cells. In this study, silver is selectively recovered from the by-product of electrodes. Silver precursors are prepared using the dissolution characteristics of the leaching solution. In the liquid reduction process, silver nanoparticles are synthesized under various surfactant conditions and then analyzed. The purity of the recovered silver is 99.24%, and the average particle size of the silver nanoparticles is 68 nm.
- 최근 인구증가에 따른 자원의 고갈과 소재의 의존성이 증가함에 따라 폐기물의 회수 및 재자원화를 통해 자원의 이용가치를 극대화하기 위한 노력이 다양한 분야에서 이루 어지고 있다[1]. 특히 폐금속 자원으로부터 회수와 가공과 정을 거쳐 원료로 재사용함으로써 철, 비철금속, 귀금속, 희소금속 등 자원의 이용가치를 증가시킬 수 있다. 자원의 1차 생산에 비해 2차 생산 공정은 환경적 영향이 낮기 때문 에 이미 WEEE (waste electrical and electronic equipment) 지 침과 같은 환경 보호 및 법규에 의해 주도되고 있으며, 상 당한 경제적 이익을 얻을 수 있기 때문에 공정의 극대화 가 이루어지고 있다[2, 3]. 그러나 기존의 1차 생산에 의해 사용된 폐금속 자원에는 이용가치가 있는 금속의 함량이 적기 때문에[4] 금속 회수에 대한 효율적인 비용 및 기술 의 개선이 필요하다. 특히 세계적으로 EEE (electrical and electronic equipment)의 성장으로 인해 그 수요가 증가하 면서 E-waste에 함유된 금속을 회수하기 위한 개발이 이 루어지고 있지만, E-waste에는 금속뿐만 아니라 중금속과 같은 위험물질도 함유되어 있으므로[5] E-waste에서 금속 을 선택적으로 회수해야 한다.
- E-waste에서의 금속 회수 및 추출은 습식제련공정 또는 건식제련공정을 통해 수행할 수 있다[6]. 건식제련공정은 전자 스크랩을 분쇄시킨 후 고온에서 금속을 회수하는 공 정으로 벨트 샌딩, 그라인딩 등의 방법이 있지만 공정이 복 잡하고 미량 금속의 고순도 회수가 어려운 단점이 있다[7]. 습식제련공정은 전자 스크랩을 산 또는 염기로 침출하여 금속을 회수하는 공정이다[8]. 불순물의 침전, 용매 추출, 흡착 및 이온 교환과 같은 분리 및 정제과정을 거쳐 고순 도의 금속을 회수하며[9], 건식제련공정에 비해 정확하고 쉽게 제어가 가능하다.
- 은은 전기, 전자, 화학 및 의학 산업에서 적용 가능한 분 야가 광범위한 금속이다[10]. 비교적 고가의 금속이며 제 한된 양으로 존재하기 때문에 E-waste에 함유된 은을 선 택적으로 회수하려는 효율적인 방법에 대한 연구가 주목 받고 있다[11]. 또한 은이 나노크기의 입자로 합성되면 광 학적, 기계적[12], 전자기적, 열적 특성[13, 14] 및 항균특 성[15]이 향상되며 나노 분말, 와이어, 페이스트 등의 소재 로 가공되어 발광소자, 항균제품, 태양전지 등에 적용이 가능하다. 하지만 회수한 은을 고순도화하여 나노입자로 제조하는 국내 기술은 현재 많은 성장을 이루지 못하였다. 따라서 E-waste로부터 회수 과정을 거쳐 나노소자로의 적 용이 가능한 은 나노입자를 합성하는 연구가 필요하다.
- 은 나노입자를 합성하는 방법으로는 화학적 환원 공정, 폴리올 공정, 방사선 분해 공정, 전기화학적 공정 등을 예 로 들 수 있으며, 액상 환원 공정을 이용한 화학적 환원법 이 가장 흔히 사용된다[16, 17]. 최근에는 균일한 입도 분 포 및 형상을 제어하고 높은 수율을 가지는 은 나노입자 를 합성하기 위해 액상환원 공정을 다양하게 변형시켜 응 용하고 있다. 또한 환원제에 의해 Ag+ 이온 상태에서 Ag0 금속으로 환원되기 위해서는 용매상에서 Ag+ 이온 상태로 존재해야 하므로 대표적으로 수계 용매가 사용되지만, 온 도에 따라 환원특성을 가지는 용매가 있으며 각각의 은 전구체의 용매에 대한 용해특성이 다르다. 따라서 조건에 맞는 용매 선택이 필요하며, 계면활성제의 제어를 통해서 도 은 나노입자의 합성에 미치는 영향이 다르므로 적절한 조건 제어가 필요하게 된다.
- 본 연구에서는 다양한 금속 및 불순물이 함유되어 있는 습식제련공정으로 제조된 전극공정부산물의 침출 용액을 이용하여 은 전구체를 선택적으로 회수하였다. 회수된 은 전구체를 화학적 환원을 통해 균일한 입도와 형상을 가지 는 은 나노입자로 합성하였으며, 은 입자의 입도를 비교하 기 위해 은 전구체와 계면활성제의 몰농도 비율 조건에 따른 실험을 진행하였다.
서 론
- 2.1. 전극공정부산물 침출액을 이용한 AgCl 전구체 제조
- 본 연구에서는 LTCC (low temperature co-fired ceramics) 전극공정부산물((주)유천테크)을 이용하여 LTCC를 75°C 에서 5 M의 HNO3로 반응시킨 침출액을 사용하였다. 은 전 구체 합성을 위한 환원제로는 Hydrochloric acid (35.0~ 37.0%, DAEJUNG)을 사용하였다. 침출액 30ml에 HCl 1M 을 주입한 후 용액을 실온에서 30 min 동안 반응시켰으며, 반응시간 동안 계속 교반하였다. 최종적으로 생성된 AgCl 을 NO3- 및 다른 불순물들로부터 분리하기 위해 원심분리 기를 이용하였고, 증류수와 에탄올로 워싱 후 건조시켜 분 말을 회수하였다.
- 2.2. 액상환원 공정을 이용한 은 나노입자 합성
- 위 실험에서 제조한 AgCl 입자를 사용하여 은 나노입자 합성 실험을 진행하였다. 용매는 Ammonium hydroxide (25.0~28.0%, DAEJUNG)을 사용하였으며, 환원제로는 Hydrazine hydrate, 100% (hydrazine 64%, ACROS)을 사용하 였다. 계면활성제로는 Polyvinyl pyrrolidone (Mw = 29000 g/ mol, ALDRICH)을 사용하여 실험을 진행하였다. Ammonia water 25 ml에 AgCl 0.01 M을 녹인 후, PVP 0.14 M을 주 입하였다. PVP 주입 20 min 후에 Hydrazine 0.1 M을 주 입하였다. 최종적으로 제조된 용액은 실온에서 교반을 통 해 60 min 동안 반응시켰다. 계면활성제가 은 나노입자 합성에 미치는 영향을 알아보기 위하여 전구체와의 몰농 도 비율을 제어하였다.
- 2.3. 특성평가
- 전극공정부산물 침출액의 은 및 불순물 함량을 확인하 기 위해 Agilent사의 4200 MP-AES 모델의 마이크로웨이 브 플라즈마-원자 방출 분광기(Microwave plasma-atomic emission spectrometer, MP-AES)를 이용하였다. 제조된 은 전구체와 은 나노입자는 Rigaku사의 ZSX Primus모델의 X선 형광 분광기(X-ray fluorescence spectroscopy, XRF)을 이용한 정성분석을 통해 불순물의 제어를 확인하였으며, 결정구조 분석을 위해 Rikaku사의 Ultima Ⅳ모델의 X선 회절 분광기(X-ray diffractometer, XRD)을 이용하였다. 은 나노입자의 형상 및 입도 분석은 ZEISS사의 Gemini 500 모델의 주사전자현미경(Field emission scanning electron microscope, FE-SEM)을 이용하여 분석하였다.
실험 방법
- 3.1. 습식환원공정으로 제조한 전극공정부산물 침출액을 이용한 은 전구체 합성
- 습식환원공정으로 제조된 전극공정부산물 침출액을 이 용하여 은 전구체를 합성하는 실험을 진행하였다. 전극공 정부산물의 침출에는 은을 산화하여 용해시키기 위해서 산화력이 강한 질산을 이용하였다. 질산 외에도 염산, 황 산 등의 산을 이용하여 침출이 가능하지만, 질산을 사용하 여 침출할 경우 다른 산을 사용하는 경우보다 은의 침출 량이 우수하므로 질산을 침출 용매로 사용하여 침출액을 제조하였다. 표 1은 은 전구체 합성에 사용된 침출액의 MP-AES 분석 결과이다. 침출액 속에 포함된 금속 원소 중에서 Ag의 함량은 2162.9 ppm (0.02M)으로 미량으로 존재하고 있었다. 이 침출액에서 선택적으로 Ag 전구체를 제조하기 위하여 AgCl의 용해 특성을 이용하였다. 용액이 질산에 의해 침출되었기 때문에 Ag 이온 및 다른 이온들 은 NO3 이온과 리간드를 형성하여 존재하고 있지만, AgNO3는 용해도가 높기 때문에 용액 내에서 이온상태로 존재하게 된다. 그에 반해 AgCl은 격자 구조에서 두 이온 이 강하게 결합하고 있어 큰 격자에너지를 가지고 있으므 로 낮은 용해도를 갖는다. 용해도는 염 결정의 격자에너지 와 더불어 수화에너지에 의해 영향을 받는다. 격자에너지 가 낮고 수화에너지가 높을수록 용해도가 높으며, 이는 결 정 구조에서 양이온과 음이온의 반경 차이에 의해 좌우된 다. AgCl의 경우 Ag+ 이온의 이온반경은 129 picometer (pm)이며, Cl-의 이온반경은 167 pm이다. AgNO3의 경우 NO3-의 이온 반경이 179 pm 이기 때문에 AgNO3의 반경 차이가 AgCl의 반경차이보다 크며, 이를 통해서 AgCl가 AgNO3 보다 큰 격자에너지를 갖고 있음을 알 수 있다.
- 침출액 내에 존재하는 다른 금속도 HCl과 반응하기 때 문에 금속 염 상태로 존재할 수 있지만, 이 경우에도 AgCl 은 다른 금속 염에 비해 상대적으로 낮은 용해도를 가지 고 있다. 침출액 내에 존재하는 이온이 Cl-와 염을 형성하 였을 경우의 용해도는 AgCl 1.93 mg/l, ZnCl2 432 g/l, SrCl2 800 g/l, CaCl2 600 g/l, FeCl3 920 g/l, AlCl3 1111 g/l 이다[18, 19]. 따라서 AgCl을 제외한 다른 금속 염은 침출 액에 용해되어 있으므로 침전반응이 일어나지 않는다. 이 러한 용해 특성을 이용하여 침출액 내에 HCl을 주입함으 로써 AgCl의 침전 반응을 유도하였으며, 합성 반응은 다 음과 같다.
- 이러한 반응은 표준자유에너지(ΔG)에 의해서 자발적으 로 일어남을 확인할 수 있다. 표준자유에너지가 음(-)의 값 을 갖는 경우에는 반응이 자발적으로 일어나게 된다. 반응 시의 반응물 및 생성물의 농도나 압력이 다른 경우 평형 상수(K)에 의해 표준자유에너지가 변하게 되며 평형 및 자발적/비자발적 반응으로 구분할 수 있다.
- 농도가 다를 경우 평형상수는 반응물의 몰농도 곱/생성물 의 몰농도 곱으로 얻을 수 있으며 이때 평형상수(K) > 1이 얻 어지면 ΔG<0 이므로 표준상태에서 자발적 반응이 일어나게 된다. 본 연구에서 진행한 실험의 경우 K = 450.28 × 10-2 이므 로 K>1, 즉 ΔG<0 이기 때문에 AgCl의 생성이 자발적으로 일어났음을 알 수 있었다.
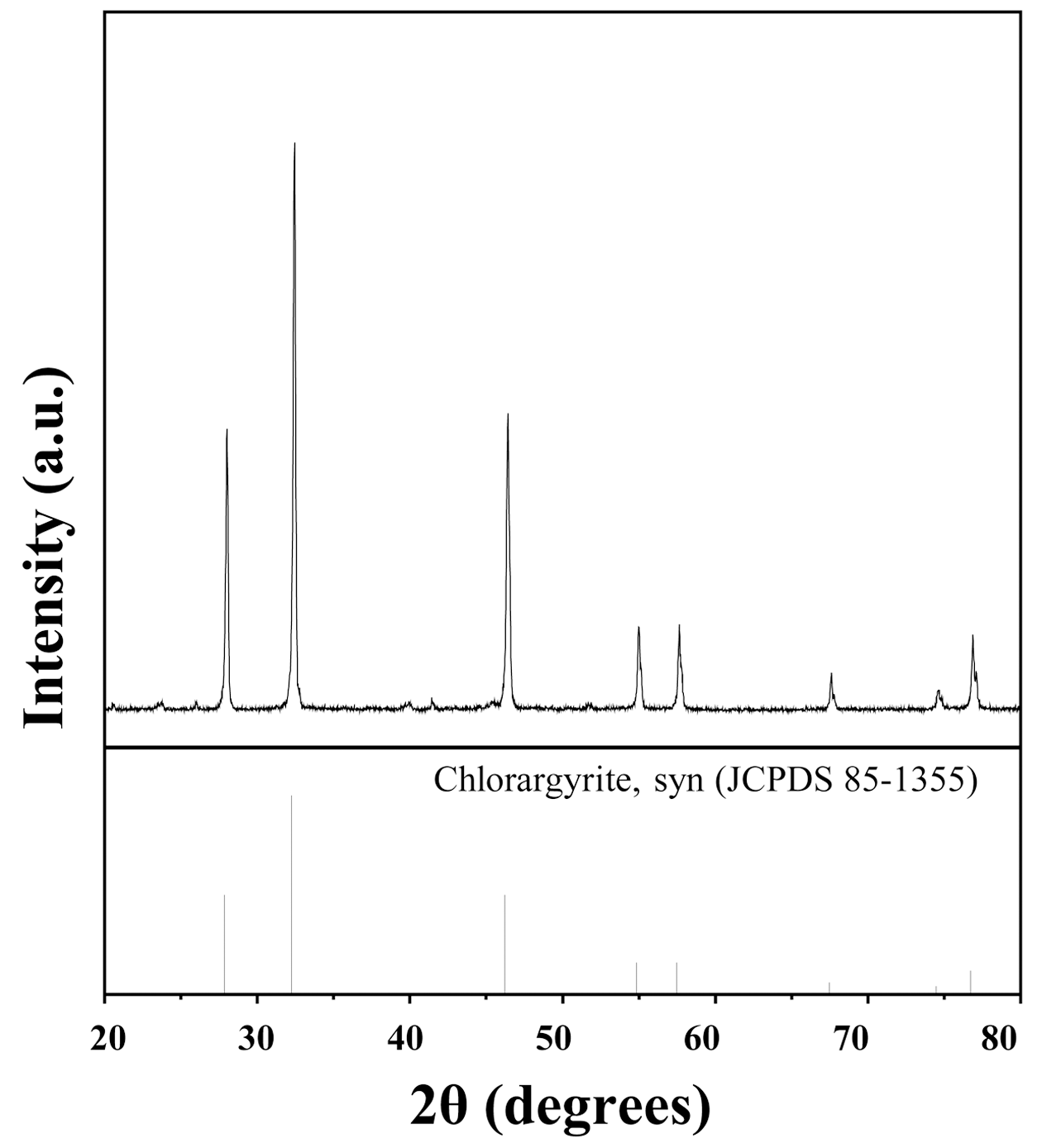
- 그림 1은 침출액으로부터 HCl을 이용하여 AgCl의 침전 반응을 유도하여 제조된 입자의 XRD 결과를 나타낸다. AgCl 입자는 (111), (200), (220), (311), (222), (400), (331), (420) 상을 가지고 있으므로 XRD 분석을 통해 AgCl 입자 가 생성되었음을 확인하였다. 이는 앞서 언급하였듯이 침 출액 내에서 생성된 AgCl의 침전을 통해 선택적인 회수가 가능하였음을 의미한다. 생성된 AgCl 입자의 불순물 제어 를 확인하기 위한 정성 및 정량 분석은 XRF를 이용하여 분석하였다. 표 2는 생성된 입자의 XRF 분석 결과이다. Ag와 Cl의 비율이 다른 원자의 함량에 비해 높은 비율을 차지하고 있었으며, 이는 AgCl의 생성으로 인해 불순물의 농도가 적은 은 전구체로 존재하고 있는 것을 확인할 수 있었다. 따라서 불순물 농도를 제어한 은 전구체 AgCl을 합성시키는 실험을 진행함으로써 순도 높은 은 나노입자 제조가 가능할 것으로 판단하였다.
- 3.2. 액상환원 공정을 이용한 은 나노입자 합성
- 침출액에서 제조한 AgCl을 전구체로 하여 고순도의 은 나노입자를 합성하는 실험을 진행하였다. AgCl이 수계 용 매에서는 용해되지 않으므로 암모니아수를 은 전구체를 용해시키는 용매로 이용하였다. 암모니아 용액 내에서 암 모니아는 Ag+ 이온을 보호하기 위해 NH3 분자가 보호 장 벽을 형성하여 [Ag(NH3)2]+의 안정한 리간드를 만들어 존 재하게 된다[20].
- 따라서 암모니아수에서 AgCl의 용해가 잘 일어나게 되 며, 이 특성을 이용하여 실험을 진행하였다. Hydrazine을 사용하여 환원을 진행시키는 과정에서 은 이온이 입자로 환원되면서 응집과 성장이 일어날 가능성이 있으므로 계 면활성제를 사용하여 입도와 형상을 제어하였으며, 나노 크기의 입자로의 제조가 가능하였다. 그림 2는 제조한 은 입자의 XRD 분석 결과이다. XRD 분석을 통해 제조한 은 전구체에서 은 입자가 합성되었음을 확인할 수 있었다. XRD 분석을 통해 확인되지 않는 미량의 불순물들이 존재 할 수 있으므로, 고순도의 은 합성이 가능하였는지 확인하 기 위해 XRF 분석을 이용하여 입자 내에 존재하는 은의 함량을 정량적으로 분석하였다. 표 3은 제조한 은 입자의 XRF 분석 결과이며, 그림 3은 XRF 분석 결과를 비교한 그래프이다. 은 입자는 AgCl과 PVP의 몰비율 조건에 따 라 각각 제조하여 분석한 후 결과 1과 결과 2로 나타내었 으며, 결과 1은 1:1의 몰비율을, 결과 2는 1:14의 몰비율을 조건으로 하여 제조한 은 입자이다. 표 3에서 나타난 바와 같이 제조한 입자에서 은의 함량은 99.24% 이었으며, 다른 불순물들의 제거 또한 가능하였음을 확인할 수 있었다. 또 한 침출 용액으로부터 제조한 은 전구체와 이를 이용하여 제조한 은 입자의 XRF 분석 결과를 비교함으로써 은의 함량이 증가하고 불순물의 함량이 감소하고 있는 것을 확 인하였다.
- 계면활성제와 은 전구체의 몰농도 비율에 따라서 은 입 자의 입도 제어가 가능하다는 것은 SEM 분석 사진을 통 해 확인할 수 있는데, 그림 4는 각각 AgCl과 PVP의 몰 비 율을 1:1, 1:14로 반응시킨 후 얻은 샘플의 FE-SEM 분석 사진이다. 1:1 비율로 합성한 입자의 평균 크기는 약 5.51 μm 이며, 1:14 비율로 합성한 입자의 평균 크기는 약 68 nm이다. 이때 1:1 비율로 합성한 은 입자는 입자의 응 집이 크게 발생하였으며, 응집된 여러 입자들이 하나의 입 자처럼 큰 입자를 형성하여 성장하고 있는 형태를 확인할 수 있었다. 하지만 PVP의 비율을 1:14로 높게 하여 합성 한 은 입자는 나노크기의 입자로 고른 입도 분포를 가지 고 있었다. 이는 PVP의 카르보닐 그룹 내에 존재하는 산 소 원자가 은 입자의 표면과 결합하여 안정한 형태를 유 지시키기 때문에 입자의 응집과 성장이 발생하지 않았으 며, 고른 입도의 은 나노입자의 합성이 가능하였음을 알 수 있다.
실험결과 및 토론
Table 1
MP-AES analysis of by-products leaching solution
| Ion | ppm |
|---|---|
|
|
|
| Ag | 2162.9 |
| Zn | 1788.6 |
| Sr | 5846.9 |
| Ca | 8798.5 |
| Fe | 85.34 |
| Al | 2645.1 |
Table 2
XRF analysis of silver chloride particles recovered by HCl
| Analyte | Result |
|---|---|
|
|
|
| Ag | 77.7455% |
| Cl | 18.0281% |
| Si | 2.0171% |
| Ca | 0.9105% |
| Fe | 0.6292% |
| Cr | 0.2644% |
| Sr | 0.2153% |
| Zr | 0.1898% |
Fig. 2

XRD diffraction patterns of silver nanoparticles prepared by using silver chloride as a precursor.

Table 3
XRF analysis of silver nanoparticles prepared by using silver chloride as a precursor
| Analyte | Result 1 | Result 2 |
|---|---|---|
|
|
||
| Ag | 98.4072% | 99.2495% |
| Cl | 0.6072% | - |
| Si | 0.5929% | 0.5183% |
| Fe | 0.2484% | - |
| Zr | 0.1443% | 0.2322% |
Fig. 3
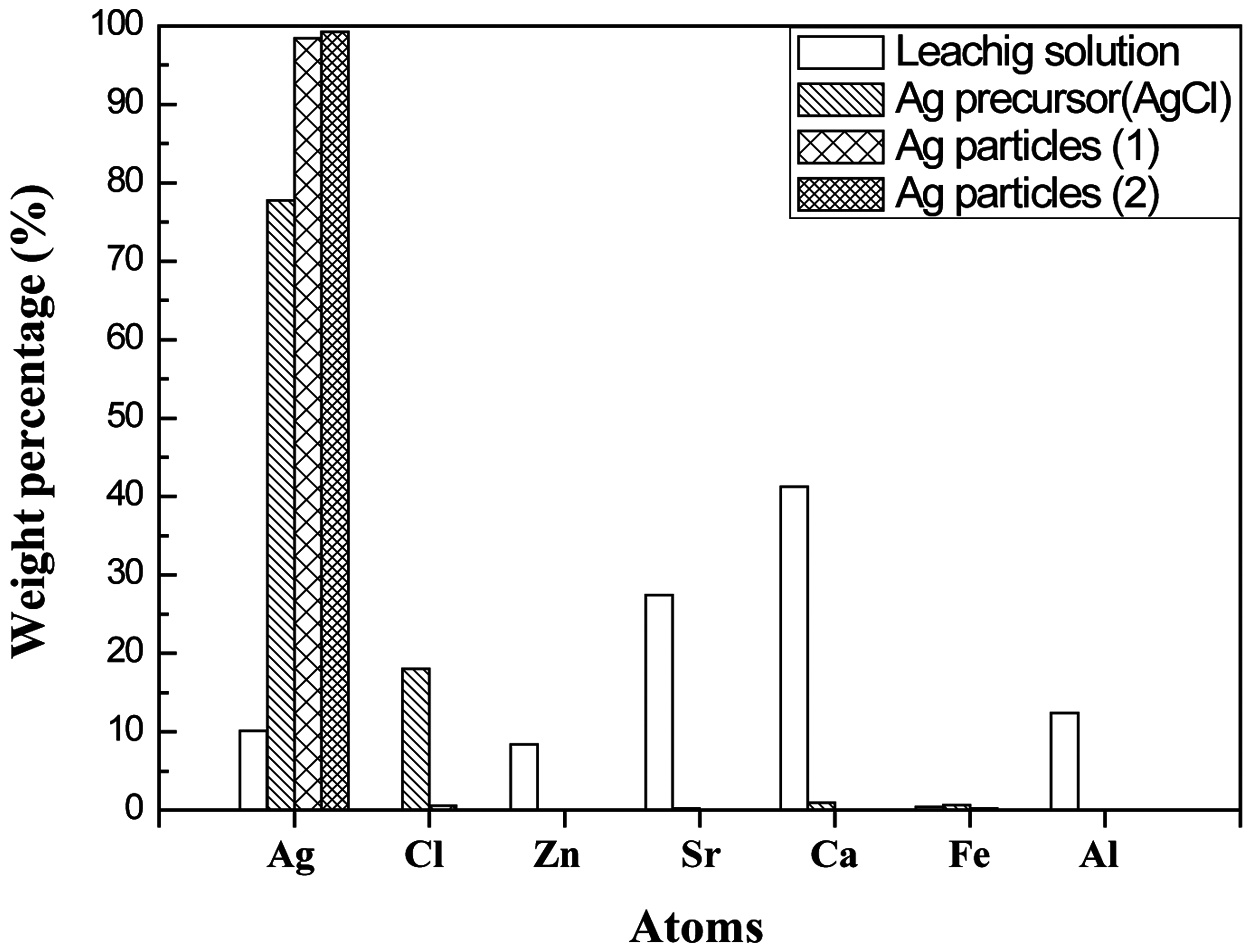
Comparative graph of control of impurities in leaching solution, precursor particles and silver particles prepared by the recovery process.

- 본 연구에서는 물질의 용해 특성을 이용하여 전극공정 부산물에서 선택적으로 은 전구체를 회수하는 실험을 진 행하였다. 또한, 회수한 은 전구체를 액상환원공정을 이용 하여 은 나노입자를 제조하는 실험을 진행하였다. 은 전구 체를 회수하는 공정에서는 AgCl이 다른 금속 염에 비해 낮은 용해도를 가지고 있으므로 선택적으로 AgCl을 침전 시키는 방법을 통해 불순물의 제어가 가능하였다. 회수한 AgCl을 은 전구체로 하여 환원시키는 방법으로 은 나노입 자를 합성하는 공정에서는 계면활성제인 PVP의 비율이 높을수록 은 입자의 크기 제어가 가능하다는 사실을 확인 하였다. 각 실험에서의 XRF 분석 결과를 비교하였을 때, 공정이 진행될수록 은의 함량이 높아지고 불순물의 함량 이 줄어들었다. 이는 최종적으로 제조한 입자가 높은 순도 를 가지는 은 입자임을 확인할 수 있었다. 침출 용액에서 AgNO3를 전구체로 회수하여 은 나노입자를 제조하는 방 법은 AgNO3가 높은 용해 특성을 가지고 있으므로 용매의 제한이 없다는 공정상의 장점을 가지고 있지만, 침출 용액 에서 전구체로 제조하는 공정에서 쉽게 리간드를 형성하 고 있으므로 전구체로의 회수가 어려운 단점을 가지고 있 다. AgNO3에 비해 AgCl을 전구체로 하여 은 나노입자를 제조하는 방법 또한 용해 특성에 영향을 가지고 있기 때 문에 용매의 제한이 있다는 단점을 가지고 있다. 하지만 이러한 낮은 용해 특성으로 인해 선택적으로 회수가 가능 하기 때문에 은 나노입자 합성을 위한 전구체를 회수하기 위한 방법으로 적합하다고 판단되었다. 따라서 본 연구에 서는 효율적인 공정 설계를 통해 폐금속 자원으로부터 선 택적으로 은의 회수가 가능하였으며, 제조한 은 나노입자 는 다양한 적용분야에서 재자원화가 가능할 것으로 예상 된다.
결 론
-
Acknowledgements
- 본 연구는 2015년도 산업통상자원부의 재원으로 한국에 너지기술평가원(KETEP)의 지원을 받아 수행한 연구과제 (No. 20155020101140)이며, 이에 감사드립니다.
감사의 글
- 1. E. A. Abdel-Aal and F. E. Farghaly: Farghaly: Powder Technol., (2007) 178 51–55.Article
- 2. S. Syed: Waste Manag., (2016) 50 234.Article
- 3. P. Isosaari and M. Sillanpaa: Separ. Purif. Rev., (2017) 46 1.Article
- 4. J.M. Navazo, G.V. Mendez and L.T. Peiro: Int. J. Life Cycle Assess., (2014) 19 567.ArticlePDF
- 5. R. Montero, A. Guevara and E. dela Torre: J. Earth Sci. Eng., (2012) 2 590.
- 6. E. David and J. Kopac: Proceedings., (2015) 2 5071.Article
- 7. E.M. Iannicelli-Zubiani, M.I. Giani, F. Recanati, G. Dotelli, S. Puricelli and C. Cristiani: J. Clean. Prod., (2017) 140 1204.Article
- 8. I. Birloaga and F. Veglio: J. Environ. Chem. Eng., (2016) 4 20.Article
- 9. M. Ghodrat, M.A. Rhamdhani, G. Brooks, S. Masood and G. Corder: J. Clean. Prod., (2016) 126 178.Article
- 10. A. Modi, K. Shukla, J. Pandya and K. Parmar: Int. J. Emerg. Technol. Adv. Eng., (2012) 2 599.
- 11. R. Dimeska, P.S. Murray, S.F. Ralph and G.G. Wallace: Polymer (Guildf.)., (2006) 47 4520.Article
- 12. H.S. Shin, H.J. Yang, S.B. Kim and M.S. Lee: J. Colloid Interface Sci., (2004) 274 89.Article
- 13. P. Kumar, M. Govindaraju, S. Senthamilselvi and K. Premkumar: Colloids Surf. B Biointerfaces., (2013) 103 658.Article
- 14. M. Ramos, E. Fortunati, M. Peltzer, F. Dominici, A. Jimenez and M. del Carrmen Garrigos: Polym. Degrad. Stabil., (2014) 108 158.Article
- 15. S. Ahmed, M. Ahmad, B.L. Swami and S. Ikram: J. Adv. Res., (2016) 7 17.Article
- 16. P.K. Sahoo, S.K. Kamal, T.J. Kumar, B. Sreedhar, A.K. Singh and S.K. Srivastava: Def. Sci. J., (2009) 59 447.Article
- 17. J. Yoo, H. Jang and K.J. Lee: J. Korean Powder Metall. Inst., (2016) 23 1.
- 18. P. Patnaik, Handbook of Inorganic Chemicals, (2002) USA McGraw-Hill.
- 19. M.J. O’Neil, A. Smith, P.E. Heckelman and S. Budavary, The Meric index: an encyclopedia of chemicals, drugs, and biologicals, MERCK&CO, (2001) USA INC.
- 20. A. Ajaypraveenkumar, J. Henry, K. Mohanraj, G. Sivakumar and S. Umamaheswari: J. Mater. Sci. Technol., (2015) 31 1125.Article
Figure & Data
References
Citations
Citations to this article as recorded by 

Recovery and Synthesis of Silver Nanoparticles from Leaching Solution of LTCC Electrode By-Products
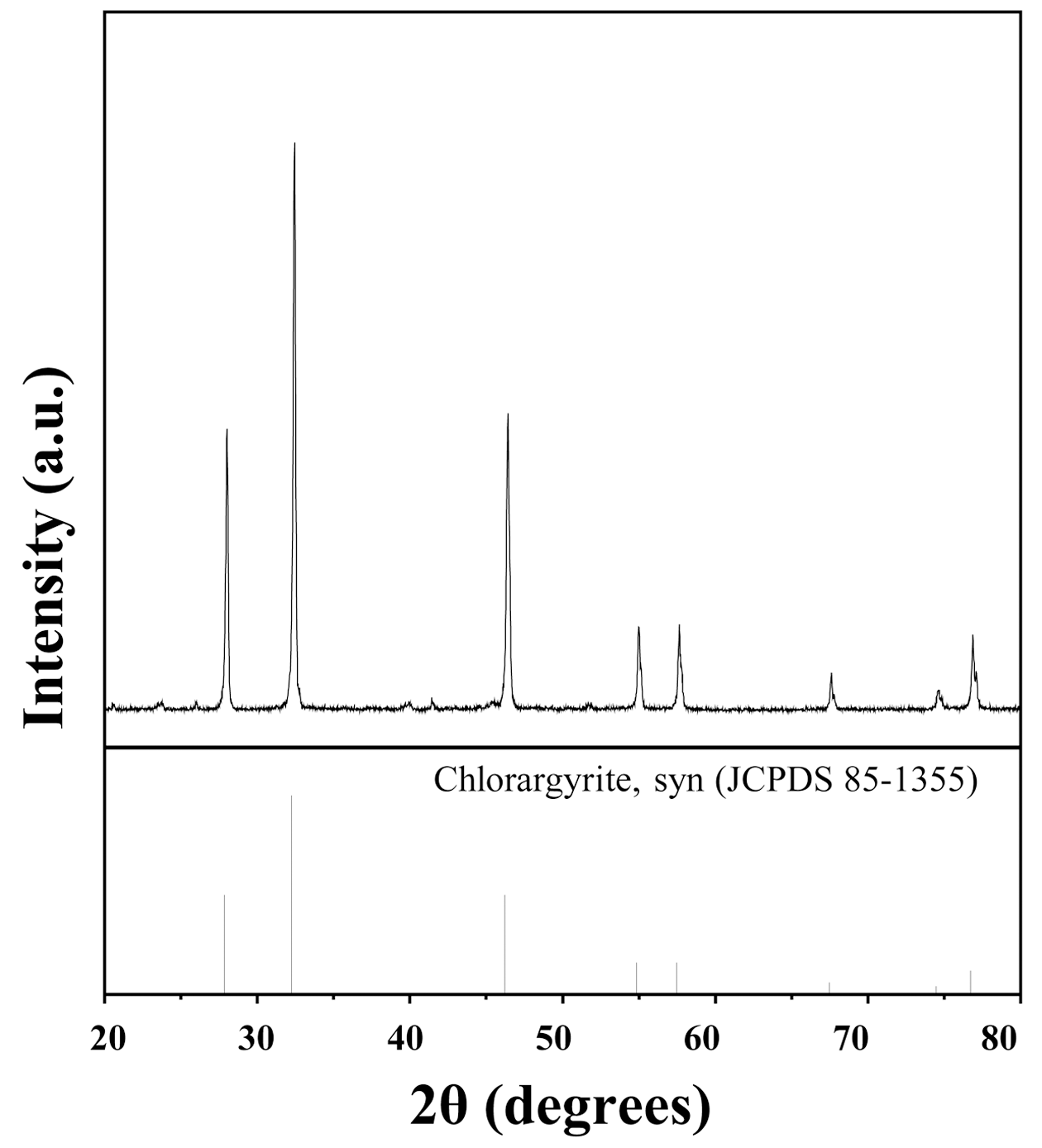
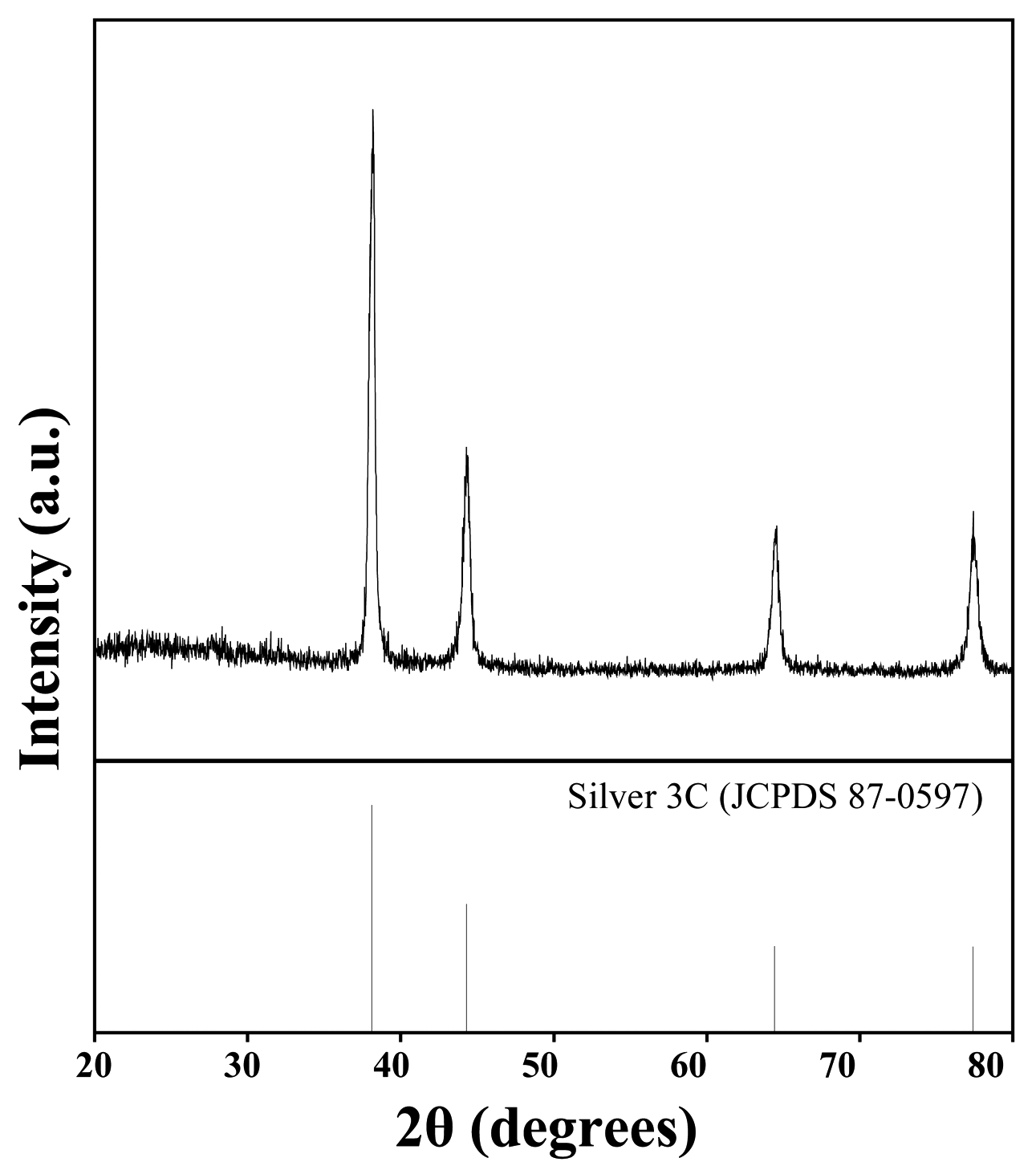
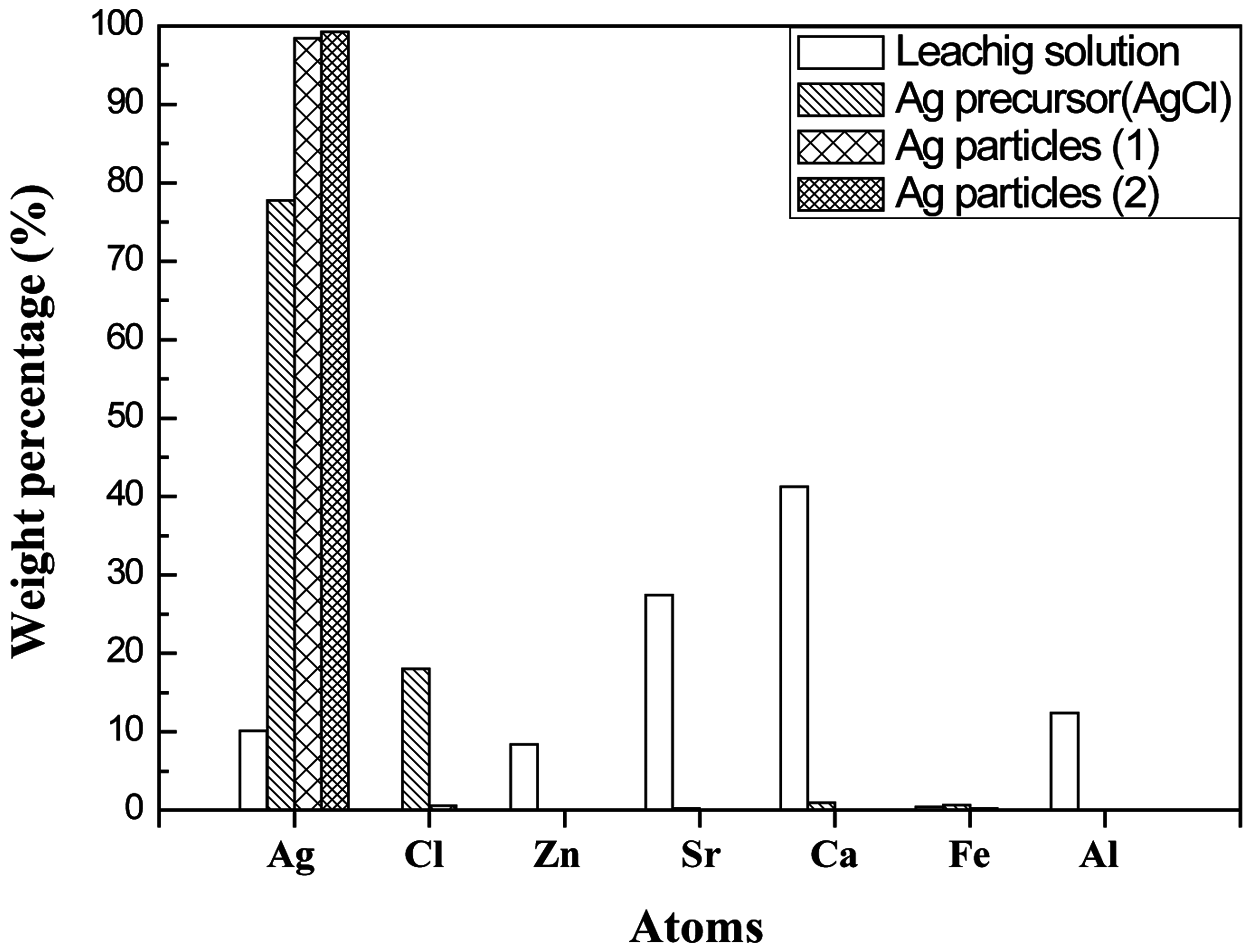

Fig. 1
XRD diffraction patterns of silver chloride recovered by HCl.
Fig. 2
XRD diffraction patterns of silver nanoparticles prepared by using silver chloride as a precursor.
Fig. 3
Comparative graph of control of impurities in leaching solution, precursor particles and silver particles prepared by the recovery process.
Fig. 4
FE-SEM images of silver nanoparticles at different silver chloride to PVP of (a) 1:1 and (b) 1:14.
Fig. 1
Fig. 2
Fig. 3
Fig. 4
Recovery and Synthesis of Silver Nanoparticles from Leaching Solution of LTCC Electrode By-Products
| Ion | ppm |
|---|---|
|
|
|
| Ag | 2162.9 |
| Zn | 1788.6 |
| Sr | 5846.9 |
| Ca | 8798.5 |
| Fe | 85.34 |
| Al | 2645.1 |
| Analyte | Result |
|---|---|
|
|
|
| Ag | 77.7455% |
| Cl | 18.0281% |
| Si | 2.0171% |
| Ca | 0.9105% |
| Fe | 0.6292% |
| Cr | 0.2644% |
| Sr | 0.2153% |
| Zr | 0.1898% |
| Analyte | Result 1 | Result 2 |
|---|---|---|
|
|
||
| Ag | 98.4072% | 99.2495% |
| Cl | 0.6072% | - |
| Si | 0.5929% | 0.5183% |
| Fe | 0.2484% | - |
| Zr | 0.1443% | 0.2322% |
Table 1
MP-AES analysis of by-products leaching solution
Table 2
XRF analysis of silver chloride particles recovered by HCl
Table 3
XRF analysis of silver nanoparticles prepared by using silver chloride as a precursor
Table 1
Table 2
Table 3
TOP
 kpmi
kpmi


 Cite this Article
Cite this Article




