Articles
- Page Path
- HOME > J Korean Powder Metall Inst > Volume 24(6); 2017 > Article
-
ARTICLE
수열합성법으로 제조된 나노막대 구조 WO3의 광촉매 효과 및 염료 흡착 반응 - 유수열a, 남충희a,b,*
- Photocatalytic and Adsorption Properties of WO3 Nanorods Prepared by Hydrothermal Synthesis
- Su-Yeol Yua, Chunghee Nama,b,*
-
Journal of Korean Powder Metallurgy Institute 2017;24(6):483-488.
DOI: https://doi.org/10.4150/KPMI.2017.24.6.483
Published online: November 30, 2017
a 한남대학교 광·전자물리학과
b 한남대학교 광·센서공학과
a Department of Applied Physics, Hannam University, Daejeon 34430, Republic of Korea
b Department of Photonics and Sensors, Hannam University, Daejeon 34430, Republic of Korea
- *Corresponding Author: Chunhgee Nam, +82-42-629-7472, +82-42-629-8313, chnam@hnu.ac.kr
• Received: December 7, 2017 • Revised: December 24, 2017 • Accepted: December 26, 2017
© The Korean Powder Metallurgy Institute. All rights reserved.
- 1,109 Views
- 4 Download
- 2 Crossref
Figure & Data
References
Citations
Citations to this article as recorded by 

- Photocatalytic Properties of WO3 Thin Films Prepared by Electrodeposition Method
Kwang-Mo Kang, Ji-Hye Jeong, Ga-In Lee, Jae-Min Im, Hyun-Jeong Cheon, Deok-Hyeon Kim, Yoon-Chae Nah
Journal of Korean Powder Metallurgy Institute.2019; 26(1): 40. CrossRef - Photocatalysis of TiO<sub>2</sub>/WO<sub>3</sub> Composites Synthesized by Ball Milling
Su-Yeol Yu, Chunghee Nam
Journal of Korean Powder Metallurgy Institute.2018; 25(4): 316. CrossRef
Photocatalytic and Adsorption Properties of WO3 Nanorods Prepared by Hydrothermal Synthesis

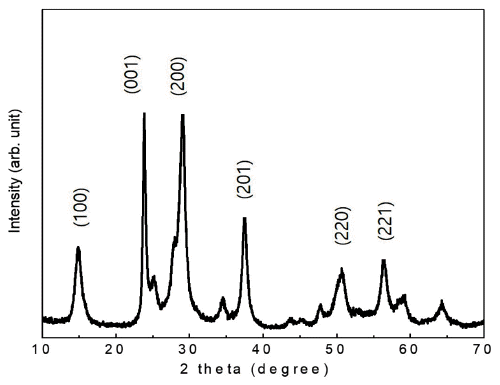

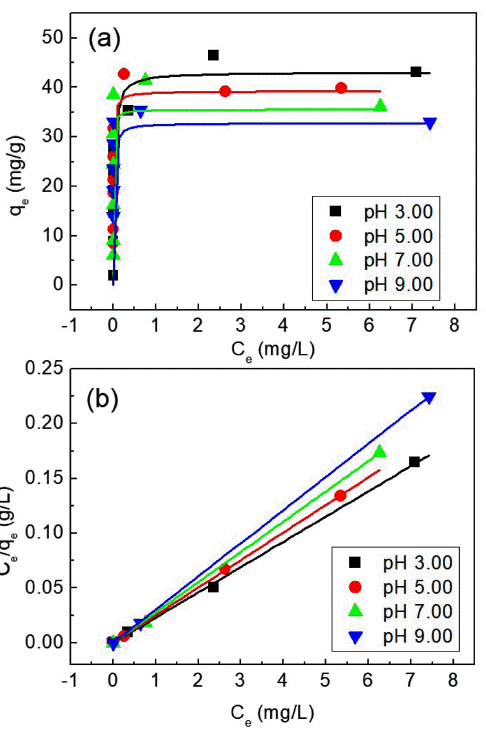
Fig. 1
SEM top-view images of chestnut bur shaped WO3 nanorods fabricated by hydrothermal synthesis: (a) magnification of 50,000 times (b) magnification of 100,000 times and (c) magnification of 200,000 times
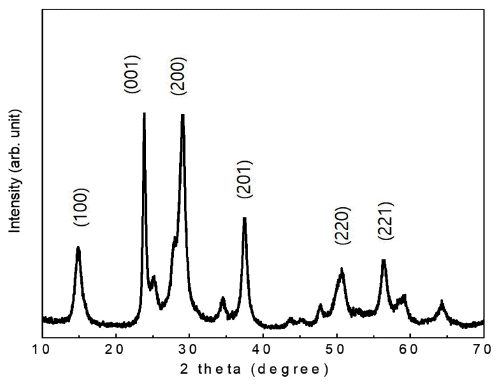
Fig. 2
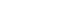
XRD pattern of WO3 powder prepared by hydrothermal synthesis with an addition of citric acid as directional agents.
Fig. 3
(a) TEM image and (b) HRTEM, SAED images, and lattice fringe spacing of WO3 nanorods with the hexagonal phase.
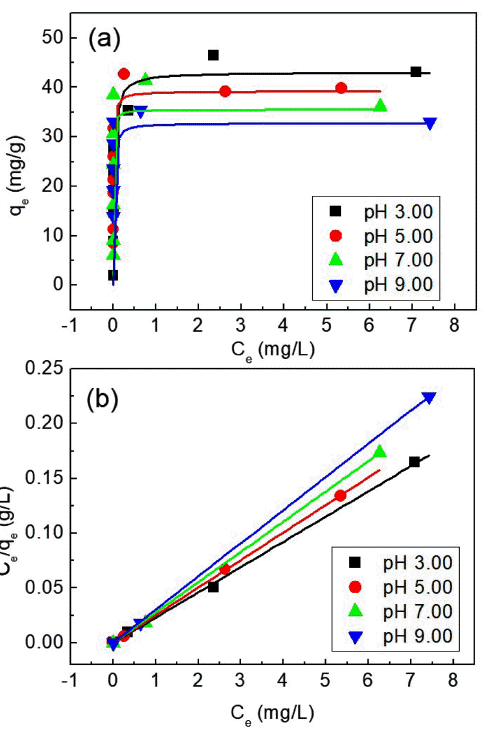
Fig. 4
(a) Maximum adsorption quantities (qm) of WO3 nanorods obtained from the Langmuir adsorption isotherm and (b) the linearized graph based on Eq. (3).
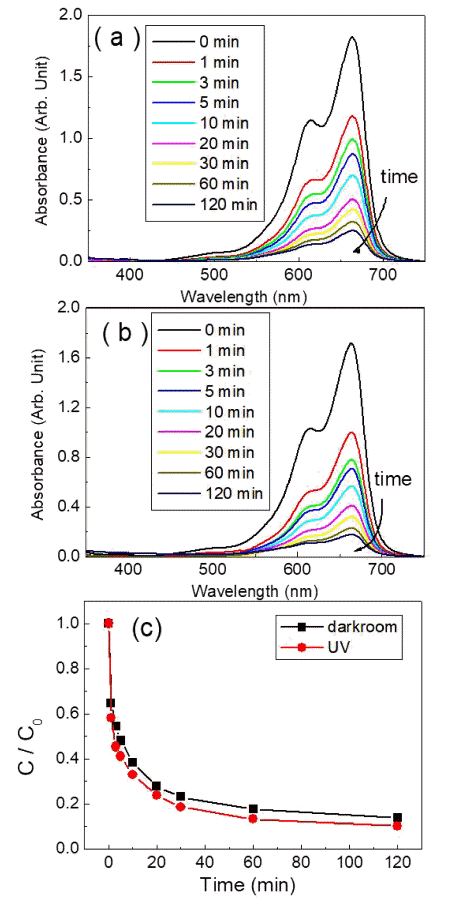
Fig. 5
Absorbance spectra of MB dyes in terms of (a) duration time in the darkroom and ultraviolet irradiation time. (c)comparison of Dye concentrations with time for dark room and UV-irradiation.
Fig. 1
Fig. 2
Fig. 3
Fig. 4
Fig. 5
Photocatalytic and Adsorption Properties of WO3 Nanorods Prepared by Hydrothermal Synthesis
| pH | 3.0 | 5.0 | 7.0 | 9.0 | |
|---|---|---|---|---|---|
|
|
|||||
| qm (mg/g) | 43.1 | 39.9 | 36.1 | 33.0 | |
| b (L/g) | 346 | 290 | 203 | 142 | |
Table 1
Maximum adsorption(qm) amounts and Langmuir isotherm constants(b) of tungsten oxides tested at various pH conditions
Table 1
TOP
 KPMI
KPMI



 Cite this Article
Cite this Article