Articles
- Page Path
- HOME > J Korean Powder Metall Inst > Volume 24(6); 2017 > Article
-
ARTICLE
Sol-gel법을 이용한 백색도가 높은 가시광 응답형 N-doped TiO2 제조 및 특성 평가 연구 - 이나리a, 유리b, 김태관c, 피재환a, 김유진b,*
- Preparation and Characterization of Visible Light-Sensitive N-doped TiO2 Using a Sol-gel Method
- NaRi Leea, Ri Yub, Tae Kwan Kimc, Jae-Hwan Peea, YooJin Kimb,*
-
Journal of Korean Powder Metallurgy Institute 2017;24(6):477-482.
DOI: https://doi.org/10.4150/KPMI.2017.24.6.477
Published online: November 30, 2017
a 한국세라믹기술원 도자세라믹센터
b 한국세라믹기술원 엔지니어링세라믹센터
c 나노태
a Ceramic Ware Center, Korea Institute of Ceramic Engineering and Technology, Icheon 17303, Republic of Korea
b Engineering Ceramic Center, Korea Institute of Ceramic Engineering and Technology, Icheon 17303, Republic of Korea
c Nanotae, Icheon 17303, Republic of Korea
- *Corresponding Author: Yoo Jin Kim, +82-31-645-1427, +82-31-645-1420, yjkim@kicet.re.kr
© The Korean Powder Metallurgy Institute. All rights reserved.
- 1,184 Views
- 8 Download
Abstract
- Nitrogen-doped titanium dioxide (N-doped TiO2) is attracting continuously increasing attention as a material for environmental photocatalysis. The N-atoms can occupy both interstitial and substitutional positions in the solid, with some evidence of a preference for interstitial sites. In this study, N-doped TiO2 is prepared by the sol–gel method using NH4OH and NH4Cl as N ion doping agents, and the physical and photocatalytic properties with changes in the synthesis temperature and amount of agent are analyzed. The photocatalytic activities of the N-doped TiO2 samples are evaluated based on the decomposition of methylene blue (MB) under visible-light irradiation. The addition of 5 wt% NH4Cl produces the best physical properties. As per the UV-vis analysis results, the N-doped TiO2 exhibits a higher visible-light activity than the undoped TiO2. The wavelength of the N-doped TiO2 shifts to the visible-light region up to 412 nm. In addition, this sample shows MB removal of approximately 81%, with the whiteness increasing to +97 when the synthesis temperature is 600oC. The coloration and phase structure of the N-doped TiO2 are characterized in detail using UV-vis, CIE Lab color parameter measurements, and powder X-ray diffraction (XRD).
- 최근 수질, 대기, 토질 등 여러 분야에서 오염 물질의 정 화 및 개선에 대한 연구가 진행되면서 광촉매 물질이 주 목 받고 있다[1, 2]. 광촉매는 빛을 받아서 친수성 분자를 활성화시켜 난분해성 물질의 산화를 유발하는 방식으로 작용된다[3]. 특히, 광촉매 TiO2는 인체에 무해하며 오염 물질 분해의 핵심인 산화력이 크고, OH 라디칼 생성을 통 한 간접 산화 반응[4], 화학적 안정성이 우수한 것으로 알 려져 있다[5-8]. TiO2는 anatase, rutile, brookskite의 결정 구조를 가지며, 각 구조에 따라 다른 물리/화학적 특성을 갖는다. 그 중에서 anatase형 TiO2는 3.2 eV로 에너지 밴드 갭이 높지만 전자와 홀의 재결합으로 인한 손실률이 낮아 광촉매 효율이 좋다[9, 10]. 다만 광촉매 활성도가 자외선 영역(λ < 380 nm)으로 국한되어 있기때문에 그 범위를 가 시광선 영역(400~700 nm)으로 확장하는 연구가 진행되고 있다[11, 12]. 광촉매 활성 범위를 확장하는 방법으로는 금 속계 :Pt, Cr, W, Ni, Mn, Fe, Cu 등 또는 비금속계 :N, P, S, F 등을 도핑(doping)하는 방법이 있다[13-18]. 상기의 물질을 사용하여 도핑시키면, 밴드갭 내에 전자가 존재할 수 있는 중간 단계를 형성시키며 기존에 요구되는 에너지 보다 낮아져 밴드갭이 감소함으로써 광촉매 활성화 범위 를 가시광선 영역까지 확장시킬 수 있다[19]. 대표적으로 는 N 이온을 광촉매 물질에 도핑하는 방법이 있다[20]. N 이온이 TiO2에 도핑되면 N 원자가 TiO2 결정격자내의 O 원자와 치환되어 N(2p) 준위가 TiO2의 valence band보다 높은 곳에 위치하게 되고, N(2p) 준위와 O(2p) 준위의 혼 성으로 인해 밴드갭의 간격이 감소하게 되어 광활성 범위 를 확장시킬 수 있다[20]. 도핑된 TiO2 물성과 광촉매 활 성에 의한 열처리 온도의 영향은 이미 보고가 되어 있으 나, 비표면적에 의한 광촉매 효과에 초점을 맞춘 연구이다 [21]. 반면에 본 연구는 빛을 광원으로 하는 조명체에 정 화 기능이 있는 기능성 조명을 개발하기 위한 연구로써, 백색도와 광촉매 특성에 초점을 맞추고 있다. 따라서, 본 연구에서는 졸겔법을 통해 N 이온을 TiO2 표면에 도핑하 고자 하였고, N 이온 도핑 첨가제 종류 등 합성 조건을 변 화시켜 고백색의 가시광 응답형 TiO2를 합성하였다.
서 론
- 광촉매용 가시광 응답형 N-doped TiO2를 대표적인 습식 합성법인 sol-gel법으로 합성하였다. 사용한 시약은 Ti source로 titanium isopropoxide(Ti[OCH(CH3)2]4, 95%, Daejung Chem., Korea)와 반응 용매인 isopropyl alcohol (IPA, 99.5%, Deajung Chem., Korea), 그리고 N 이온 도핑을 위한 source 로 ammonia solution(NH4OH-xH2O, 28% Junsei Chem., Japan)과 ammonium chloride(NH4Cl, 99% Junsei Chem., Japan)을 사용하였으며, 해당 시약은 별도의 정제과정 없이 사용하였다. 90 mL의 titanium isopropoxide를 360 mL의 IPA 에 용해하였다. Titanium isopropoxide의 5 wt%와 20 wt%에 해당하는 ammonia solution 4.5 mL와 18 mL, ammonium chloride 4.5 g과 18 g을 각각 40 mL 증류수에 희석한 후 미리 준비한 Ti suspension과 투입하였다. 이후 해당 용액 을 300 rpm의 속도로 12시간 동안 교반하여 가수분해 반 응시켰다. 반응물을 약 5시간동안 상온에서 숙성한 후, 용 매를 제거하기 위해 12시간 동안 80°C에서 건조하였다. 건조된 반응물은 2°C/min의 승온 속도로 500°C와 600°C 에서 각각 합성하여 N-doped TiO2를 제조하였다. N 이온 도핑 첨가량은 A, 합성 온도는 T로 명명하여 시료명을 표 기하였다. 예를 들어 5A-600T는 첨가량이 5 wt%이고 합 성온도는 600°C 인 N-doped TiO2이며 표 1에 표기하였다. 제조된 N-doped TiO2의 광촉매 특성 거동에 대한 평가를 위해 범용적으로 이용되는 methylene blue trihydrate (C16H24CIN3O3S·H2O, 97%, Daejung Chem. Korea)의 분해 효율에 대한 평가를 하였다. 0.18 g의 메틸렌 블루가 용해 된 500 mL의 수용액에 0.01 g의 준비된 시료를 투입하여 가시광 노출시간에 따른 광촉매의 유기물 분해 특성을 평 가하였다. N-doped TiO2 합성된 조건에 따른 결정구조의 분 석을 위해 CuKα radiation(λ = 1.54178 Å)의 조건으로 X선 회절(Right D/max 2500v/pc, Rigaku, Japan)을 측정하였다. 또한, N 이온 도핑 첨가제 양 및 합성 온도에 따른 광학적 특성 및 광촉매 특성 거동은 UV-Visible Spectrometer(UV- 2600, Shimazu, Japan)를 이용하여 분석하였다. 분광광도 계를 통한 광학적 특성분석과 더불어 제조된 입자의 색도 에 대한 평가를 위해 색차계(Handy color meter, NR-12A, Nippon Denshoku Industries Co., LTD. Japan)를 활용하여 색상변화에 대한 고찰을 하였다.
실험 방법
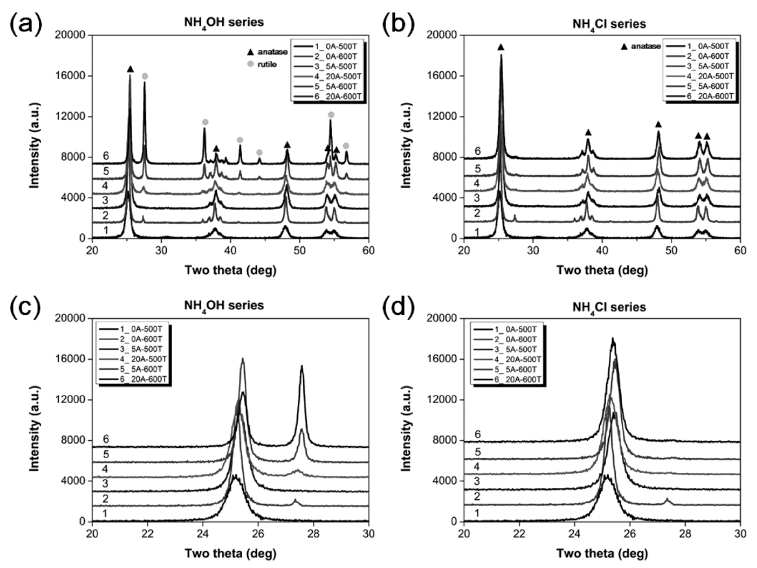
- 그림 1는 N이온 도핑 첨가제 및 합성 온도 조절하여 제 조한 N-doped TiO2 분말의 결정상 분석 결과이다. N 이온 을 도핑하지 않은 TiO2의 경우, 500°C에서는 아나타제 (JCPDS No. 00-064-0863), 600°C에서는 아나타제와 루타 일 (JCPDS No. 00-021-1276) 일부가 혼재된 것을 그림 1 에서 볼 수 있다. 한편, N 이온 도핑 첨가제로 NH4OH를 이용한 경우 500°C에서는 주요 결정상이 아나타제로 확인 되었고, NH4OH 양이 20 wt%으로 증가하면서 루타일 결 정상이 생성되었다. 특히, 그림 1(a)에서 볼 수 있듯이 합 성 온도와 첨가제 양이 증가할수록 루타일 결정상이 높아 지는 것을 볼 수 있다. 순수 TiO2도 600°C에서는 일부 루 타일 결정상이 생성된 것에 비해, N 이온 도핑 첨가제로 NH4Cl 사용한 경우에는 첨가제 양, 합성 온도 관계없이 아나타제 결정상만 생성되었다(그림 1(b)). 이는 NH4OH 와 NH4Cl을 사용하였을 때의 H+ 이온을 방출하는 해리도 차이로 인해 결정구조적으로 차이가 발생하기 때문이다. 즉, pH가 낮은 경우에는 루타일형 TiO2 결정상이 형성되 고 pH가 높은 경우 아나타제형 TiO2 결정상이 형성된다 [25]. 20~30°를 부분 확대한 그림 1(c)와 1(d)를 XRD 결 과를 보면, O 이온 일부가 N 이온으로 치환되어 순수 TiO2보다 N이온 도핑 첨가제를 넣고 합성한 TiO2는 전체 적으로 쉬프트된 것을 볼 수 있는데, 이를 통해 N-doped TiO2로 제조된 것을 알 수 있었다.
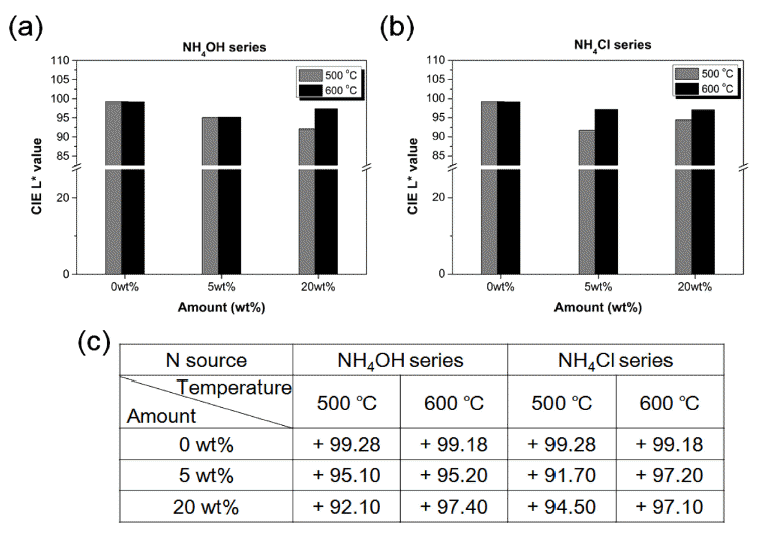
- 그림 2는 N 이온 도핑 첨가제 양과 합성 온도에 따라 가시광 응답형으로 제조된 N-doped TiO2의 백색도 변화를 비교한 그래프이다. CIE Lab은 각각 명암(L*), 적/녹색 (a*), 황/청색(b*)을 의미하는 지표로써, D65를 기준으로 L* 값을 통해 백색도를 확인할 수 있다[22]. N 이온을 도핑하 지 않은 TiO2의 백색도는 500°C와 600°C에서 각각 +99.28 와 + 99.18으로 매우 높은 L*값을 가졌다. N 이온 도핑 첨 가제로 NH4OH를 넣어 제조한 N-doped TiO2의 백색도는 각 조건별로 5A-500T (+95.10), 5A-600T (+95.20), 20A- 500T (+92.10), 20A-600T (+97.40)를 갖고, NH4Cl 도핑제 의 경우에는 5A-500T (+91.70), 5A-600T (+97.20), 20A- 500T (+94.50), 20A-600T (+97.10)임을 그림 2(c)에서 볼 수 있다. 대표적인 광촉매 물질로 알려진 대구사 P25의 백 색도는 +99.83으로 매우 높은 값을 가지며, 루타일과 아나 타제의 결정상이 70:30로 이루어져 있다[7]. NH4OH를 이 용해 제조된 N-doped TiO2의 경우에도 온도가 높아지면서 루타일과 아나타제의 비율이 최대 60:40으로 증가한 것을 확인할 수 있는데, 백색도는 아나타제-루타일의 상전이와 관련이 있다[17]. 루타일은 발색단(chromophore) 주위보다 는 대칭적인 배위(symmetrical coordination)를 유도하여 Jahn-teller effect를 감소시키기 때문에 백색도가 증가하게 된다. 또한, 순수 TiO2보다 N-doped TiO2의 백색도는 낮으 나, 합성 온도를 높여 루타일 결정상 비율을 증가시키면 백색도를 증가시킬 수 있을 것으로 여겨진다.
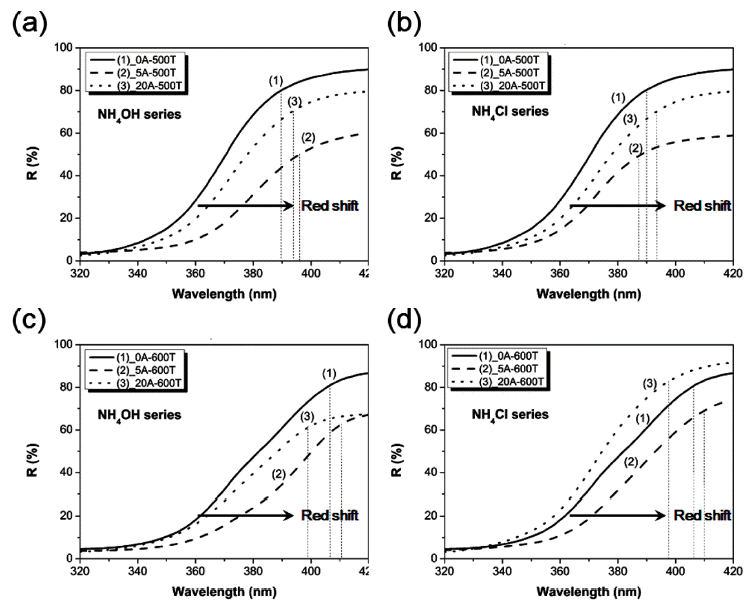
- N 이온을 도핑시켜 제조한 TiO2의 광학적 특성을 평가 하기 위해 반사율을 측정하였다. 그림 3은 N 이온 도핑 첨 가제 양 및 합성 온도에 따른 반사율 변화를 비교한 그래 프이다. 500°C와 600°C에서 합성한 순수 TiO2의 고유 파 장대는 각각 390, 406 nm로 확인되었으며 이를 기준으로 N 이온이 도핑되었을 때 단파장 혹은 장파장 영역으로 쉬 프트 되었는지 비교 분석하였다. 순수 TiO2 대비 N-doped TiO2는 도핑 첨가제 양 및 합성 온도에 따라 파장의 변화 를 보였다. 그림 3(a)와 3(c)에서 보듯이, NH4OH를 5, 20 wt%를 넣고 500°C에서 제조한 N-doped TiO2는 396 nm, 394 nm으로 N 이온을 도핑하지 않은 TiO2보다 4~6 nm 가 량 쉬프트 되었고, 600°C에서 제조한 N-doped TiO2는 각 각 409, 399 nm로 3~7 nm정도 쉬프트 되었다. 한편 NH4Cl를 5, 20 wt%를 넣고 500°C에서 제조한 N-doped TiO2는 394, 387 nm, 600°C에서는 412, 398 nm으로 약 3~8 nm 쉬프트 된 것을 그림 3(b)와 3(d)에서 확인하였다. 대부분 N-doped TiO2는 순수 TiO2 대비 장파장쪽으로 쉬 프트 되었지만, 일부 조건에서는 순수 TiO2보다 단파장 영 역으로 쉬프트 되었다. 특히, NH4Cl를 5 wt% 넣고 600°C 에서 제조한 N-doped TiO2가 410 nm로 장파장 영역쪽으 로 가장 많이 쉬프트 되었다. 이를 통해 도핑 첨가제가 20 wt%인 조건보다는 5 wt%인 조건이 가시광 영역까지 범위를 확장시키는데 효과적인 것을 확인하였다.
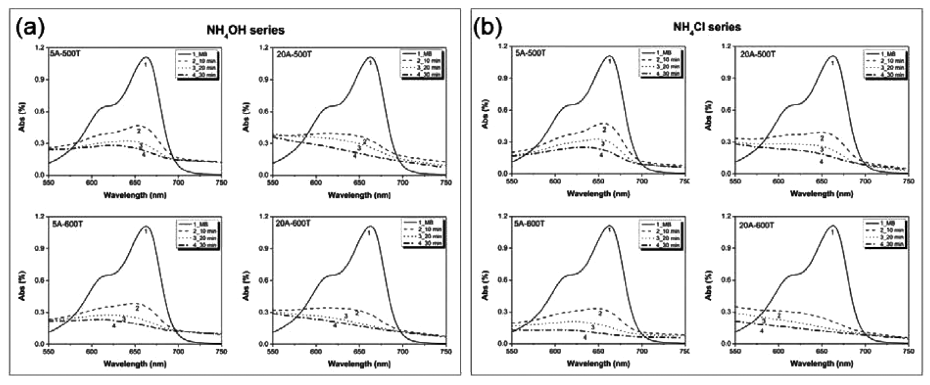
- 합성한 N-doped TiO2의 가시광 영역에서의 활성도를 확 인하기 위하여 가장 잘 알려진 메틸렌 블루 분해 테스트 법을 이용하였다[23]. 일반적으로 메틸렌 블루를 수용액으 로 제조시 파란색을 띠며 가시광선에서 분해되어 용액색 이 투명하게 변화되지만 자외선 영역에서는 거의 분해되 지 않는 특성을 갖고 있다. 메틸렌 블루는 헤테로 고리 방 향족 화합물로 상온에서는 짙은 녹색이고 산화반응에서는 푸른색을 띄지만 광촉매와 반응하면 빛에 의해 환원 작용 이 발생하여 N 이온이 H 이온과 결합하면서 분자 구조에 결함이 생기면서 투명해진다[24]. 그림 4는 광조사 시간에 따른 N-doped TiO2의 광분해 특성을 테스트한 흡광도 그 래프이다. 가시광 응답형으로 제조한 N-doped TiO2에 의 해 메틸렌 블루 초기 분해율이 50% 이상 감소하는 것을 볼 수 있다. 합성 온도 및 첨가제 양에 의한 분해량 차이 는 있지만, N 이온 도핑 첨가제 종류 관계없이 광노출 시 간이 증가할수록 약 680 nm 부근의 메틸렌 블루 흡광 피 크를 감소시켰다. 앞서 언급했듯이, 흡광도가 감소한 이유 는 N-doped TiO2가 빛 에너지를 받아 촉매로 작용하면서 메틸렌 블루의 일정한 결합을 단절시키기 때문이며, 이를 통해 제조된 샘플들이 가시광 영역에서의 유기물 분해 효 과가 있는 것을 확인하였다.
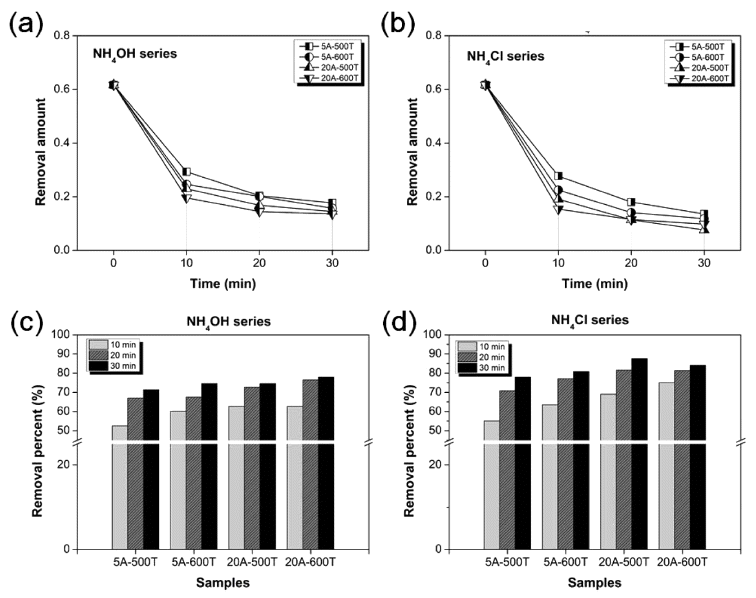
- 그림 5는 광조사 시간별 N-doped TiO2의 광촉매 효율을 정량적으로 비교한 메틸렌 블루 농도 변화 및 분해 효율 을 나타낸 그래프이다. 메틸렌 블루 용액의 680 nm 파장 대의 흡광도와 각각의 N-doped TiO2를 혼합한 용액을 태 양광에 노출하여 10분 간격으로 흡광도를 체크하여 농도 변화를 그림 5(a)와 5(b)에 나타내었고, 이 농도변화를 토 대로 메틸렌 블루 분해 효율을 환산하여 그림 5(c)와 5(d) 에 표기하였다. 초기 메틸렌 블루 농도가 0.62인 것 비해 태양광에 10분 노출시, 약 0.15~0.30로 농도로 급격히 감 소하였다. 이때, N 도핑 첨가제인 NH4OH와 NH4Cl를 넣 고 합성한 N-doped TiO2의 분해 효율은 각각 53~68% 및 55~75%으로 NH4Cl이 약 7%로 조금 더 높았다. 광조사 10분 경과 후부터는 분해량은 감소하나, 20분에는 약 67~82%, 30분일 때는 71~88%으로 지속적으로 메틸렌 블 루가 분해되는 것을 확인하였다. 특히, NH4Cl 20 wt% 첨 가해 500~600°C에서 합성한 시료와 NH4OH 20 wt% 넣고 600°C에서 합성한 시료가 가장 높은 분해 효율을 보였다. 그러나, 그림 3의 반사율 분석에서 볼 수 있듯이 이 시료 들은 N 이온을 도핑하지 않은 TiO2 보다 blue shift되었기 때문에 가시광 영역에서의 분해효과라고 판단하기에는 확 실하지가 않다. 반면에 NH4Cl 5 wt%를 첨가해 600°C에서 합성한 N-doped TiO2는 가장 많이 red shift 되었으며, 가 시광 영역에서 81%의 높은 분해 효율을 갖는 가시광 응 답형 TiO2라고 판단된다.
결과 및 고찰
X-ray diffraction spectrum of as-prepared N-doped TiO2 powders by N ion source and synthesized temperature; (a) NH4OH series and (b) NH4Cl series. Enlarge scale from 20o to 30o; (c) NH4OH series and (d) NH4Cl series.
Whiteness comparison graph of N-doped TiO2 powders by N ion source content; (a) NH4OH series and (b) NH4Cl series. (c) Whiteness table according to synthesis conditions.
Reflectance of N-doped TiO2 powders. NH4OH series; (a) 500°C, (b) 600°C and NH4Cl series; (c) 500°C, (d) 600°C.
Methylene blue decomposition graph of N-doped TiO2 with irradiation time under sunlight; (a) NH4OH series and (b) NH4Cl series.
- 본 논문에서는 졸겔법을 활용하여 가시광 응답형 Ndoped TiO2를 제조하였다. N 이온 도핑 첨가제로는 NH4OH 및 NH4Cl로 이용하였고, 합성 온도는 500~600°C로 변화 시켰다. 순수 TiO2 대비 N-doped TiO2의 결정상과 백색도 를 비교하고 메틸렌 블루 용액을 이용하여 흡광도를 측정 하고 광분해 효과를 확인하였다. NH4OH를 첨가하여 600°C에서 제조한 N-doped TiO2는 아나타제-루타일 비율 이 40:60인 혼합 결정상으로 백색도가 +97 이상으로 가장 높았으며, 순수 TiO2에 비해 큰 차이는 없는 것으로 확인 되었다. 반면, 반사율과 메틸렌블루 분해율은 NH4Cl이 5 wt% 첨가되었을 때, 아나타제 결정상이지만 최대 412 nm까지 장파장 영역으로 쉬프트 되었고, 81 %로 높 은 제거율을 보였다. 최종적으로 NH4Cl이 NH4OH보다 N 이온 도핑에 유리하며, 첨가제 양이 5 wt% 이하이고 600 °C일 때 우수한 가시광 응답형 N-doped TiO2가 제조되는 것을 확인 할 수 있었다.
결 론
-
Acknowledgements
- 본 연구는 경제 협력권 산업육성사업의 나노융합소재 R&D (R0004801)로 수행되었으며, 이에 감사드립니다.
감사의 글
- 1. D.M. Tobaldi, R.C. Pullar, A.F. Gualtieri, G. Otero-Irurueta, M.K. Singh, M.P. Seabra and J.A. Labrincha: J. Solid State Chem.., (2015) 231 87.Article
- 2. C. Di Valentin, E. Finazzi, G. Pacchioni, A. Selloni, S. Livraghi, M.C. Paganini and E. Giamello: Chem. Phys.., (2007) 339 44.
- 3. D. Bahenemann, D. Bockelmann and R. Goslich: Sol. Energy Mater.., (1991) 24 564.
- 4. M.C. Yeber, J. Rodrguez, J. Freer, J. Baeza, N. Durn and H.D. Mansilla: Chemosphere., (1999) 39 1679.Article
- 5. A.L. Linsebigler, G. Lu and J.T. Yates: Chem. Rev.., (1995) 95 735.Article
- 6. M.R. Hoffmann, S.T. Martin, W. Choi and D.W. Bahnemann: Chem. Rev.., (1995) 95 69.Article
- 7. T.L. Thompson and J.T. Yates: Chem. Rev.., (2006) 106 4428.Article
- 8. J.M. Hermann, C. Duchamp, M. Karkmaz, B.T. Hoai, H. Lachheb, E. Puzenat and C. Guillard: J. Hazard. Mater.., (2007) 146 624.
- 9. M.V. Rao, K. Rajeshwar, V.R. Vernerker and J. Dubow: J. Phys. Chem.., (1980) 84 1987.Article
- 10. G.K. Boschloo, A. Goossens and J. Schoonman: J. Electroanal. Chem.., (1997) 428 25.Article
- 11. Y. Ishibai, J. Sato, T. Nishikawa and S. Miyagishi: Appl. Catal. B., (2008) 79 117.Article
- 12. W. Choi, A. Termin and M.R. Hoffmann: J. Phys. Chem.., (1994) 98 13669.Article
- 13. C.H. Huang, I.K. Wang, Y.M. Lin, Y.H. Tseng and C.M. Lu: J. Mol. Catal. Chem.., (2010) 316 163.Article
- 14. S.T. Martin, C.L. Morrison and M.R. Hoffmann: J. Phys. Chem.., (1994) 98 13695.Article
- 15. L. Palmisano, V. Augugliaro, A. Sclafani and M. Schiavello: J. Phys. Chem.., (1988) 92 6710.Article
- 16. J. Zhu, W. Zheng, B. He, J. Zhang and M. Anpo: J. Mol. Catal. Chem.., (2004) 216 35.Article
- 17. F.T. Vieira, D.S. Melo, S.J. Lima, E. Longo, C.A. Paskocimas, W.S. JA nior and A.G. Souza: Mater. Res. Bull.., (2009) 44 1086.Article
- 18. E.M. Samsudin and S.B. Hamid: Appl. Surf. Sci.., (2017) 391 326.Article
- 19. K. Nakata and A. Fujishima: J. Photochem. Photobiol. C Rev.., (2012) 13 169.Article
- 20. C.D. Valentin, E. Finazzi, G. Pacchioni, A. Selloni, S. Livraghi, M.C. Paganini and E. Giamello: Chem. Phys.., (2007) 339 44.
- 21. S.Y. Lim and et al: Appl. Chem. Eng.., (2011) 22 61.
- 22. J.D. Cunha, D.M. Melo, A.E. Martinelli, M.A. Melo, I. Maia and S.D. Cunha: Dyes Pigm.., (2005) 65 11.Article
- 23. S.M. Chin, E.S. Park, M.S. Kim and J.S. Jurng: Powder Technol.., (2010) 201 171.Article
- 24. G. Munjal, G. Dwivedi and A.N. Bhaskarwar: Int. Proc. Chem. Biol. Environ. Eng.., (2015) 90 82.
- 25. M. Henry, J.P. Jolivet and J. Livage, Chemistry Spectroscopy and Applications of Sol-Gel Glasses, (1992) Springer, Berlin 77 153.
Figure & Data
References
Citations

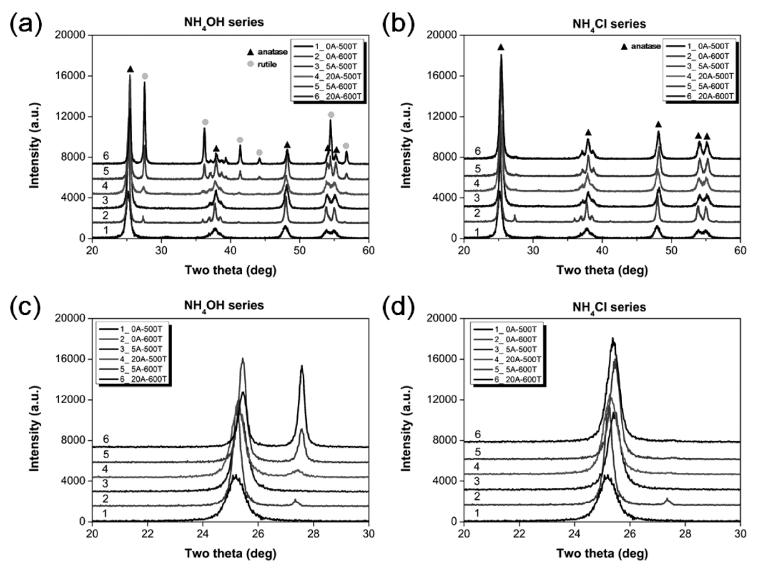




Fig. 1
Fig. 2
Fig. 3
Fig. 4
Fig. 5
| No. | N source | Amount (wt%) | Temp. (°C) | Naming |
|---|---|---|---|---|
|
|
||||
| 1 | NH4OH or NH4Cl | 0 | 500 | 0A-500T |
| 2 | 5 | 5A-500T | ||
| 3 | 20 | 20A-500T | ||
| 4 | 0 | 600 | 0A-600T | |
| 5 | 5 | 5A-600T | ||
| 6 | 20 | 20A-600T | ||
Table 1
TOP
 KPMI
KPMI

 Cite this Article
Cite this Article





