Articles
- Page Path
- HOME > J Korean Powder Metall Inst > Volume 25(3); 2018 > Article
-
ARTICLE
폐니켈수소전지로부터 회수된 희토류 침전물의 희토류 산화물 분말 제조에 대한 연구 - 김대원a,*, 안낙균a, 심현우a, 박경수a, 최희락b
- A Study on the Preparation of Rare Earth Oxide Powder for Rare Earth Precipitates Recovered from Spent Ni-MH Batteries
- Dae-Weon Kima,*, Nak-Kyoon Ahna, Hyun-Woo Shima, Kyung-Soo Parka, Hee-Lack Choib
-
Journal of Korean Powder Metallurgy Institute 2018;25(3):213-219.
DOI: https://doi.org/10.4150/KPMI.2018.25.3.213
Published online: May 31, 2018
a 고등기술연구원 신소재공정센터
b 부경대학교 재료공학과
a Advanced Materials and Processing Center, Institute for Advanced Engineering (IAE), Yongin 17180, Korea
b Depatment of Materials Science & Engineering, Pukyong National University, Busan, 608-739, Korea
- *Corresponding Author: Dae-Weon Kim, TEL: +82-31-330-7458, FAX: +82-31-330-7116, E-mail: mdsimul@iae.re.kr
• Received: April 27, 2018 • Revised: May 2, 2018 • Accepted: May 14, 2018
© The Korean Powder Metallurgy Institute. All rights reserved.
- 561 Views
- 2 Download
- 2 Crossref
Figure & Data
References
Citations
Citations to this article as recorded by 

- Recycling of Rechargeable Batteries: Insights from a Bibliometrics‐Based Analysis of Emerging Publishing and Research Trends
Jiao Lin, Xiaodong Zhang, Li Cai, Ersha Fan, Shumeng Wu, Su Ma, Feng Wu, Renjie Chen, Li Li
Advanced Energy and Sustainability Research.2022;[Epub] CrossRef -
Synthesis of Rare Earth Oxide from NaREE(SO4)2·H2O by Ion Substitution Reaction
Dae-Weon Kim, Bo-Ram Kim, Hee-Lack Choi
Journal of the Korean Society of Mineral and Energy Resources Engineers.2020; 57(5): 405. CrossRef
A Study on the Preparation of Rare Earth Oxide Powder for Rare Earth Precipitates Recovered from Spent Ni-MH Batteries
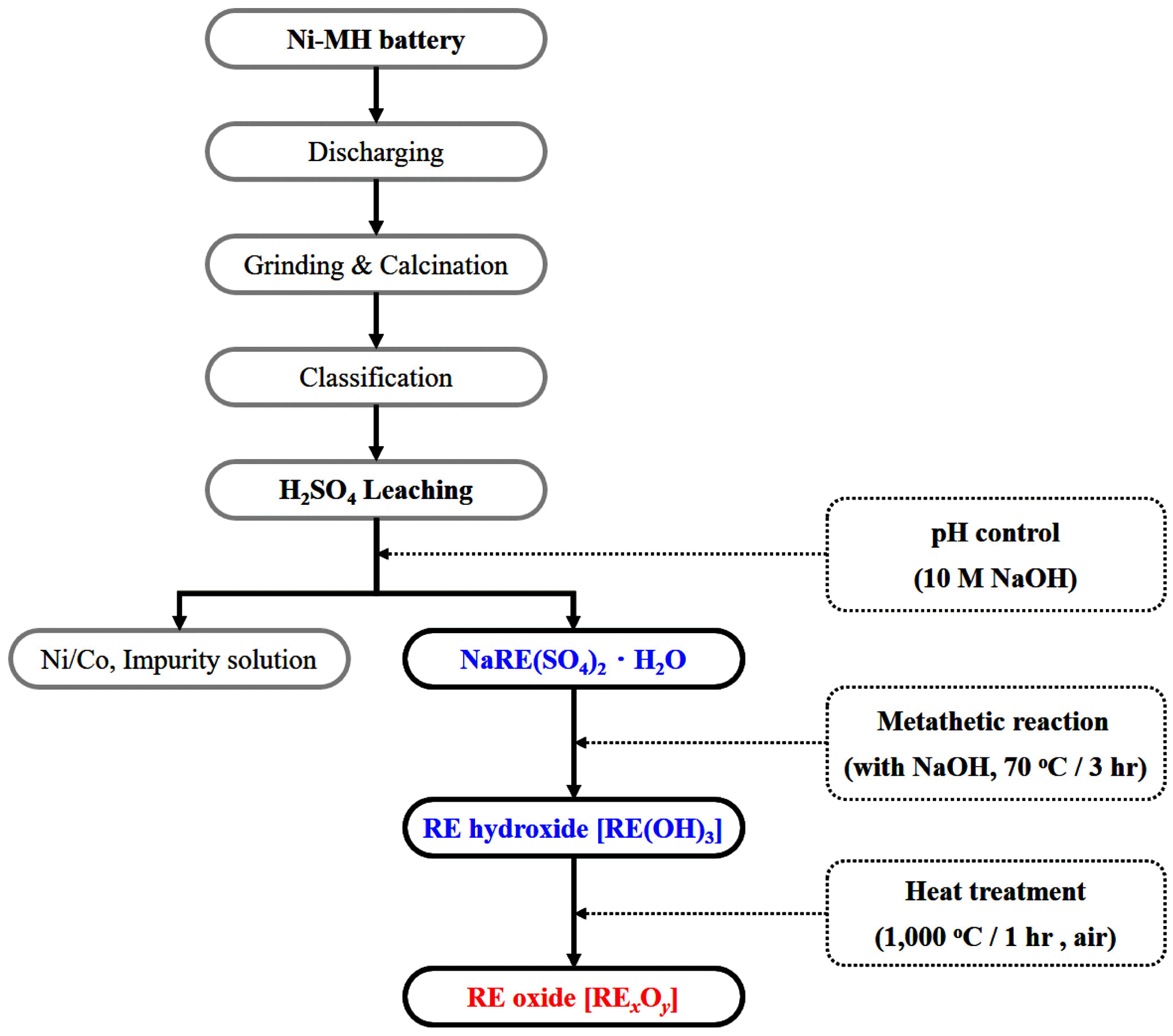
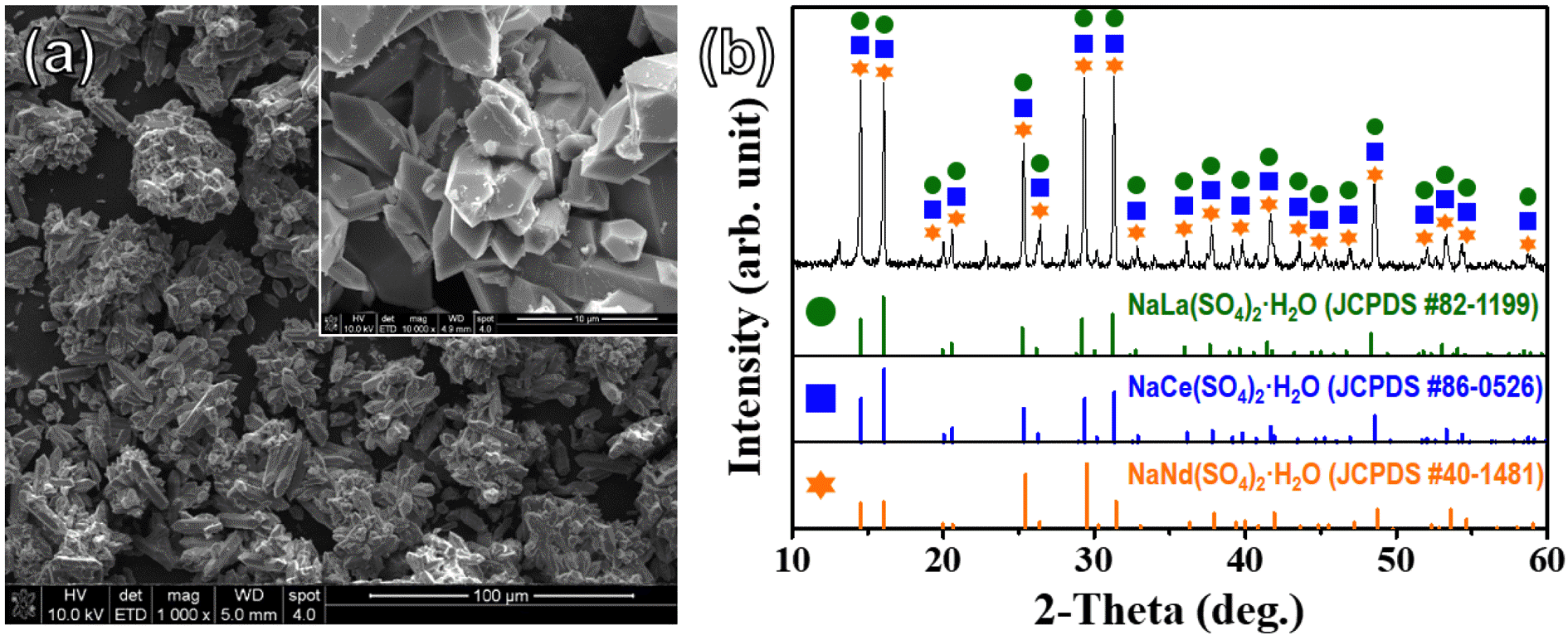
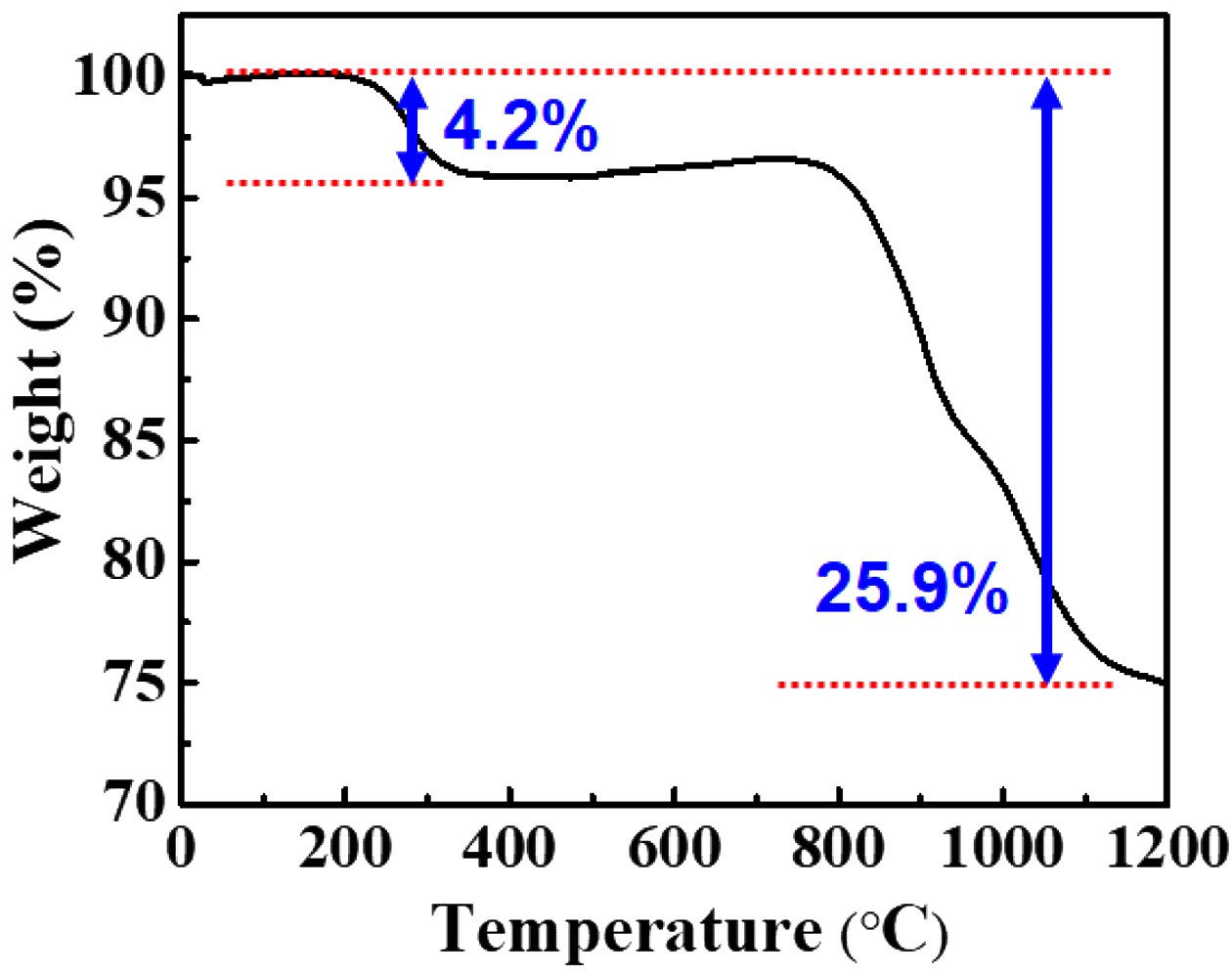
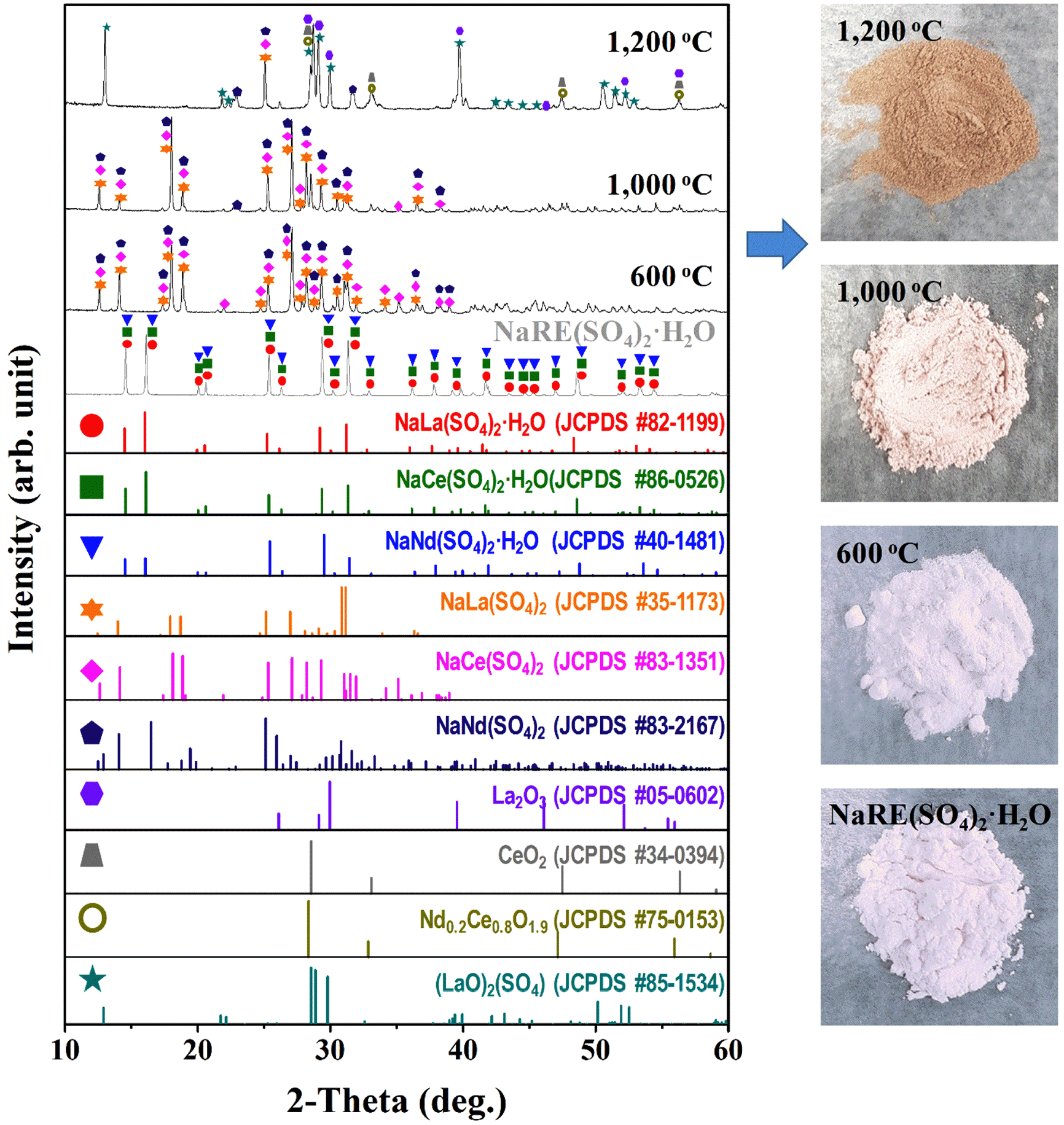

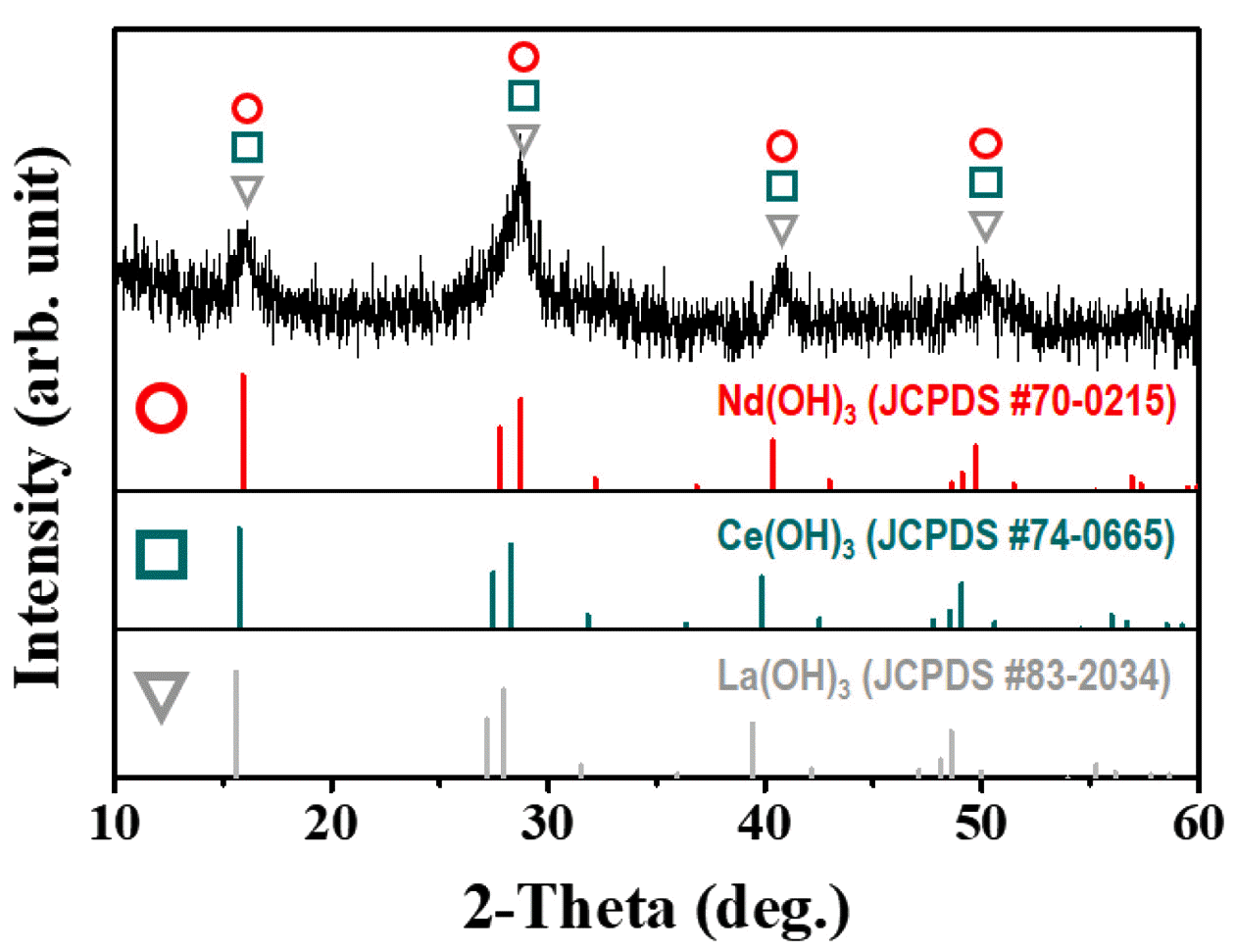
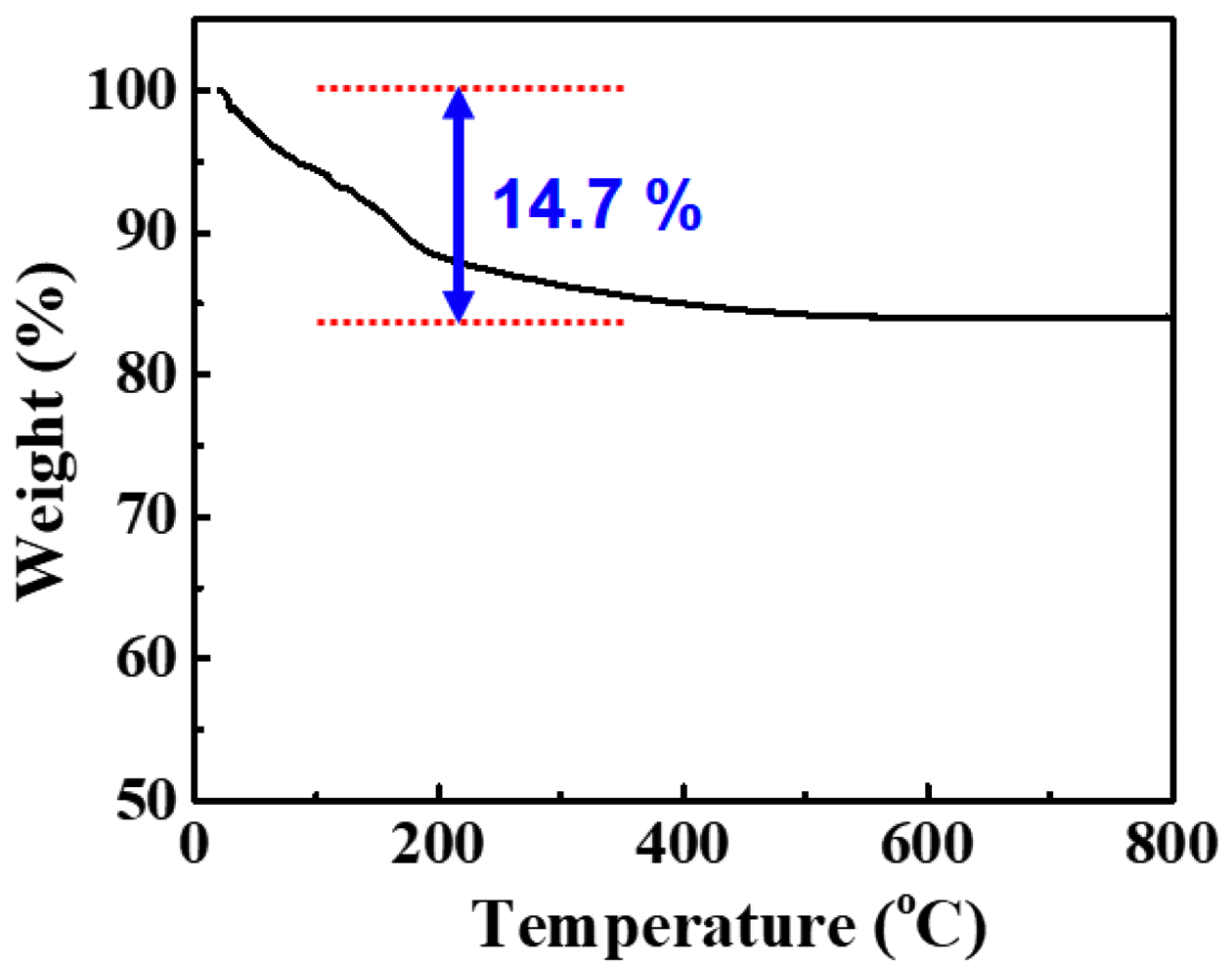
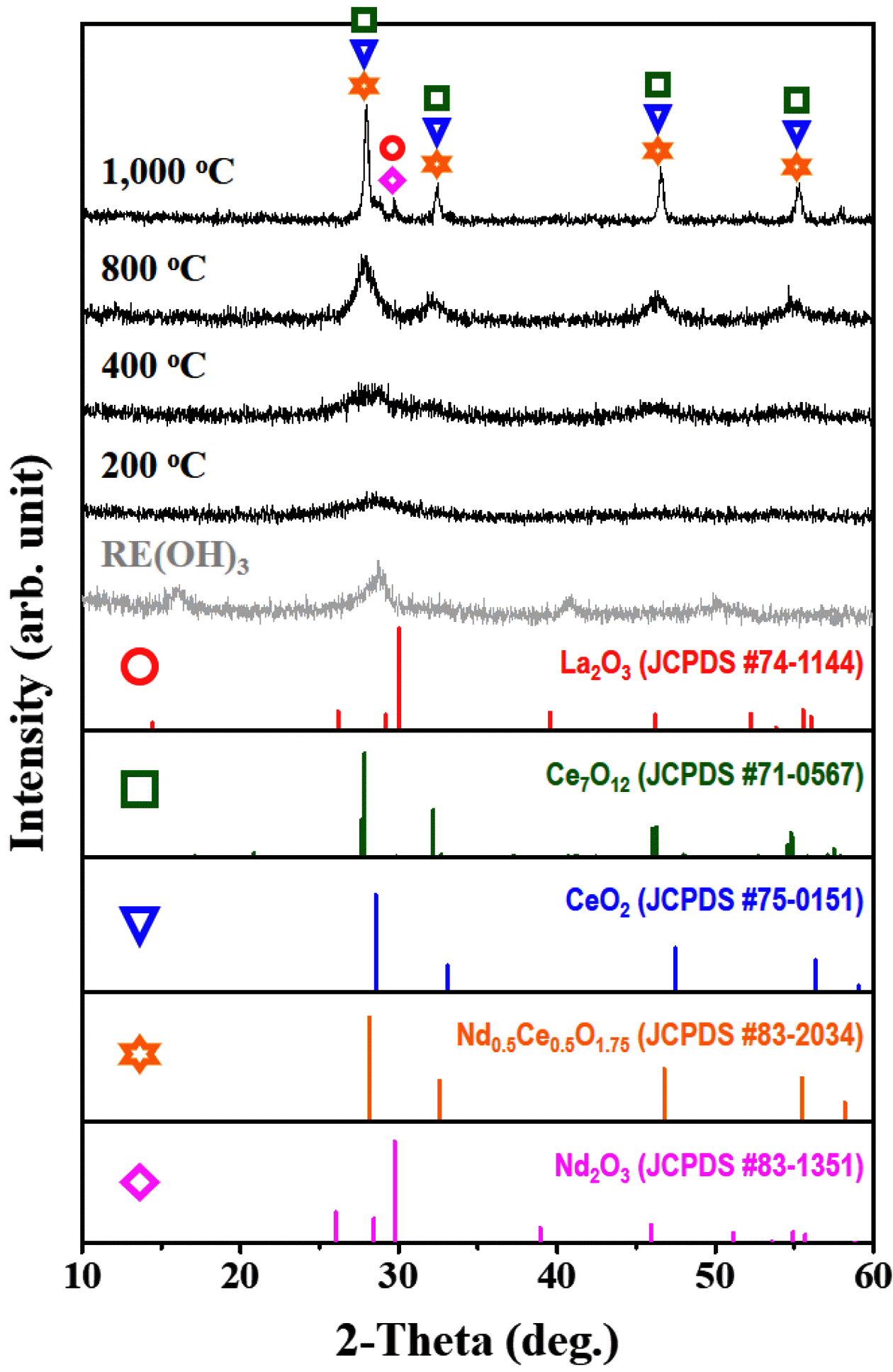
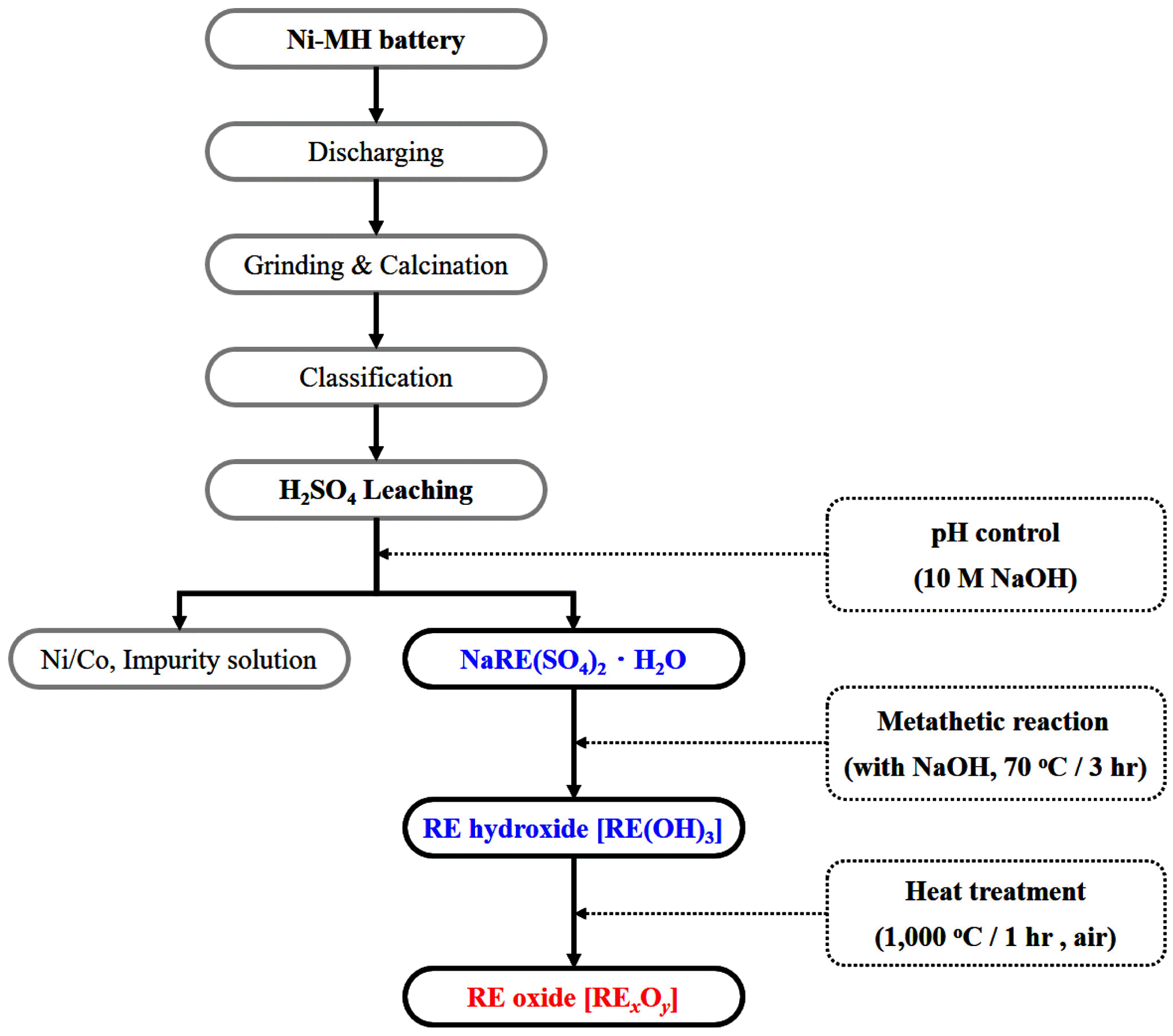
Fig. 1.
Experimental procedure for the preparation of rare earth oxides from spent Ni-MH batteries.
Fig. 2.
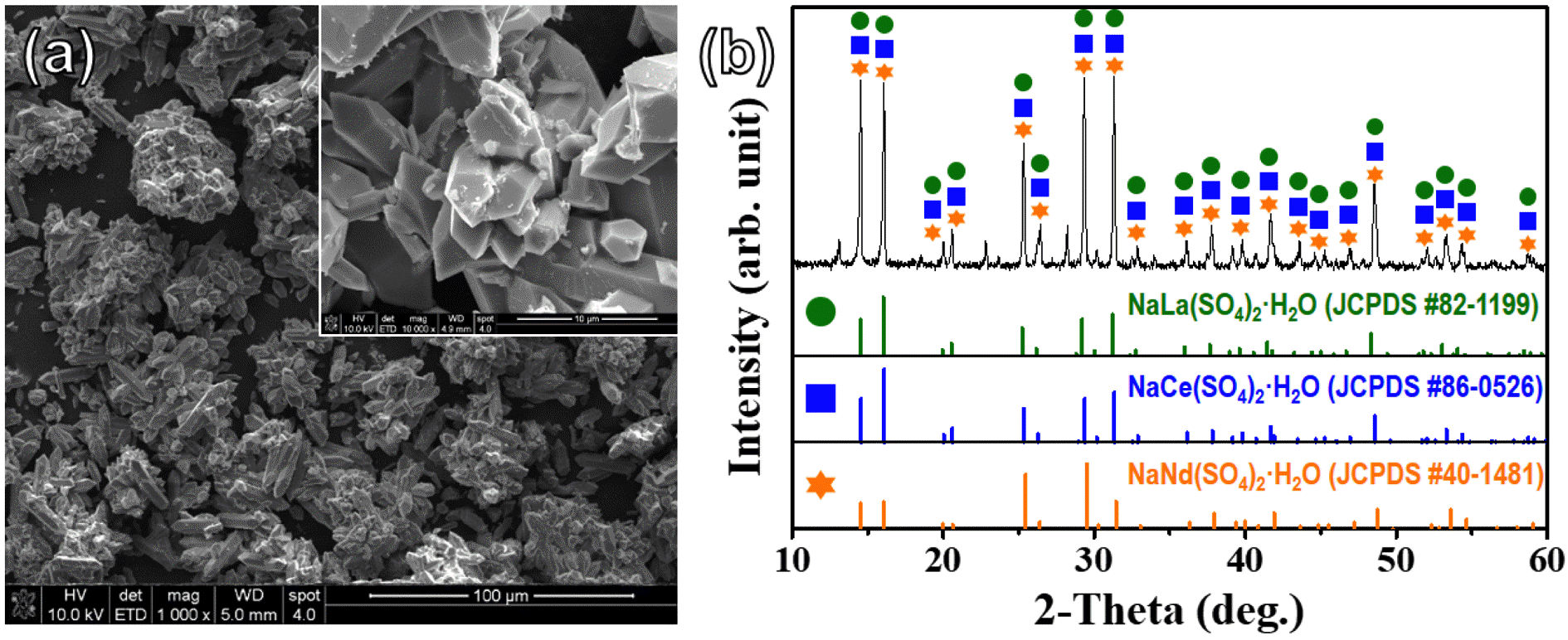
(a) Typical FESEM image and (b) XRD pattern of rare earth precipitates taken after H2SO4 leaching process. The inset of (a) shows a high-magnification observation of rare earth precipitates.
Fig. 3.
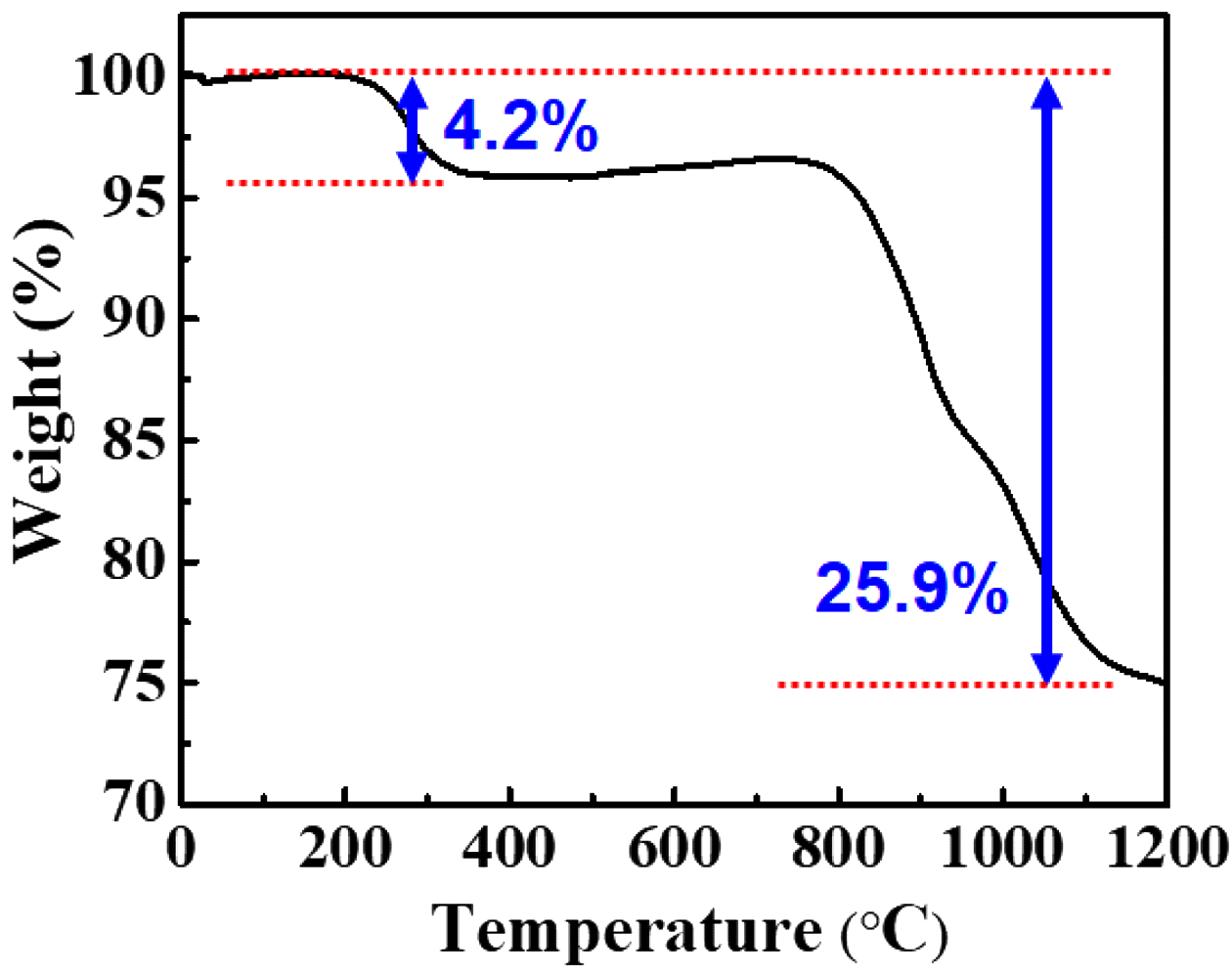
Thermal behavior of rare earth precipitates (NaRE (SO4)2·H2O, RE = La, Ce, Nd) in air (Heating rate: 10°C/MIn).
Fig. 4.
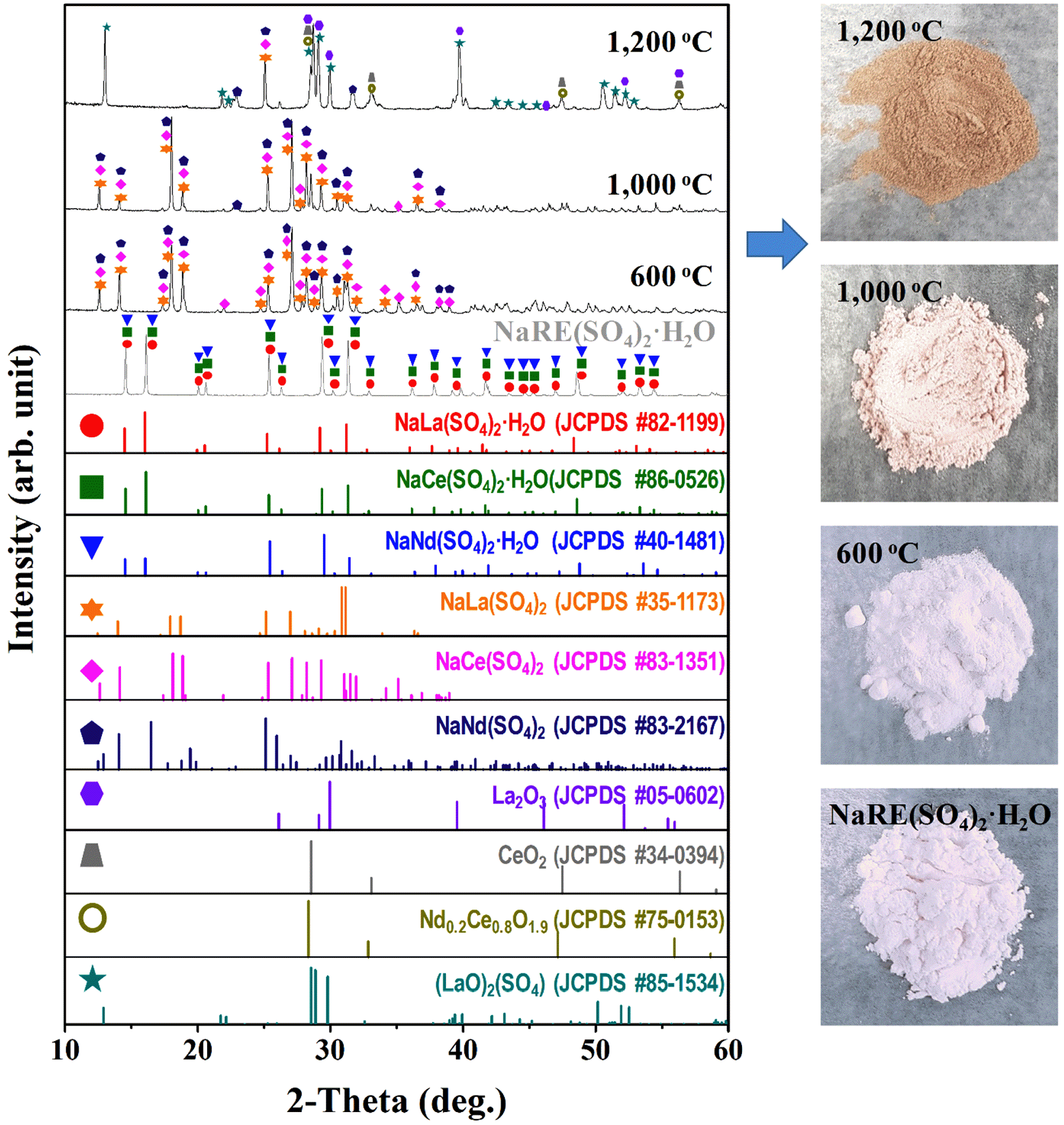
XRD patterns of rare earth precipitates (NaRE(SO)4·H2O) with the various heat treatment conditions (left), and corresponding the digital photographs of powder, respectively (right).
Fig. 5.
(a) Digital photographs from the rare earth precipitate (NaRE(SO4)2·H2O) to rare earth oxide (RExOy) powders, and (b~d) corresponding FESEM images, respectively.
Fig. 6.
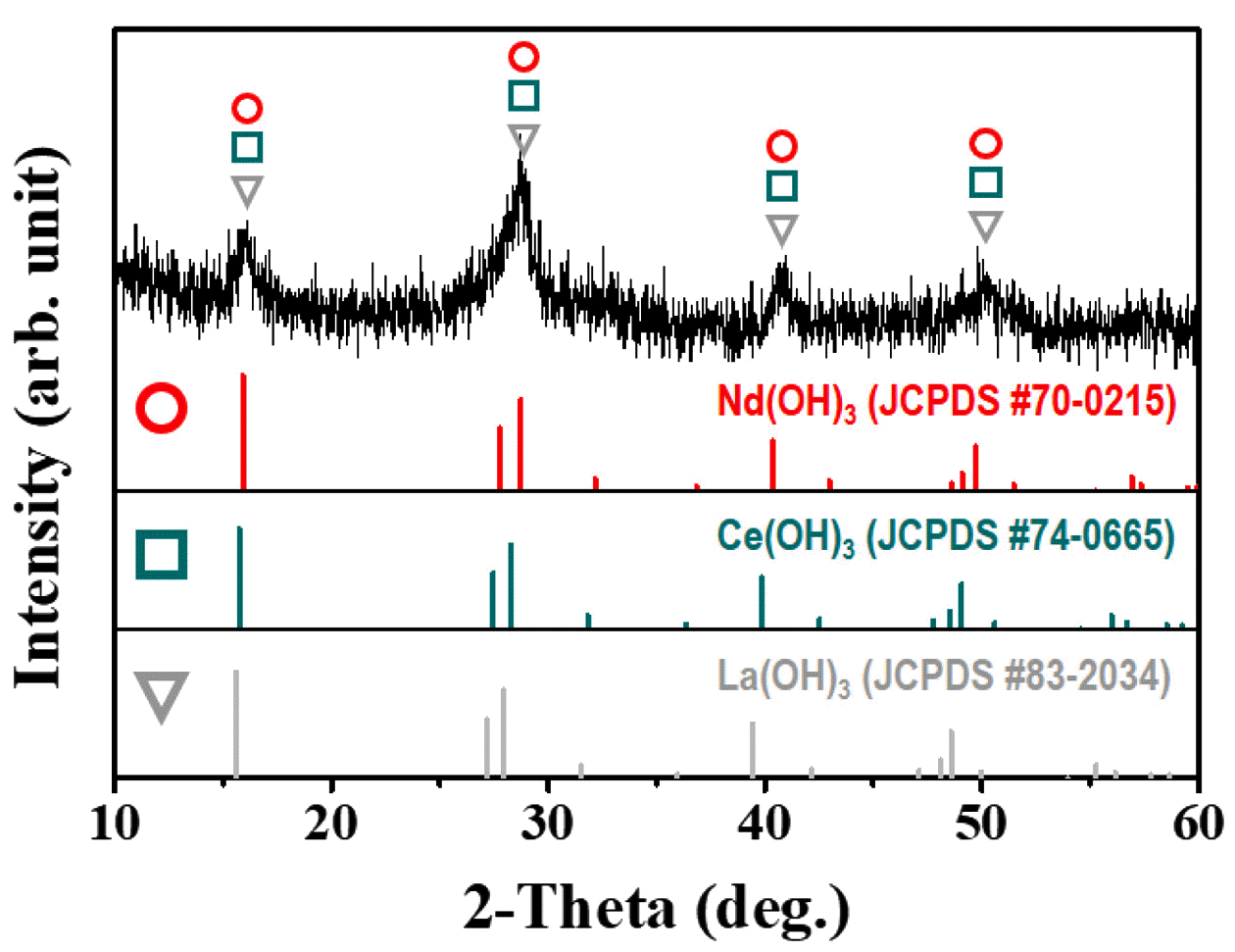
XRD pattern of rare earth hydroxide (RE(OH)3, RE = La, Ce, Nd) caused by metathesis reaction.
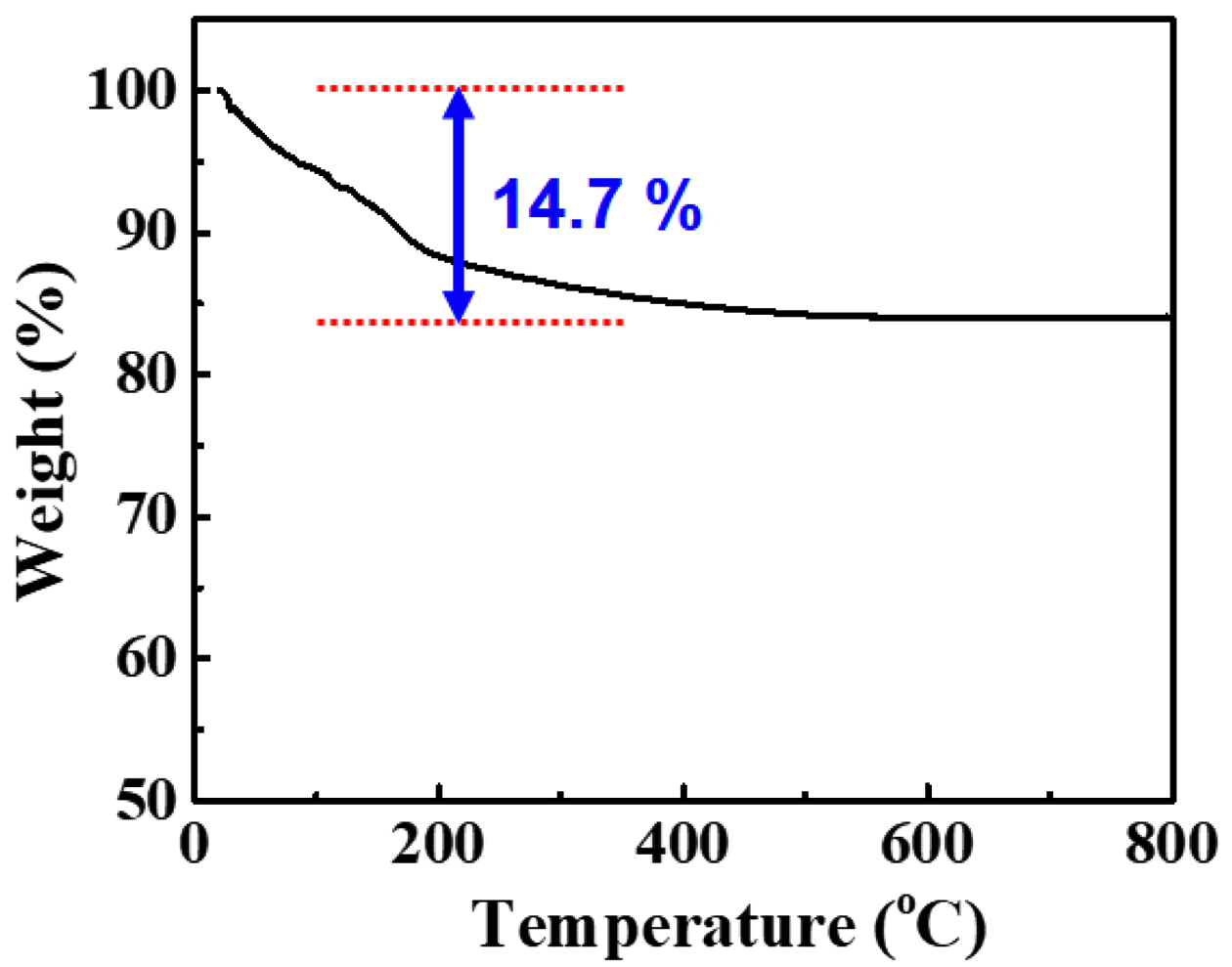
Fig. 7.
TG analysis of rare earth hydroxide (RE(OH)3) powder.
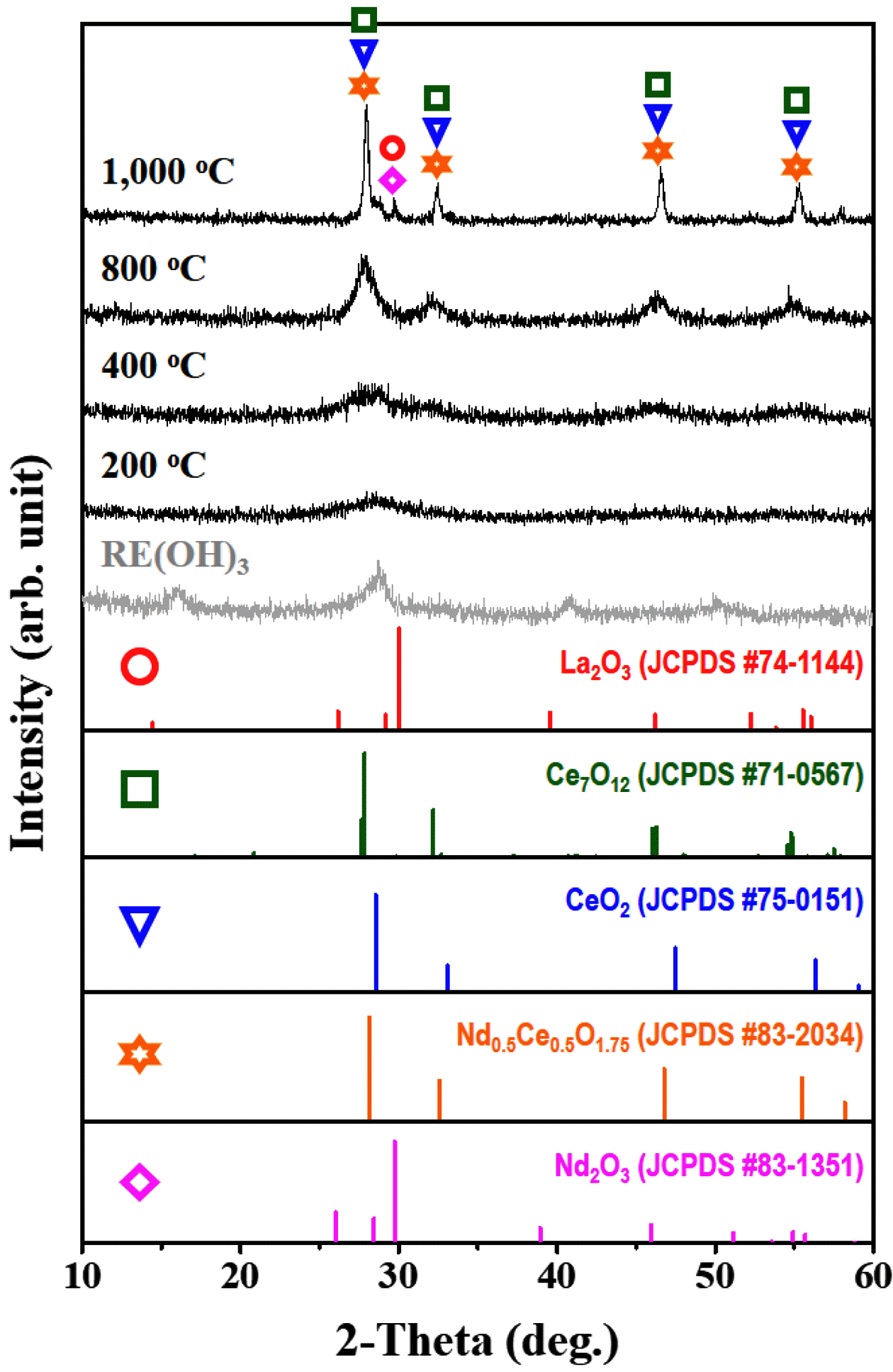
Fig. 8.
XRD patterns of rare earth hydroxide (RE(OH)3) powders with the various heat treatment conditions.
Fig. 1.
Fig. 2.
Fig. 3.
Fig. 4.
Fig. 5.
Fig. 6.
Fig. 7.
Fig. 8.
A Study on the Preparation of Rare Earth Oxide Powder for Rare Earth Precipitates Recovered from Spent Ni-MH Batteries
| # | Components of NaRE(SO4)2·H2O | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Ni | Co | Rare earth elements | Etc. | |||||||||
| La | Ce | Nd | Pr | K | Fe | Al | Zn | Mn | Na | |||
| Weight (%) | 0.1 | 0.0 | 18.3 | 25.6 | 20.6 | 0.4 | 1.1 | 0.5 | 0.0 | 0.1 | 0.0 | 33.3 |
Table 1
Details of components for NaRE(SO4)2·H2O
Table 1
TOP
 KPMI
KPMI


 Cite this Article
Cite this Article








