Articles
- Page Path
- HOME > J Powder Mater > Volume 32(5); 2025 > Article
-
Research Article
돼지 장기 부산물의 분말화 전략: 건조법 및 고분자 첨가제의 영향 비교 연구 - 윤서완1, 정은주2, 신의철2, 김현욱2, 김경수1,*
- Powderization Strategy for Porcine Organ By-Products: A Comparative Study on the Effects of Drying Method and Polymer Additives
- Seo Wan Yun1, Eun Ju Jeong2, Eui-Cheol Shin2, Hyun-Wook Kim2, Kyeong Soo Kim1,*
-
Journal of Powder Materials 2025;32(5):416-427.
DOI: https://doi.org/10.4150/jpm.2025.00269
Published online: October 31, 2025
1경상국립대학교 제약공학과
2경상국립대학교 생명자원과학과
1Department of Pharmaceutical Engineering, Gyeongsang National University, Jinju 52725, Republic of Korea
2Department of GreenBio Science, Gyeongsang National University, Jinju 52725, Republic of Korea
- *Corresponding author: Kyeong Soo Kim Tel: +82-55-772-3391 Fax: +82-55-772-3399 E-mail: soyoyu79@gnu.ac.kr
© The Korean Powder Metallurgy & Materials Institute
This is an Open Access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/4.0/) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
- 466 Views
- 11 Download
Abstract
- This study aimed to develop a powderization strategy using porcine by-products (kidney, liver, and heart) by evaluating the effects of raw material type, pretreatment, and additives (hydroxypropyl methyl cellulose P645 and gelatin) on powder characteristics. Powders from kidney tissue were analyzed for yield, particle structure, compressibility, and size distribution, based on the drying method and additive composition. The spray-dried sample with gelatin at 1:0.5 (w/w) showed 20.4% compressibility and the smallest, most uniform particles, indicating excellent flowability. Due to its superior structural stability, gelatin was selected over HPMC P645. Liver and heart samples that underwent enzymatic hydrolysis and the Maillard reaction were spray-dried with gelatin and assessed for yield and microstructure. The Alcalase-treated liver sample showed the highest yield. Surface analysis confirmed that gelatin formed a protective film enhancing particle stability. These findings suggest gelatin-based spray drying is effective for producing high-quality powders from protein-rich by-products.
- 국내 축산업의 고도화와 함께 육류 생산 과정에서 발생하는 부산물의 자원화 필요성이 꾸준히 제기되고 있다. 돼지의 도축 과정에서 발생하는 내장은 생체중 대비 약 22.9%를 차지한다[1]. 그중 신장, 간, 심장과 같은 적내장 부위는 단백질 함량이 높고 철분과 아연 등의 무기질, 생리활성 펩타이드, 항산화 물질 등을 풍부하게 함유하고 있어 고단백 기능성 원료로서 활용 잠재력이 크다[2]. 그러나 특유의 강한 향취, 낮은 관능적 기호성, 가공 적합성 부족 등으로 인해 실제 산업적 적용에는 여전히 한계가 따른다[3].
- 이러한 문제를 극복하기 위한 전략으로 단백질 가수분해와 마이야르 반응을 접목한 전처리 기술이 제안되고 있다[4]. 효소에 의한 가수분해는 고분자 단백질을 저분자 펩타이드 및 자유 아미노산으로 전환함으로써 소화율을 높이고 기능성 물질 생성을 유도한다[5]. 이와 동시에 마이야르 반응은 환원당과 아미노기의 반응을 통해 풍미 향상, 항산화 활성 증가와 같은 품질 향상 효과가 있는 것으로 알려져 있다[6]. 실제 선행 연구에서는 돼지 적내장에 Alcalase 및 Trypsin을 적용하여 얻은 가수분해물의 항산화 활성을 평가하였으며, 시료 부위 및 효소 종류에 따라 DPPH, ABTS, 히드록실 라디칼 소거능에 유의한 차이를 나타냈다고 보고하였다[7]. 특히 간-Alcalase 처리군에서 높은 가수분해도와 함께 우수한 항산화 활성이 확인되었다. 그러나 이러한 전처리 시료는 단순 액상 형태로는 장기 저장이 어렵고, 수분 함량이 높아 산화 및 미생물 변질에 취약한 단점이 있어 분말 형태로의 가공이 요구된다[8, 9].
- 이를 위해 본 연구에서는 대표적인 용매 증발 방식인 분무건조와 동결건조를 적용하여 돼지 적내장 유래 시료의 안정한 분말화 전략을 탐색하였다. 분무건조 및 동결건조 기술은 서로 다른 둘 이상의 고형 성분을 균질하게 분산된 고체분산체로 가공하는 데 효과적인 기술이다[10, 11]. 특히 분무건조는 열풍을 짧은 시간 동안 적용하여 원료를 미세 분말로 가공할 수 있으며, 입자 크기 및 형상 제어가 용이하여 식품 및 제약 산업에서 널리 활용되고 있다. 다만, 건조 중 열과 수분의 급격한 변화로 인해 입자 간 융합, 표면 불안정성 등의 문제가 발생할 수 있다. 이러한 물리적 한계를 보완하고자 건조 공정 중 고분자 첨가제를 병용함으로써 분말의 구조 안정성과 유동성을 향상시키는 접근이 필요하다[12].
- 분말화 과정의 효율성과 품질을 개선하기 위해 식품첨가물공전에 수재된 다양한 필름 형성 고분자로서 HPC (Hydroxypropyl cellulose), HPMC (Hydroxypropyl methyl cellulose), HPMCP (Hydroxypropyl methyl cellulose phthalate), PEG (Polyethylene glycol) 200~9500, Pectin, PVA (Polyvinyl alcohol), 젤라틴 등을 검토하였다. 특히 HPMC P645는 열 안정성과 점탄성을 갖춘 셀룰로오스계 고분자로, 분무건조 과정에서 입자 표면에 보호막을 형성하고 구조 수축을 억제하는 데 유리하다. 또한 용해도 측면에서 우수하며, 주요 고형 성분을 안정적으로 분산시키는 기능이 보고된 바 있다[13, 14]. 이에 따라 식품첨가물공전에 수재된 다양한 필름 형성 고분자 중 HPMC P645를 선정하여 첨가 비율을 달리하여 실험에 적용하였다. 또한 젤라틴은 뛰어난 피막 형성과 생분해성이 특징인 천연 고분자로, 건조 중 핵심 성분을 코팅하여 항산화 및 항균 안정성을 부여하는 데 효과적이다. 선행 연구에 따르면 젤라틴 기반 마이크로입자가 주요 성분의 보호 및 유동성 향상에 기여한다. 또한 젤라틴은 주요성분 입자를 캡슐화(Encapsulation)하여 항산화 및 항균 특성을 개선하여 주요성분을 보호하는 효과를 가진 것이 보고된 바 있다[15, 16]. 이러한 기능을 바탕으로 본 연구에서도 젤라틴을 다양한 비율로 적용하여 분말화 적합성을 평가하였다.
- 따라서 본 연구는 돼지 적내장을 대상으로 원료 부위, 전처리 조건, 고분자 첨가제 유형에 따른 분말의 표면 구조, 밀도, 입도 분포, 압축도 등 물리화학적 품질 특성 차이를 평가⋅비교하였다. 이를 통해 고단백 반응성 부산물의 안정적인 분말화 가능성을 확인하고, 산업적 응용을 위한 최적 조합 조건을 제시하고자 하였다.
1. Introduction
- 2.1. 시약 및 기기
- 본 연구에 사용된 돼지 신장은 분쇄물의 형태로, 돼지 간 및 심장 유래 가수분해물-마이야르 반응물은 액상 형태로 경상국립대학교 동물생명융합학부(Jinju, Republic of Korea)로부터 제공받아 사용하였다. Hydroxypropyl methyl cellulose (HPMC P645)는 한미약품(Seoul, Republic of Korea)에서 제공받아 사용하였다. 젤라틴은 대정화금(Siheung, Republic of Korea)에서 구매하여 사용하였다. 분말 제조를 위해 분무건조기(ADL311S, Yamato Scientific, Tokyo, Japan) 및 동결건조기(Alpha 1-2 LDplus, Martin Christ, Germany)를 이용하였다. 시료의 전처리를 위한 균질화는 고속 균질기(T25 digital ULTRA-TURRAX, IKA, Germany)를 이용하여 수행하였다. 제조된 분말의 형태 및 표면 특성은 전계방사형 주사전자현미경(FE-SEM, MIRA3, TESCAN, Czech Republic)을 통해 분석하였다. 입자 크기 분석은 레이저 회절 입도 분석기(Mastersizer 3000, Malvern Instruments, UK)를 사용하여 수행하였다. 실험에 사용된 시약은 모두 분석 시약급 이상의 제품을 사용하였다.
- 2.2. 돼지 신장 시료의 분말화
- 분쇄된 돼지 신장 시료는 정제수 40 mL에 일정량을 첨가 후 고속 균질기를 이용하여 11,000 rpm에서 10분간 균질화하였다. 균질화된 시료는 60 mesh 체(250 μm)를 통과시켜 체공보다 큰 입자를 제거하였다. 첨가제로 미리 준비된 합성 고분자인 HPMC P645 용액 또는 천연 유래 고분자인젤라틴 용액 10 mL을 사용하였으며, 균질화된 시료 대비 다양한 비율로 제조 후 투입하고 동시에 교반하였다(Table 1). 건조 공정은 분무건조(SD) 또는 동결건조(FD) 방식으로 수행하였다. 분무건조는 직경 711 μm의 Nozzle을 사용하였고, 주입구 온도 120°C, 배출구 온도 75~78°C, 분무공기 압력 0.1 MPa, 공급 유속 1.5 mL/min, blower 6.5 조건에서 실시하였다. 동결건조는 Ice condenser 온도 –70°C, 진공도(vacuum) 0.12 mbar 조건으로 24시간 동안 진행하였으며, 건조 완료 후 시료는 블렌더로 분쇄하여 분말 형태로 제조하였다. 제조된 각 시료는 건조 공정 방식과 첨가제 종류 및 비율에 따라 KP (Kidney + HPMC P645) 및 KG (Kidney + 젤라틴) 그룹으로 구분하여 관리하였으며, 각 조성 및 수득률은 Table 1에 정리하였다.
- 2.3. 돼지 간 및 심장 가수분해-마이야르 반응물의 분말화
- 효소 가수분해를 거쳐 2.5%(w/v) xylose를 첨가 후 가열 반응을 마친 돼지 간 및 심장 유래 시료를 사용하였다. 젤라틴은 50°C로 가온된 정제수에 용해하여 용액으로 제조하였으며, 액상의 마이야르 반응물 내 예상 고형분 1 g당 1:0.5 (w/w) 비율에 해당하는 젤라틴 용액을 준비하였다. 본 연구에서 Predicted solid content는 배합 단계의 이론 고형분(%)을 의미하며, 액상 마이야르 반응물을 동결건조하여 수분을 제거한 뒤 잔존 고형분을 계량하고, 이를 총 원액으로 나누어 계산하였다. 젤라틴은 제조 용액 농도를 고형분 비율로 적용하였다. 젤라틴 용액을 마이야르 반응물에 첨가한 후 교반하여 균일하게 혼합하였다. 혼합 시료는 섹션 2.2에서 기술한 조건과 동일한 분무건조 공정을 적용하여 분말화하였다. 제조된 시료는 사용된 돼지 적내장 부위와 단백질 가수분해 효소의 종류에 따라 Liver-Alcalase 처리군(MLA), Liver-Trypsin 처리군(MLT), Heart-Alcalase 처리군(MHA), Heart-Trypsin 처리군(MHT)으로 구분하였다(Table 2).
- 2.4. 돼지 적내장 함유 분말의 물리화학적 특성 분석
- 표면 형태학적 특성 – 제조된 분말의 입자 형태 및 표면 구조는 전계방사형 주사전자현미경(FE-SEM)을 사용하여 관찰하였다. 전처리를 위해 시료는 이중 접착탄소 테이프를 이용해 샘플 스터브에 부착 후, 금속 스퍼터 코터(Ion Sputter, EMI Tech)를 이용하여 백금으로 4분간 코팅하였다. 코팅은 7 × 10-3 mbar 압력, 25 mA 전류 및 100% 터보 속도로 수행되었다.
- 밀도 및 압축도 분석 – 제조된 분말의 흐름성과 압축성을 정량적으로 평가하기 위하여 겉보기 밀도(bulk density, ρbulk) 및 탭 밀도(tapped density, ρtapped)를 측정하였다. 각 시료 5 g을 플라스틱 메스실린더에 자연스럽게 흘려 넣어 충전한 후 부피를 측정하여 겉보기 밀도를 확인하였다. 이어서 동일한 높이에서 500회 반복 낙하를 통해 메스실린더 내 분말의 용적이 거의 일정하게 될 때까지 다짐(tapping)한 후 최종 부피를 측정하여 탭 밀도를 확인하였다. 이를 바탕으로 다음의 Carr’s compressibility index (CI, %)와 Hausner ratio(HR)를 다음과 같이 계산하였다:
- Carr’s index 및 Hausner ratio는 분말의 압축성 및 흐름성 지표로 활용되며, 일반적으로 CI 수치가 낮고, HR이 1에 가까울수록 분말의 흐름성이 양호한 것으로 해석한다[17, 18].
- 입도분포 분석 – 입자 크기 분석은 레이저 회절 기반 입도 분석기를 이용하여 수행하였다. 분석은 건식 분산 방식으로 진행되었으며, 시료는 분산 공기 압력 1.5 bar, 공급 속도 50%, 호퍼 간격 1.5 mm의 조건에서 측정되었다. 입도 분포 결과는 누적 기준 입자 크기인 D10, D50, D90 값으로 나타내었으며, 각각 전체 입자의 10%, 50%, 90%가 해당 크기 이하에 존재함을 의미한다[19].
2. Experimental
- 3.1. 돼지 신장 함유 분말의 제조 및 물리화학적 특성 평가
- 돼지 적내장은 식육 부산물 중에서도 저렴한 가격과 높은 단백질 함량을 바탕으로 기능성 식품 및 사료 소재로의 활용 가능성이 제시되고 있다. 그 중 신장은 필수 아미노산, 철분, 단백질이 풍부한 조직으로 알려져 있다. 이러한 특성으로 인해 최근에는 가수분해, 마이야르 반응 등 생물학적 전처리를 통해 기능성 펩타이드나 항산화 성분을 유도 및 강화하려는 시도가 활발히 진행되고 있다[2, 4]. 그러나 실질적인 산업 적용에서는 복잡한 전처리 이전에 적내장 원물 상태에서의 물리적 가공성과 분말화 적합성 평가가 우선되어야 할 필요가 있다. 특히 건조 및 고분자 첨가 조건만으로도 향미 개선, 수분 안정성 확보, 입도 조절 등의 이점을 기대할 수 있기에 본 연구에서는 신장 조직 자체를 단순 절단 및 분쇄한 시료를 사용하였고, 다양한 고분자 첨가제와 건조 방식을 적용하여 분말을 제조하였다. 분말의 수득률, 표면 형상, 흐름성 및 입도 특성을 평가하였으며, 이를 바탕으로 향후 기능성 강화를 위해 전처리된 돼지 적내장 소재(섹션 3.2)의 물리적 초기 가공 단계의 최적화 가능성을 확인하고자 하였다.
- 건조 공정의 수득률은 분말 제조의 경제성과 직결되며, 원료의 고형분 함량, 점도, 건조 방식 및 첨가제의 종류에 따라 크게 영향을 받는다. 본 연구에서 제조된 돼지 신장 기반 시료의 수득률은 건조 방식에 따라 유의한 차이를 보였다(Table 1). 동결건조(FD) 시료는 평균 90.2%의 높은 수득률을 기록한 반면, 분무건조(SD) 시료는 43.8~56.1% 수준으로 다소 낮은 수득률을 나타냈다. 특히 고분자 미첨가 상태에서 분무건조한 시료(SD-K)는 36.2%로 가장 낮은 수득률을 보였다(Fig. 1). 이러한 차이는 공정 특성에서 기인한 것으로 판단된다. 동결건조는 시료를 영하의 조건에서 건조시키기 때문에 고형분의 열적 변성이 없고, 기기 내 부착으로 인한 손실이 거의 없어 건조물 대부분을 회수할 수 있다. 반면, 분무건조는 고온 상태에서 액상 시료를 미립화하여 급속 건조시키는 방식으로, 열에 의한 점착, 노즐 막힘, 건조 챔버 내 벽면 부착 등에 따른 손실이 불가피하다. 또한 고분자 첨가제의 비율이 높아질수록 수득률이 증가하는 경향이 확인되었다. 이는 고분자 첨가제가 분말화 효율을 개선하는 데 기여할 수 있음을 시사한다[12]. 제조된 돼지 신장 분말의 외관을 관찰한 결과, 고분자 미첨가 상태에서 분무건조된 시료(SD-K)는 Fig. 1에서 확인되듯 밝은 갈색을 띠는 미세 분말 형태를 나타냈으며, 일부 색소의 열분해와 수분 급속 증발에 의한 탈색 현상으로 관찰되었다. 이와 달리 동결건조 시료(FD-K)는 선홍색 또는 적갈색을 유지하였으며, 원료의 생육 색상이 보존되는 경향을 보였다. 한편 Fig. 2와 같이 고분자 첨가에 따른 분말 색상의 변화가 관찰되었다. 일반적으로 첨가제의 종류 및 함량이 증가할수록 분말의 색상은 상대적으로 옅어지는 경향을 나타냈으며, 이는 고분자 물질이 원료 내 색소 성분을 희석시키는 데 기인한 것으로 판단된다[20, 21]. 특히 신장 원료 대비 동일한 양의 젤라틴을 첨가한 시료는 고분자 미첨가 시료(SD-K)에 비해 명확히 밝은 갈색 계열을 나타냈다. 이러한 경향은 선행 문헌에서도 유사하게 보고된 바 있다. Ferrari, C. C. et al. (2005)은 블랙베리 분말의 분무건조 공정에서 말토덱스트린의 농도가 증가할수록 분말의 밝기(L*) 값이 유의하게 증가하며, 이를 색소의 상대 농도 감소로 인한 색상 희석 효과로 해석하였다[20]. Sarabandi, K. H. et al. (2019) 또한 사과 주스 농축액의 분무건조 시 담체 농도에 비례하여 L* 값이 증가하는 뚜렷한 경향을 보고하였다[21]. 본 연구에서 관찰된 고분자 함량 증가에 따른 색상 변화 역시 이와 일치하며, 첨가제 조성이 분말의 색도 및 시각적 기호성에 영향을 미칠 수 있음을 시사한다. 또한 향미 측면에서 분무건조(SD) 시료는 비린내 및 내장 특유의 이취가 완화된 반면, 동결건조(FD) 시료에서는 이취가 상대적으로 더 많이 잔존하는 것이 관능적으로 확인되었다. 이는 분무건조 공정에서 Amine류, Aldehyde류 등 휘발성 저분자 화합물이 열에 의해 일부 제거되었기 때문으로 해석된다. 유사한 경향은 Xin, X. et al. (2022)의 연구에서도 확인되었으며, 이들은 분무건조 과정 중 일부 휘발성 향미 성분의 손실이 발생하며 최종 분말의 향 특성에 영향을 줄 수 있음을 보고하였다[22].
- 분말의 입자 형상 및 표면 구조는 분산성, 용해도, 흐름성 등 물리적 특성과 밀접하게 관련되며, 제조 공정 및 첨가제 조성에 따라 큰 차이를 보일 수 있다. 이에 따라 본 연구에서는 건조 방식과 고분자 첨가 여부에 따른 표면 형태학적 변화를 FE-SEM을 통해 관찰하였다. Fig. 3과 같이 고분자 미첨가 시료의 경우 FD-K는 수분 제거 과정에서 형성된 얼음 결정의 영향으로 다공성의 덩어리형 입자가 응집된 형태를 보였으며, 섬유질 조직이 일부 노출되어 있었다. 반면, SD-K는 대부분 약 10 μm의 미세 입자로 구성되었으며, 전체적으로 구형에 가까운 형상을 보였으나, 표면은 매끄럽지 않고 수축 자국과 주름이 관찰되었다. 이러한 표면 구조는 급속한 수분 증발로 인해 입자 표면이 먼저 경화되며 내부와의 수축률 차이로 인해 형성되는 전형적인 분무건조 입자의 특성으로, Sugiyama, Y. et al. (2006)의 보고와도 일치한다[23]. 한편, Fig. 4A의 결과에서 고분자 첨가 시료는 무첨가군에 비해 입자 크기가 더 균일하였으며, 첨가제의 종류와 비율에 따라 표면 구조 및 입자 간 집합 양상에서 차이를 보였다. 젤라틴 첨가군은 함량에 따른 차이 없이 비교적 균일한 입자 크기와 수축 완화된 외형을 보였으며, 이는 건조 중 형성된 피막이 입자의 구조적 안정성 및 형태 보존에 기여한 것으로 해석된다. El Amine, K. M. et al. (2022)은 젤라틴 기반 입자를 분무건조할 경우, 그 친수성 및 필름 형성 특성으로 인해 입자 간 응집을 억제하고 경계가 명확한 안정적인 입자 구조가 형성된다고 보고한 바 있다[24]. 이러한 결과는 향후 분말화가 요구되는 고단백 반응성 소재에 적용 가능성을 제시하며, 고분자 조성을 통한 미세구조 제어가 기능성 분말 설계에 유효한 전략이 될 수 있음을 보여준다. 반면, HPMC P645를 1:1 (w/w)로 첨가한 시료(SD-KP-1)에서는 입자 간 경계가 불분명하고 다층 구조 또는 응집체 형태가 형성되는 양상이 확인되었으며, 이는 입자의 개별성 및 분산성 측면에서 불리하게 작용할 수 있다. Boel, E. et al. (2020)은 고분자 농도가 높을수록 수분의 표면 확산이 지연되어 초기 외피 형성이 늦어지고, 이로 인해 입자 간 융합 또는 응집이 발생할 수 있음을 보고한 바 있다[25]. 또한 동결건조된 시료(Fig. 4B)의 경우 급속한 수분 승화로 인해 조직 내 수분이 제거되면서 판상 구조의 입자가 형성되었으며, 전체적으로 200 μm 이상의 균일하지 않은 크기 분포를 나타내었다. 특히 동일한 첨가제의 함량 조건에도 젤라틴 첨가군에 비해 HPMC P645첨가군은 원료 조직 표면이 그대로 노출되는 등 코팅 효과가 제한적으로 나타났다. 이는 구조 보호를 위한 피막 형성에는 일정 수준 이상의 고분자 함량이 요구됨을 시사한다. 이러한 결과는 고분자 조성에 따라 분말의 미세구조와 물리적 품질에 영향을 줄 수 있음을 보여주며, 돼지 적내장 소재의 가공 설계에 있어 젤라틴과 같은 첨가제의 선택이 입자 안정성과 제조 효율성을 고려한 전략으로 작용할 수 있음을 시사한다.
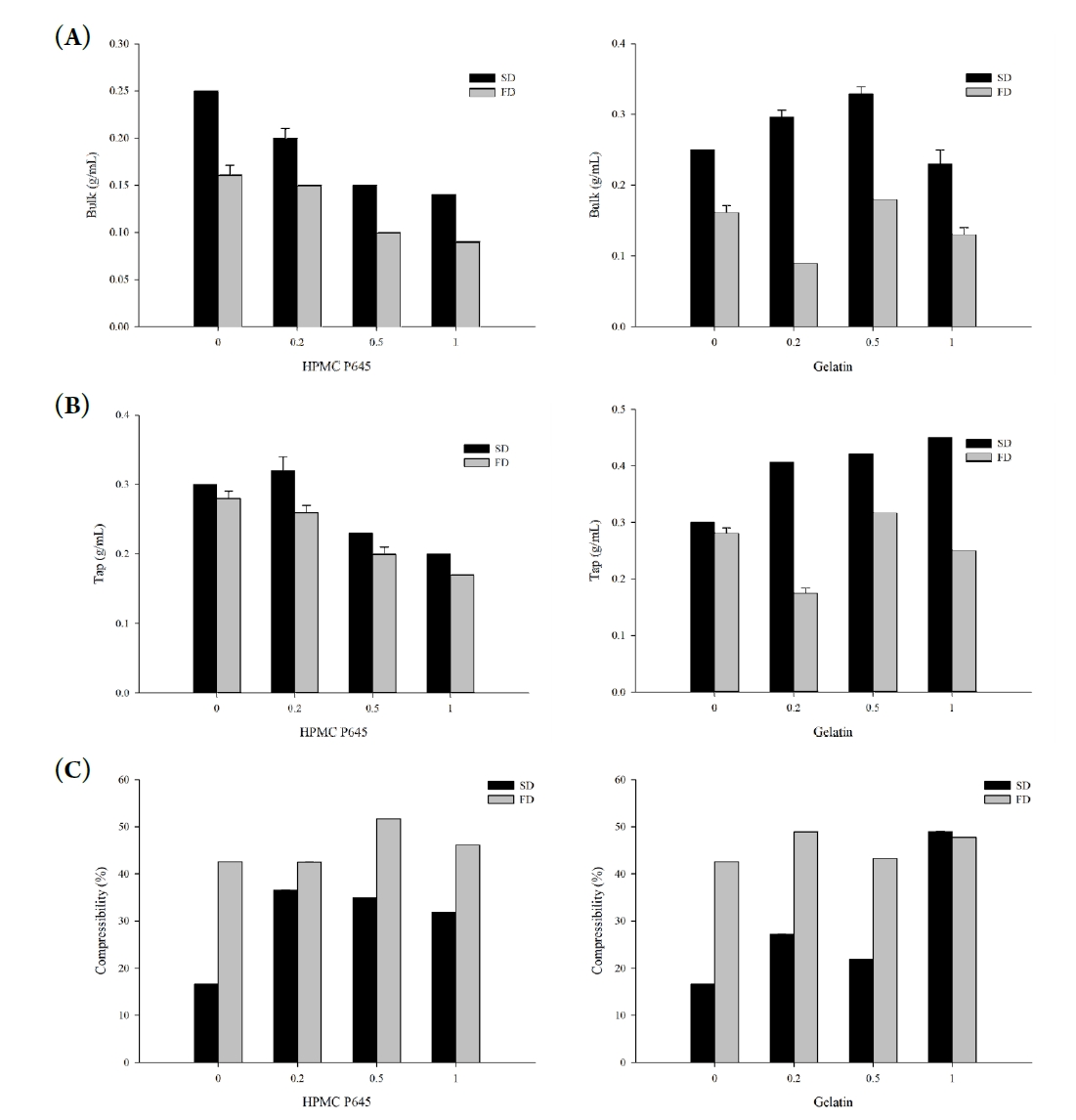
- 분말의 충전 밀도 및 압축도는 제조 공정과 첨가제 조성에 따라 크게 달라지며, 이는 정제화나 캡슐 충진과 같은 후속 제형화 과정에서 중요한 유동성 및 가공성 지표로 활용된다. 본 연구에서는 각 시료에 대해 겉보기 밀도(bulk density)와 탭 밀도(tapped density)를 측정하고, 이를 바탕으로 Carr’s compressibility index (CI, %) 및 Hausner ratio (HR)를 산출하여 압축성 및 흐름성을 평가하였다(Fig. 5). CI는 값이 낮을수록 흐름성이 우수하며, 일반적으로 10% 이하를 ‘Excellent’, 11~15%를 ‘Good’, 16~20%를 ‘Fair’, 21~25%는 ‘Possible’, 26% 이상은 ‘Poor’, ‘Very very Poor’로 분류된다[17, 18]. 더불어 HR은 1에 근접할수록 흐름성이 양호하다고 해석한다. 동결건조 시료의 HR은 1.7~2.0을 나타내며, CI는 대체로 40~50% 수준으로 'Very very poor' 등급에 해당하였으며, 이는 부피 대비 가벼운 질량과 높은 내부 공극률에 기인한 것으로 판단된다. 반면, 분무건조 시료는 비교적 낮은 HR (1.2~1.6) 및 압축도(16~50%)를 나타냈으며, 특히 고분자를 첨가하지 않은 SD-K 시료는 HR 1.2 및 CI 16.7%로 'Fair' 수준의 흐름성을 보였다. 이는 입자 간 간섭이 적고 고형분이 농축되어 밀집된 형태로 건조된 결과로 해석된다. 젤라틴 또는 HPMC P645를 첨가한 경우, 첨가제의 종류와 비율에 따라 압축도와 흐름성에 차이를 보였다. SD-KG-0.5는 HR 1.3 및 21.9%의 압축도를 나타내며 상대적으로 우수한 흐름성을 보였고, 이는 고형분 구조가 상대적으로 조밀하면서도 표면 응집이 억제된 결과로 해석된다. 이와 같은 물성은 분말을 사료첨가제나 건강기능성 소재로 활용할 때, 다른 성분과의 혼합성 및 가공 적응성을 높이는 데 유리하게 작용할 수 있다. 이러한 결과는 건조 방식과 고분자 조성에 따라 분말의 물리적 밀집성 및 압축 가능성이 크게 달라질 수 있음을 보여주며, 이는 분말형 기능성 소재의 설계 시 중요한 고려 요소로 작용할 수 있다.
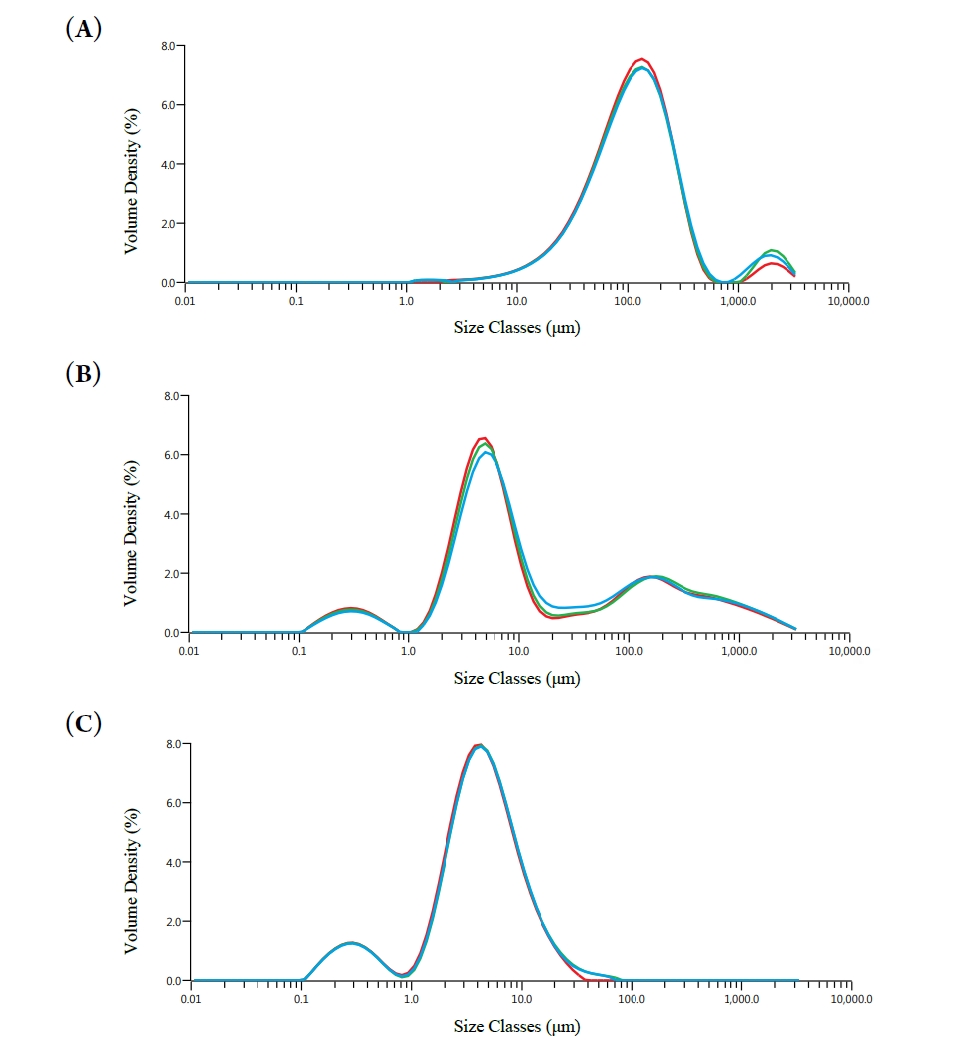
- 입도분포는 분말의 유동성, 혼합 균질성, 용해도 등과 밀접한 관련이 있으며, 품질 안정성과 가공 적응성에 직접적인 영향을 미친다. 따라서 건조 방식 및 고분자 첨가 여부에 따른 입도 특성을 레이저 회절 기반 입도분석기를 통해 평가하였다. 분석 결과는 누적 입도 지표(D10, D50, D90) 및 Span, Uniformity, SSA(Specific Surface Area) 등의 지표로 정리하였다(Fig. 6) [19]. FD-K 시료는 D50이 113.7 ± 2.1 μm, D90이 310.0 ± 18.7 μm로 가장 큰 입자 크기를 나타냈으며, Span은 2.3, Uniformity는 1.2로 비교적 균일한 분포를 보였다. 이는 수분 승화 후 파편화된 구조가 비교적 일정하게 분쇄된 결과로 해석된다. 반면, SD-K 시료의 경우 D50은 7.5 ± 0.8 μm, D90은 508.3 ± 94.7 μm로 측정되었고, Span은 67.3, Uniformity는 21.9로 매우 불균일한 분포를 나타내었다. 이는 급속한 탈수로 인한 수축 및 응집으로 입자 간 크기 편차가 커진 결과로 판단된다. 가장 우수한 입도 특성은 젤라틴을 1:0.5(w/w)로 첨가한 SD-KG-0.5 시료에서 확인되었으며, D50은 4.2 ± 0.1 μm, D90은 11.7 ± 0.4 μm로 가장 작고 균일한 입자 크기를 보였다. 이 시료는 Span이 2.6, Uniformity가 0.8로 세 시료 중 가장 우수한 분포 균일성을 나타냈으며, SSA 또한 3829 m²/kg으로 가장 넓은 표면적을 갖는 입자 구조를 형성하였다. 이는 젤라틴이 건조 중 피막을 형성해 입자 간 융합을 억제하고 분산 안정성을 높인 결과로 해석된다. 이는 향후 분말 기반 제형의 유동성 및 가공성 측면에서 유리하게 작용할 수 있기에, 본 연구에서는 분무건조-젤라틴 첨가 공정을 분말화 전략으로 활용하였으며, 이는 돼지 간 및 심장 유래 마이야르 반응물에도 동일하게 적용하였다.
- 3.2. 돼지 간 및 심장 가수분해-마이야르 반응물 함유 분말의 제조 및 물리화학적 특성 평가
- 돼지 적내장은 철분, 생리활성 펩타이드, 항산화 성분이 풍부한 고단백 소재로 기능성 식품 및 사료 원료로서의 활용 가능성이 높다. 최근 Hwang, J. et al. (2025)은 Alcalase 및 Trypsin으로 가수분해한 간, 심장, 위 등 돼지 적내장 시료의 항산화 활성을 비교한 결과, 조직 및 효소 종류에 따라 DPPH, ABTS, 히드록실 라디칼 소거 활성에 유의한 차이가 나타났다고 보고하였다[7]. 이러한 결과는 적내장 유래 단백질 소재의 기능성 원료로서의 가능성을 뒷받침한다. 본 연구에서는 해당 기관으로부터 제공받은 마이야르 반응물 시료를 기반으로 젤라틴을 첨가한 분무건조 공정을 적용하여 기능성 분말을 제조하였다. 이를 통해 간 및 심장 마이야르 반응물의 분말화 적합성을 평가하고, 고단백 반응성 부산물에 대한 산업적 가공 전략으로의 활용 가능성을 검토하고자 하였다.
- Table 2에 제시된 바와 같이 마이야르 반응물 시료는 특히 단백질 가수분해 효소의 종류에 따라 분무건조 수득률에서 뚜렷한 차이를 보였다. 간 시료의 경우 Alcalase 처리군(SD-MLA)의 수득률은 74.7%로 가장 높은 값을 나타냈고, Trypsin 처리군(SD-MLT)는 58.7%로 확인되었다. 반면, 심장 시료에서는 Trypsin 처리군(SD-MHT)이 72.0%로 Alcalase 처리군(SD-MHA, 53.3%)보다 유의하게 높았다. 이는 동일한 건조 조건에서도 조직 및 효소 간 상호작용에 따라 점도, 분산 안정성, 건조 효율 등이 달라질 수 있음을 시사한다. 특히 Alcalase는 간 조직에서의 가수분해 효율이 더 우수하다고 보고된 바 있으며, 실제로 Wang, Z. et al. (2023)은 Alcalase가 Trypsin보다 돼지 간의 효소 분해에 더 적합하다고 평가하였다[26]. 이러한 결과는 원료 특성과 효소 조합이 수득률과 가공 효율에 큰 영향을 줄 수 있음을 보여준다. 또한 첨가제를 사용하지 않고 마이야르 반응물만을 분무건조 시 분말을 수득하지 못했으나, 젤라틴을 혼입한 경우 모든 시료에서 분말 수득률이 향상되는 경향을 확인하였다. 이는 젤라틴이 건조 중 피막 형성을 유도하며 점착 및 열 변성에 의한 손실을 완화함으로써 분말 회수율 개선에 기여한 결과로 해석된다.
- Fig. 7A와 같이 액상의 각 마이야르 반응물은 효소 종류와 관계없이 간 시료(MLA, MLT)가 심장 시료(MHA, MHT)보다 더 진한 갈색을 나타냈다. 반면, 분무건조를 거친 분말 상태에서는 적내장 부위와 관계없이 Alcalase 처리군(SD-MLA, SD-MHA)이 Trypsin 처리군(SD-MLT, SD-MHT)보다 더 진한 갈색을 보였다(Fig. 7B). 이는 고형분 조성의 차이뿐만 아니라 분무건조 중의 열적 처리 및 수분 증발 과정에서 Alcalase 처리군 내 풍부한 저분자 펩타이드와 유리 아미노산이 추가적으로 농축되면서 색소 밀도가 증가한 결과로 사료된다[27, 28]. 특히 Alcalase는 높은 가수분해 효율을 바탕으로 마이야르 반응의 전구체 생성을 촉진하는 것으로 보고된 바 있으며, 이로 인해 건조 중 갈변 반응이 더 활발히 진행되었을 가능성이 있다[7]. 또한 향취 측면에서 모든 분무건조 시료는 돼지 적내장 특유의 비린내 및 이취가 완화되었으며, 건조 중 휘발성 저분자 성분의 일부가 제거된 것으로 판단된다.
- FE-SEM 관찰 결과, 분말 시료는 입자 간 응집 양상과 표면 코팅 특성에서 원료 부위에 따라 상이하게 나타났다(Fig. 8). 간 유래 시료(SD-MLA, SD-MLT)의 경우 주요 고형 성분이 젤라틴에 의해 외부에서 코팅된 형태로 관찰되었으며, 표면이 두껍고 응집이 뚜렷한 구조를 보였다. 반면, 심장 유래 시료(SD-MHA, SD-MHT)는 고형 성분이 젤라틴과 함께 내부에서 먼저 응집된 후 외피가 형성된 구조로 관찰되었으며, 표면은 비교적 조밀하지 않고 입자 경계가 산란된 형태를 보였다. 이러한 구조적 차이는 원료 부위의 단백질 조성 및 분산 상태에 따라 건조 중 젤라틴과의 상호작용 방식이 달라졌기 때문으로 해석된다. 특히 간 가수분해–마이야르 반응물 유래 시료는 상대적으로 균일한 코팅층이 형성되어 입자 간 경계 안정성과 구조 보존성 측면에서 유리하게 작용할 것으로 판단된다.
3. Results and discussion
- 본 연구에서는 돼지 적내장 유래 부산물의 기능성 분말화를 위한 전략으로 원료 부위(신장, 간, 심장), 전처리 조건(가수분해–마이야르 반응 유무), 첨가제 유형(HPMC P645, 젤라틴)에 따른 분말 특성을 비교•평가하였다. 전처리 없이 절단한 신장 시료에 대해 분무건조 및 동결건조를 적용한 결과, 젤라틴을 1:0.5 (w/w) 비율로 첨가한 분무건조 시료(SD-KG-0.5)는 낮은 압축도(20.4%)와 작고 균일한 입도분포를 나타내었으며, 유동성과 가공 적합성 측면에서 가장 우수한 결과를 보였다. HPMC P645도 첨가제로 검토되었으나, 미세구조 안정성 및 분산성 측면에서 젤라틴이 더 유리한 특성을 보여 최종 공정에 채택되었다. 이후 가수분해 및 마이야르 반응을 거친 간 및 심장 시료를 활용하여 젤라틴을 혼합한 분무건조 공정을 통해 최종 분말을 제조하였다. 이 중 SD-MLA는 수득률 74.7%로 가장 높은 제조 효율을 나타냈다. 또한 FE-SEM 관찰 결과, 간 시료는 고형 성분이 외부에서 피막화된 안정적인 구조로 관찰되었으며, 이는 젤라틴의 코팅 효과에 기인한 것으로 해석된다. 젤라틴은 건조 중 입자 간 융합을 억제하고, 표면에 피막을 형성함으로써 분산성과 구조 안정성을 향상시키는 데 기여하였다. 특히 형성한 피막은 입자 간 상호작용을 완화시켜 유동성을 개선할 뿐만 아니라, 수분 흡수 및 산화로부터의 보호를 통해 보존성 향상에도 긍정적인 영향을 미칠 수 있을 것으로 판단된다. 결론적으로 젤라틴 기반 분무건조 공정을 활용한 본 연구는 돼지 적내장 유래 고단백 부산물의 분말 물성 향상과 시료 간 가공 적합성 비교에 유효한 실험적 기반을 제공하였다. 해당 공정은 기능성 식품, 건강보조제, 반려동물 사료 분야 등 다양한 응용 분야에서의 실용적 활용 가능성을 제시하였다. 상용화 관점에서 분무건조의 스케일업 가능성, 가속•장기 저장안정성 및 유동•타정성 등의 기능성 검증이 요구된다. 또한 정제 등 목표에 부합하는 제형을 제작하여 공정 적합성 및 배치 간 일관성 확인이 이루어질 때, 산업적 확장성 및 제품화 타당성을 입증하는 근거가 될 것이다.
4. Conclusion
-
Funding
This work was carried out with the support of “Research Program for Agriculture Science and Technology Development (Project No. RS-2023-00231446)” Rural Development Administration, Republic of Korea.
-
Conflict of Interest
The authors declare that they have no competing financial interests or personal relationships that may have influenced the work reported in this paper.
-
Data Availability Statement
The original contributions presented in this study are included in the article. Further inquiries can be directed to the corresponding author(s).
-
Author Information and Contribution
Seo Wan Yun: Master of Science; conceptualization, methodology, writing–original draft
Eun Ju Jeong: Professor; writing–review & editing
Eui-Cheol Shin: Professor; writing–review & editing
Hyun-Wook Kim: Professor;writing–review & editing, material support
Kyeong Soo Kim: Professor; project administration, funding acquisition, writing–review & editing, supervision
-
Acknowledgments
None.
Article information





| Formulation | MLA | MLT | MHA | MHT | |
|---|---|---|---|---|---|
| Predicted solid content of Maillard product solution (g) | 1 | 1 | 1 | 1 | |
| Gelatin (g) | 0.5 | 0.5 | 0.5 | 0.5 | |
| Water (g) | (8) | (8) | (8) | (8) | |
| Yield (%) | SD | 74.7 | 58.7 | 53.3 | 72.0 |
- 1. P. N. Seong, K. M. Park, S. H. Cho, S. M. Kang, G. H. Kang, B. Y. Park, S. S. Moon and H. Van Ba: Korean J. Food Sci. Anim. Resour., 34 (2014) 297.Article
- 2. Y. Zou, F. Shahidi, H. Shi, J. Wang, Y. Huang, W. Xu and D. Wang: Trends Food Sci. Technol., 110 (2021) 432.Article
- 3. F. Toldrá, M.-C. Aristoy, L. Mora and M. Reig: Meat Sci., 92 (2012) 290.Article
- 4. Y. Fu, Y. Zhang, O. P. Soladoye and R. E. Aluko: Crit. Rev. Food Sci. Nutr., 60 (2020) 3429.Article
- 5. S. R. Ramakrishnan, C.-R. Jeong, J.-W. Park, S.-S. Cho and S.-J. Kim: Heliyon, 9 (2023).
- 6. Y. Tang, Y. Huang, M. Li, W. Zhu, W. Zhang, S. Luo, Y. Zhang, J. Ma and Y. Jiang: Food Res. Int., 195 (2024) 114984.Article
- 7. J. Hwang, W.-Y. Son, E. J. Jeong, K.-S. Kim, E.-C. Shin, D.-H. Song, K.-W. Lee and H.-W. Kim: Appl. Sci., 15 (2024) 47.Article
- 8. Q. Rao, A. Klaassen Kamdar and T. P. Labuza: Crit. Rev. Food Sci. Nutr., 56 (2016) 1169.Article
- 9. C. Liu, L. Kong, P. Yu, R. Wen, X. Yu, X. Xu and X. Peng: Foods, 11 (2022) 2133.Article
- 10. T. T. T. Nguyen, T. V. A. Le, N. N. Dang, D. C. Nguyen, P. T. N. Nguyen, T. T. Tran, Q. V. Nguyen, L. G. Bach and D. T. N. Pham: J. Food Qual., 2021 (2021) 5525879.Article
- 11. L. Garcia-Amezquita, J. Welti-Chanes, F. Vergara-Balderas and D. Bermúdez-Aguirre: Encyclopedia of Food and Health., (2016) 104.Article
- 12. J. Lee, F. Taip and Z. Abdullah: Food Res., 2 (2018) 486.Article
- 13. J. H. Lee, M. J. Kim, H. Yoon, C. R. Shim, H. A. Ko, S. A. Cho, D. Lee and G. Khang: J. Pharm. Investig., 43 (2013) 205.ArticlePDF
- 14. Y. Wang, Y. Xie, D. Xu, X. Lin, Y. Feng and Y. Hong: Dry. Technol., 32 (2014) 557.Article
- 15. J. Gómez-Estaca, M. Balaguer, G. López-Carballo, R. Gavara and P. Hernández-Muñoz: Food Hydrocolloids, 70 (2017) 313.Article
- 16. A. M. Yousaf, D. W. Kim, J. K. Kim, J. O. Kim, C. S. Yong and H.-G. Choi: Powder Technol., 275 (2015) 257.Article
- 17. R. B. Shah, M. A. Tawakkul and M. A. Khan: AAPS PharmSciTech, 9 (2008) 250.ArticlePDF
- 18. A. Moghbel and H. Abbaspour: Iran. J. Pharm. Res., 12 (2013) 231.
- 19. M.-J. Choi, M.R. Woo, H.-G. Choi and S. G. Jin: Int. J. Mol. Sci., 23 (2022) 9491.Article
- 20. C. C. Ferrari, S. P. M. Germer and J. M. de Aguirre: Dry. Technol., 30 (2012) 154.Article
- 21. K. Sarabandi, S. Peighambardoust, A. Sadeghi Mahoonak and S. Samaei: J. Food Sci. Technol., 55 (2018) 3098.ArticlePDF
- 22. X. Xin, S. Essien, K. Dell, M. W. Woo and S. Baroutian: Food Bioprocess Technol., 15 (2022) 785.ArticlePDF
- 23. Y. Sugiyama, R. J. Larsen, J.-W. Kim and D. A. Weitz: Langmuir, 22 (2006) 6024.Article
- 24. K.M. El Amine: Food Raw Mater., 10 (2022) 252.
- 25. E. Boel, R. Koekoekx, S. Dedroog, I. Babkin, M. R. Vetrano, C. Clasen and G. Van den Mooter: Pharmaceutics, 12 (2020) 625.Article
- 26. Z. Wang, L. Xing, J. Cai, F. Toldrá, Y. Hao and W. Zhang: Food Biosci., 55 (2023) 103036.Article
- 27. Z. Zhou and T. Langrish: J. Food Eng., 305 (2021) 110615.Article
- 28. Z. Zhou and T. Langrish: J. Food Process Eng., 45 (2022) e13936.Article
References
Figure & Data
References
Citations





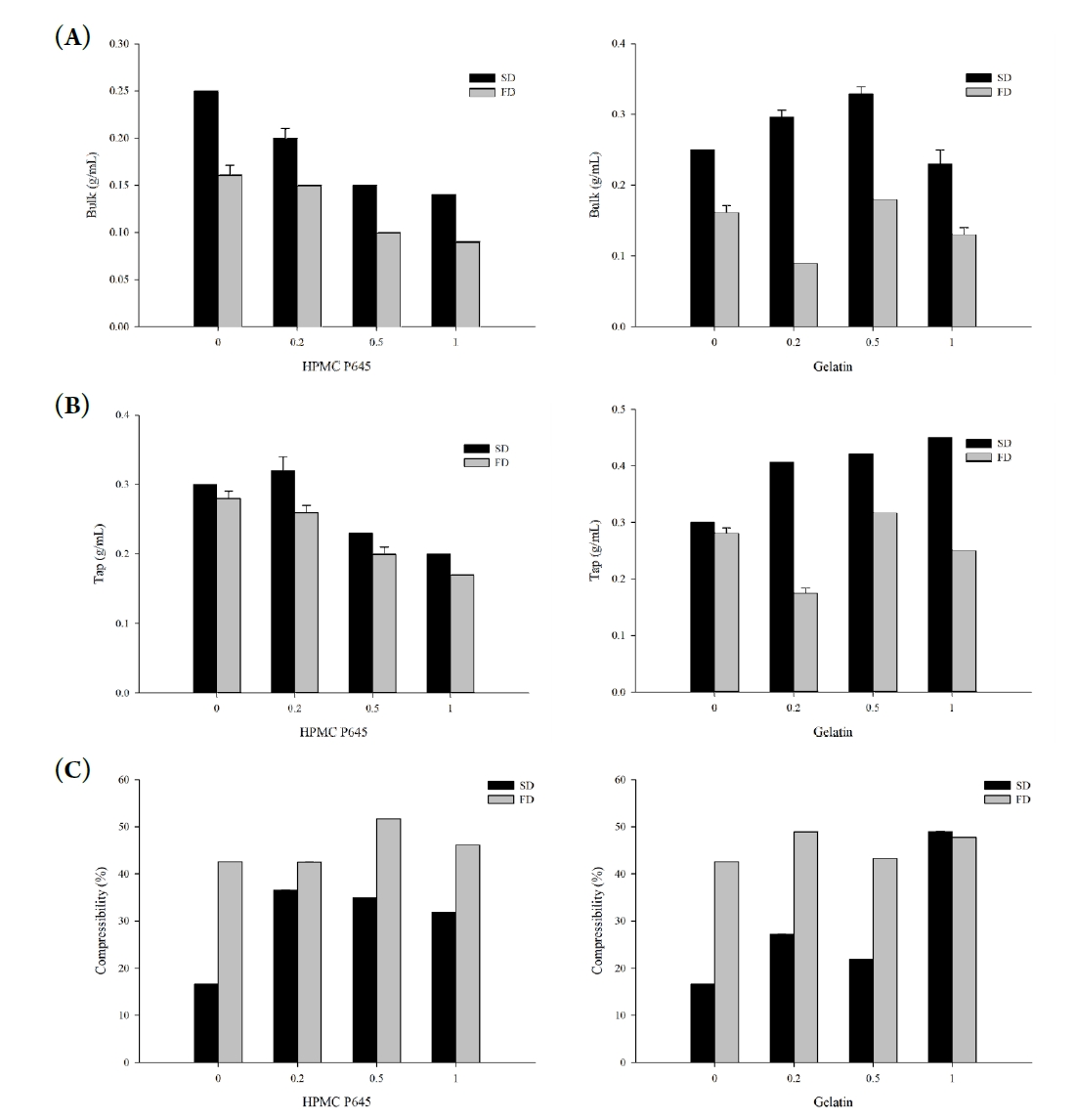
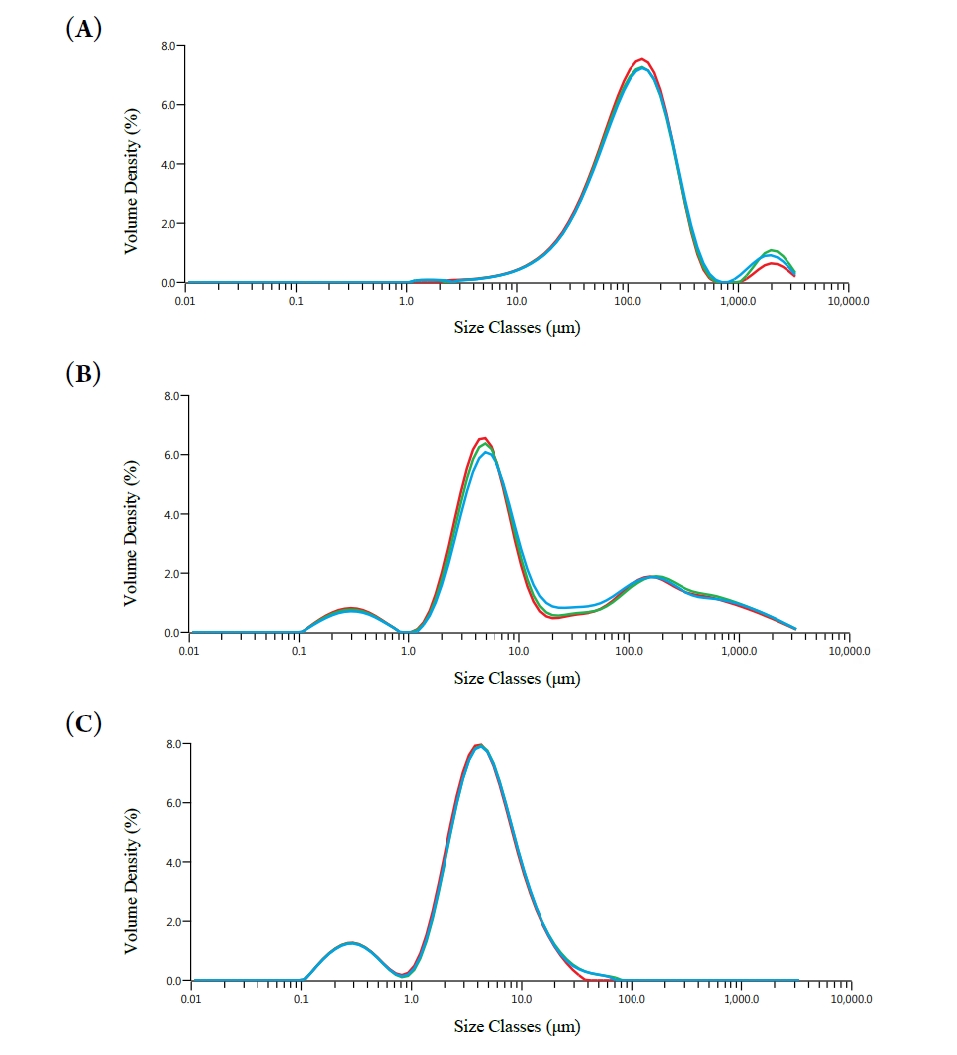



Fig. 1.
Fig. 2.
Fig. 3.
Fig. 4.
Fig. 5.
Fig. 6.
Fig. 7.
Fig. 8.
Graphical abstract
| Formulation | KP-1 | KP-0.5 | KP-0.2 | KG-1 | KG-0.5 | KG-0.2 | |
|---|---|---|---|---|---|---|---|
| Kidney (g) | 1 | 1 | 1 | 1 | 1 | 1 | |
| HPMC P645 (g) | 1 | 0.5 | 0.2 | - | - | - | |
| Gelatin (g) | - | - | - | 1 | 0.5 | 0.2 | |
| Water (g) | (50) | (50) | (50) | (50) | (50) | (50) | |
| Yield (%) | SD | 55.0 | 56.1 | 50.7 | 53.5 | 48.4 | 43.8 |
| FD | 94.0 | 86.9 | 91.9 | 91.3 | 92.9 | 83.9 | |
| Formulation | MLA | MLT | MHA | MHT | |
|---|---|---|---|---|---|
| Predicted solid content of Maillard product solution (g) | 1 | 1 | 1 | 1 | |
| Gelatin (g) | 0.5 | 0.5 | 0.5 | 0.5 | |
| Water (g) | (8) | (8) | (8) | (8) | |
| Yield (%) | SD | 74.7 | 58.7 | 53.3 | 72.0 |
KP; kidney with HPMC P645, KG; kidney with gelatin.
Table 1.
Table 2.
TOP
 KPMI
KPMI



 ePub Link
ePub Link Cite this Article
Cite this Article









