Articles
- Page Path
- HOME > J Powder Mater > Volume 30(2); 2023 > Article
-
Article
합성 방법에 따른 Li1.3Al0.3Ti1.7(PO4)3 소결체의 미세 구조 및 이온전도 특성 연구 - 최슬기a, 최재원b,*, 양민호a,*
- A Study on the Microstructures and Ionic Conductivity of Li1.3Al0.3Ti1.7(PO4)3 with Different Synthesis Routes
- Seul Ki Choia, Jeawon Choib,*, MinHo Yanga,*
-
Journal of Korean Powder Metallurgy Institute 2023;30(2):107-115.
DOI: https://doi.org/10.4150/KPMI.2023.30.2.107
Published online: March 31, 2023
a 단국대학교 에너지공학과
b 경상국립대학교 화학과
a
b
-
* Corresponding Authors: MinHo Yang, TEL: +82-41-550-3685, FAX: +82-41-559-7914, E-mail: mhyang@dankook.ac.kr
Jaewon Choi, TEL: +82-55-772-1481, FAX: +82-55-772-1481, E-mail: cjw0910@gnu.ac.kr - - 최슬기: 학생, 최재원·양민호: 교수
• Received: February 15, 2023 • Revised: April 18, 2023 • Accepted: April 19, 2023
© The Korean Powder Metallurgy Institute. All rights reserved.
- 1,572 Views
- 37 Download
- 1 Crossref
Abstract
- Li1.3Al0.3Ti1.7(PO4)3(LATP) is considered a promising material for all-solid-state lithium batteries owing to its high moisture stability, wide potential window (~6 V), and relatively high ion conductivity (10-3–10-4 S/cm). Solid electrolytes based on LATP are manufactured via sintering, using LATP powder as the starting material. The properties of the starting materials depend on the synthesis conditions, which affect the microstructure and ionic conductivity of the solid electrolytes. In this study, we synthesize the LATP powder using sol-gel and co-precipitation methods and characterize the physical properties of powder, such as size, shape, and crystallinity. In addition, we have prepared a disc-shaped LATP solid electrolyte using LATP powder as the starting material. In addition, X-ray diffraction, scanning electron microscopy, and electrochemical impedance spectroscopic measurements are conducted to analyze the grain size, microstructures, and ion conduction properties. These results indicate that the synthesis conditions of the powder are a crucial factor in creating microstructures and affecting the conduction properties of lithium ions in solid electrolytes.
- 최근 신재생에너지 및 전기자동차의 보급 확대로 중대 형 이차전지 시장이 매년 큰 폭으로 성장하고 있으며, 이 에 따라 고에너지/고출력 밀도를 갖는 이차전지 개발을 위 한 경쟁이 점차 심화되고 있다. 현재 리튬이온전지는 양극 과 음극으로 구성된 전극 조립체를 다공성 절연막으로 격 리시킨 뒤 이온전도도(~10-2 S/cm at 25°C)가 높은 유기 전 해액을 주입하여 사용한다[1]. 이때 사용되는 액상의 유기 전해액은 가연성이 높아 고온 및 단락 전류로 인한 이차 전지 폭발 및 화재 위험이 존재한다. 이와 같은 문제점을 극복하기 위해 유기 전해액 내에 난연성 첨가제를 첨가하 거나 겔 형태의 고분자 전해액을 사용하고 있지만 리튬이 차전지의 안전성 문제는 여전히 해결하기 어려운 상황이 다[2, 3] 따라서, 가연성이 높은 유기 전해액 대신에 난/불 연성의 리튬이온전도성 유기 혹은 무기 고체전해질을 적 용하면 이차전지의 폭발 및 화재 위험성을 근본적으로 해 소할 수 있다.
- 고체 전해질은 구동 전압 범위가 넓어 전극의 사용이 제 한되지 않고, 전기화학적 안정성이 우수하다는 장점을 가 지고 있다. 또한 우수한 기계적 특성과 불에 잘 타지 않는 특성으로 인해 액상 유기 전해액 사용으로 인한 리튬이차 전지의 안전성 문제를 해결하고 에너지 밀도를 획기적으 로 증대시킬 수 있을 것으로 여겨지고 있다[4]. 고체전해 질은 크게 고분자, 황화물, 산화물 고체전해질로 나눌 수 있다. 고분자 고체전해질은 1973년 Fenton 등에 의해 poly (ethylene oxide)와 알칼리 염을 사용하는 형태의 전해질이 처음으로 보고된 이래로 꾸준한 연구가 진행되어 왔으나 고분자의 특성상 사용 온도에 제한이 있고 상온에서의 낮 은 이온 전도도(10-5~10-8 S/cm)로 인해 실제 전지로의 응 용이 제한되었다[3]. 황화물 고체전해질은 1981년 Mercier 등에 의해 Li2S와 P2S5가 2:1 비율로 혼합된 glass형태의 고체전해질이 처음 보고되었으며 이온전도도는 ~10-4 S/ cm 수준이었다[5]. 2011년 Kanno 교수 연구 그룹에 의해 액상의 유기 전해액 수준의 높은 이온전도도(10-2~10-3 S/ cm)를 나타내는 Li10GeP2S12가 보고된 이 후 황화물 고체 전해질은 전고체전지 실용화에 큰 가능성을 보이고 있다[6]. 하지만, 대기 중 수분과 쉽게 반응하여 독성이 강한 H2S 를 형성할 수 있어 취급이 까다롭고 상업적 이용이 심각 하게 제한되고 있다[7]. 한편 산화물 고체전해질은 우수한 대기 안정성과 비교적 높은 이온전도도와 기계적 강도 때 문에 리튬 덴드라이트 성장을 효과적으로 억제할 수 있어 전고체 리튬이차전지에 대한 적용 가능성을 보여주었다[8]. 산화물 고체전해질은 1993년 Inaguma 등에 의해 ~10-5 S/ cm 수준의 이온전도도를 갖는 perovskite형 Li0.5La0.5TiO3 가 처음 개발되었으며, 그 후로 Li7La3Zr2O12, Li1+xAlxGe2-x (PO4)3, Li1.3Al0.3Ti1.7(PO4)3 (이하 LATP) 등과 같이 비교적 높은 이온전도도(10-3~10-4 S/cm)를 갖는 산화물 고체전해 질에 대한 연구가 활발히 진행되고 있다[9-12].
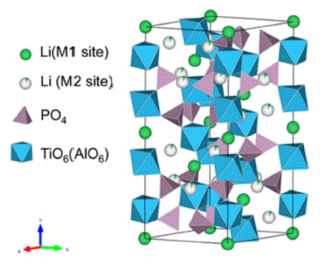
- 산화물 고체전해질 중 전형적인 NASICON형 구조를 갖 는 LATP는 Fig. 1과 같이 Ti(Al)O6 팔면체와 PO4 사면체 가 서로 모서리를 공유하고 있는 구조를 가지고 있다[13]. 이로 인해 Li 이온이 이동할 수 있는 3차원 구조의 이온 채널이 형성된다[14]. 일반적인 LATP의 전구체 분말 합성 방법에는 melt-quenching, mechanical activation, 졸-겔법, 공침법 등이 알려져 있다[15-17]. 이러한 분말 합성 방법 은 분말 입자의 크기, 형태, 분포 및 응집도에 영향을 미 치며 이는 고체전해질의 미세 구조 및 이온 전도 특성에 큰 영향을 미친다. 하지만, 합성 방법에 따른 LATP 전구 체 분말의 특성이 고체전해질에 미치는 영향에 대한 연구 는 미비한 실정이다. 따라서, 본 연구에서는 비교적 낮은 온도에서 입자 크기가 균일한 초미세 분말의 제조가 가능 한 졸-겔법과 공침법을 이용해 두 종류의 LATP 분말을 합 성하였으며, 졸-겔법으로 합성된 LATP 분말을 C-LATP와 공침법으로 합성된 LATP 분말을 E-LATP라 각각 명명하 였다[18]. 또한 서로 다른 조건으로 합성된 LATP 분말을 이용하여 펠렛 형태의 고체전해질을 제조하여 고체전해질 의 미세구조와 이온전도 특성을 분석하고 비교하였다.
1. 서 론
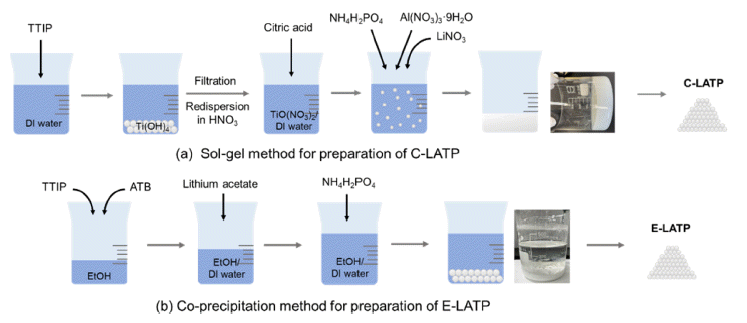
- 본 연구에서는 졸-겔법과 공침법으로 두 종류의 LATP 분말을 합성하였다. 먼저 112 g Titanium(IV) isopropoxide (Ti(OC3O7)4, 97%, Sigma Aldrich) 원액을 24 mL/min 속도 로 교반 중인 증류수에 주입하여 백색의 침전물을 포함하 는 용액을 만들었다. 생성된 백색의 침전물을 여과하여 증 류수로 수차례 세척한 뒤 증류수에 다시 분산시켜 Nitric acid(HNO3, 70%, DAEJUNG)를 10 mL/min 속도로 6분 30초 동안 주입하여 투명한 용액이 될 때까지 교반 하였 다. 이 후 chelate agent인 Citric acid(99.5%, SAMCHUN) 를 171.14 g 첨가하여 Ti 전구체 용액을 만들었다. 상기 제 조된 Ti 전구체 용액에 Lithium nitrate(LiNO3, 99%, Alfa Aesar)과 Aluminium nitrate(Al(NO3)3·9H2O, 98%, Sigma Aldrich)를 화학양론 비에 맞추어 넣고 염이 완전히 용해 될 때까지 교반 한다. 이 투명한 수용액에 90.66 g Ammonium phosphate(NH4H2PO4, 99%, Merck)를 상온에서 첨가 하여 균질한 졸 상태로 만들었다. 이 때 졸 상태의 혼합물 은 수 초 이내에 자발적으로 겔을 형성하였다. 겔 상태의 혼합물을 약수저로 잘게 부순 뒤 85°C의 온도에서 24 시 간 동안 건조시켰다. 건조된 겔은 박스 전기로에서 700°C 의 온도로 3 시간 동안 하소하여 유기물을 제거하고, 열처 리를 마친 LATP 파우더를 공전/자전형 믹서(Pulversette 6, Fritsch)를 이용하여 밀링용 지르코니아 용기에 LATP: 에 탄올: 지르코니아볼(1.9 mm)을 1:0.5:10 비율로 넣어 450 rpm의 회전속도로 15분 밀링 후 15분 휴지를 24 회 반복 하였다.
- 다음으로 19.23 g Titanium(IV) isopropoxide(TTIP, 97%, Sigma Aldrich)와 2.96 g Aluminium tri-sec butoxide(Al [OCH(CH3)C2H5]3, ATB, ≥97%, S igma A ldrich ) 원액을 72.08 mL 무수 에탄올에 첨가하여 혼합 용액을 만들었다. 0.4 M Lithium acetate dihydrate(CH3CO2Li·2H2O, ≥99%, Thermo Fisher) 수용액과 0.4 M Ammonium phosphate monobasic(NH4H2PO4, 99.999%, ACROS ORGANICS) 에 탄올 용액을 따로 준비하여 Ti 전구체와 Al 전구체가 포 함된 투명한 용액에 넣고 상온에서 2 시간 동안 교반하여 성분들을 완전히 혼합하였다. 교반 후에 형성된 침전물은 원심분리기를 사용하여 분리하고 동결건조하여 분말을 얻 었다. 이렇게 얻어진 분말을 위에 언급한 C-LATP와 동일 한 조건으로 하소와 분쇄 과정을 거쳐 최종적으로 백색의 E-LATP 분말을 얻었다.
- 이렇게 얻어진 백색 분말을 지름 16 mm 성형 몰드에 채 워 넣고 5 ton의 무게로 일축가압성형하여 펠렛 형태의 성 형체를 만들었다. 이 성형체를 5°C/min의 승온속도로 1000°C까지 승온 시킨 후 1000°C에서 10 시간 동안 소결 하여 소결체를 제조하였다. 소결 과정 중 리튬 소실을 방 지하기 위해 성형체와 조성이 동일한 분말을 덮어주었다.
- 출발 원료인 LATP 분말의 순도 및 결정성 확인을 위해 Cu-Kα선을 사용하였으며 40 kV, 15mA 조건에서 2θ가 10°~90°까지 5°/min의 스캔 속도로 X-선 회절 분석(X-ray diffraction; XRD, MiniFlex600, Rigaku)을 실시하였다. 분 말 입자의 크기 및 분포도 확인을 위해 동적광산란 분석 (Dynamic Light Scattering; DLS, NanoPlus)을 실시하였다. 분말 입자의 크기, 형상 및 소결체의 미세 구조는 가속 전압 10 kV 조건으로 전계 주사 현미경(Field Emission- Scanning Electron Microscopy; FE-SEM, S-4800, Hitachi) 을 이용하여 분석하였다. LATP 고체전해질의 이온전도도 와 grain boundary capacitance 값은 전기화학 임피던스 분 광법(Electrochemical Impedance Spectroscopy; EIS, 1260, Solartron)을 통해 측정하였다.
2. 실험방법
- 본 연구에서는 Fig. 2에 나타낸 것처럼 졸-겔법과 공침 법을 이용하여 두 종류의 LATP 분말을 합성하였다. 먼저 졸-겔법을 이용하여 LATP 분말을 제조할 경우 전구체 원 료에 물이 첨가되면 다음 식(1)과 같이 가수 분해 반응이 진행된다.
- 이 후 NH4H2PO4를 첨가하면 중합 반응에 의해 겔화가 진행되기 시작하여 약 1 시간이 지나면 겔화 반응이 종료 된다. 상기 합성된 겔을 건조, 분쇄, 하소하여 백색의 CLATP 분말을 얻었다. 한편, 공침법을 이용하여 LATP 분 말을 제조할 경우 졸-겔 반응과 달리 용매를 증류수가 아 닌 무수 알코올을 사용하여 TTIP와 ATB가 혼합된 혼합 용액을 만든다. 0.4M Li 전구체 수용액과 0.4M phosphate 전구체 알코올 용액을 따로 준비한 뒤 상기 제조된 Ti/Al 전구체 혼합 용액에 첨가하면 수산화물 형태의 백색 입자 가 침전된다. 얻어진 백색의 침전물을 증류수로 수 차례 세척하고 동결 건조하여 백색의 E-LATP 분말을 얻었다.
- 상기 제조된 C-LATP와 E-LATP는 700°C에서 3 시간동 안 하소시켰다. 하소 전후의 C-LATP와 E-LATP 분말의 XRD 분석 결과를 Fig 3에 나타내었다. 두 시료 모두 하 소 전에는 비정질 피크가 관찰되었으나, 하소 처리 후에 두 시료 모두 TiPO3, AlPO4, TiP2O7 등의 이차상이 존재 하지 않고 NASICON 구조의 LiTi2(PO4)3 (ICDD #35- 0754)상 외에 주목할 만한 피크들이 관찰되지 않았다[19]. 이를 통해 제조된 C-LATP와 E-LATP 분말이 수백 나노 미터 크기의 Li1.3Al0.3Ti1.7(PO4)3 결정립으로 이루어진 것을 확인하였다.
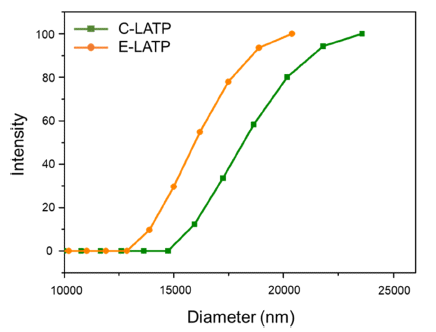
- 하소한 C-LATP와 E-LATP 분말 시료의 입자 크기 및 분포를 확인하기 위해 산란광의 시간 상관 함수 형태의 데이터를 입자 확산 상수 분포의 누적 값을 포함한 DLS 분석을 수행하였고 그 결과를 Fig. 4에 나타내었다. 기존 에 사용되던 선형 최소 제곱 분석법을 대신하여 수식이 복잡함에도 불구하고 더욱 정확한 데이터를 얻을 수 있다 고 알려진 비 선형적인 누적 분포분석을 통한 Fig. 4의 결 과로부터 C-LATP와 E-LATP의 평균 누적 입도는 각각 1021.7 nm, 870.1 nm크기의 나노분말이 제조되었음을 확 인하였다[20]. 입도가 가장 작은 입자들부터 시작하여 누 적 중량이 n%에 도달했을 때의 입도(d)를 측정했고 d10, d50, d90 분포를 확인한 결과 C-LATP의 분포도는 각각 15710.9 nm, 18167.9 nm, 21309.2 nm이고 E-LATP의 분포 도는 128.8 nm, 150.3 nm, 231.3 nm로 C-LATP 보다 ELATP의 입자가 더 작게 형성됨을 알 수 있다.
- Fig. 5는 C-LATP와 E-LATP 분말 시료의 분쇄 전과 후 의 미세구조를 비교한 SEM 분석 결과이다. C-LATP의 분 쇄 전과 후의 SEM 이미지인 (a)와 (b)를 비교했을 때, 분 쇄 전 C-LATP 분말의 평균 직경은 300 nm인 다공성 세라 믹 구조가 관찰되었고 입자의 크기가 균일한 형상을 나타 냈다. 반면, 분쇄 후 C-LATP 분말의 형상은 불균일한 입 자들이 형성되었는데 이는 졸-겔 제조법으로 인한 낮은 결 정화 온도의 영향으로 인해 입자간 상호작용 시 서로 응 집되려는 경향이 증가하기 때문이라고 사료된다. 반면 (c) 와 (d)는 E-LATP 분말의 분쇄 전 후의 결과로써, 분쇄 전 E-LATP 분말의 평균 직경은 100 nm로 상대적으로 균일한 입자 크기와 분포를 나타내었다. 이는 세라믹 파우더를 동 결 건조할 시, 입자크기에 중요한 영향을 미치는데 진공 (100 mTorr)하에서 임계 동결속도 이하로 내려가지 않는 상태로 24 시간 이상 유지한 입자들은 응집하지 않기 때 문이라고 판단된다[21]. 이와 같은 영향으로 분쇄 후 ELATP의 분말 역시 입자의 형상이 전과 크게 다르지 않음 을 확인할 수 있다.
- 하소 후 분말 시료를 이용하여 펠렛 성형체를 만들고 성 형체의 무게, 지름, 두께를 측정하여 밀도를 비교하였다. C-LATP와 E-LATP 성형체의 밀도는 각각 1.66 mg/cm3, 1.60 mg/cm3로 이는 C-LATP와 E-LATP 분말의 분쇄 후 SEM 이미지에서도 확인할 수 있듯이, E-LATP의 분말이 C-LATP에 비해 전반적으로 기공구조가 넓게 분포된 결과 의 영향이라고 판단된다.
- Fig. 6은 소결 후 C-LATP와 E-LATP 펠렛의 표면과 단 면을 분석한 SEM 결과이다. 먼저 표면 이미지를 보면, CLATP의 표면은 마름모꼴의 입자 구조로 형성되어 있으며 grain과 grain boundary의 경계가 다소 명확하게 보이는 것 을 확인하였다. 또한 기공이 거의 없는 상태로 크기가 약 20 μm 수준의 입자들이 결합되어 있음을 확인하였다. ELATP 시료의 표면에는 산호 형상의 층이 존재하는 것을 확인할 수 있으며 C-LATP와 동일한 면적으로 비교했을 때 소결 시 더 작은 입자들이 서로 응집된 것처럼 보이지 만, 더 높은 배율에서 관찰했을 때 미세한 기공들이 더 많 이 존재하는 것을 확인하였다. 이는 XRD와 DLS 분석 결 과와는 다르게 소결 시, C-LATP의 경우 입자가 성장하지 않는 반면에 E-LATP의 경우 입자가 성장하는 차이를 확 인할 수 있다.
- 이와 같은 결과는 펠렛 시료의 파단면을 분석한 Fig. 7 에서도 확인할 수 있다. C-LATP 시료의 경우, 표면에서 약 간의 기공 구조가 관찰되었지만 내부로 들어갈수록 입자 들이 치밀하게 뭉쳐져 있는 것을 확인할 수 있다. 이는 CLATP 분말이 소결 과정에서 입자끼리 넥킹(necking)이 고 르게 된 것으로 판단된다. 반면에 E-LATP의 파단면은 시 료의 중심부와 표면 부분에서 미세구조 차이가 관찰되지 않아 매우 균일해 보였지만, 펠렛의 내부로 갈수록 100 nm 수준의 다수의 기공이 존재하는 것을 확인할 수 있다. 이는 LATP 입자 간의 접촉 면적이 C-LATP에 비해 크게 감소한 것이라고 예상할 수 있고, 이러한 고체전해질 내부 에 존재하는 기공은 이온전도도를 감소시킬 뿐만 아니라 기계적 결함을 초래할 수 있는 원인이 될 것이라고 사료 된다[22].
- Fig. 8는 소결 후 펠렛 형태의 LATP 시료의 XRD 분석 결과로써, TiPO3, AlPO4, TiP2O7 등의 이차상이 존재하지 않고 순수한 LiTi2(PO4)3 상을 나타내는 것을 확인하였다. 또한, 분말 회절 패턴으로 결정구조를 분석하는 일반적인 방법으로 리트벨트 정련법(Rietveld refinement)을 사용하 는데 이를 위해 결정구조의 초기 모델로부터 계산된 패턴 을 구하여 측정된 회절패턴과 비교했다. 측정된 회절 패턴 과 계산된 모델 간의 차이를 줄이는 과정은 최소제곱법 (least-square method)을 통해 반복했다. 최소제곱법은 측정 값과 계산값 차이의 제곱의 합 또는 평균을 최소화하도록 매개 변수를 탐색하는 방법이며 식 (5)를 이용하여 계산할 수 있다. 또한 두 시료 선폭 평균 결정립자 크기 L을 관련 시키는 공식을 다음 식 Scherrer equation (6)을 이용하여 계산하였다. 이때, 적층 결함(stacking fault)에 의한 미세 변형(microstrain)과 같은 효과는 무시하였다[23, 24].
- 여기서 Sy는 측정값과 계산값의 차이, yi는 i번째 스텝에서 측정된 회절 세기, yci는 모델로부터 계산된 회절 세기이며 wi는 1/yi이다. 리트벨트는 각 피크에 가우스 함수를 할당 한 다음, 가우스 함수들을 중첩시켜 전체 회절 프로파일을 계산할 수 있는 방법을 공식화하였다. 현재에는 가우스 함 수와 로렌츠 함수를 조합시켜 만든 Pseudo-Voigt 함수를 사용하고 있다.
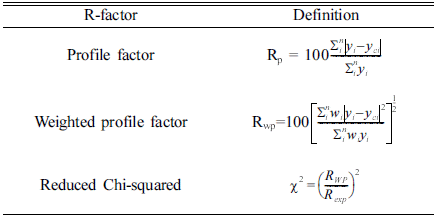
- 리트벨트 정련은 계산값과 측정값 차이가 최소가 될 때 까지 사용 가능한 변수를 반복적으로 조정하는 피드백 과 정으로 최선의 fitting에 대한 판단을 내리기 위해서는 기 준이 필요하다. 이때 사용되는 신뢰성 지수(R-factor)를 사 용하며, 본 분석에 쓰인 각 신뢰도 값의 정의는 Tabel 1과 같다.
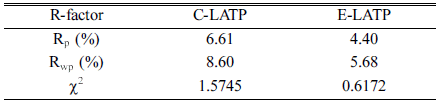
- 초기 구조 모델을 가지고 분말 회절 프로파일을 계산한 다음 측정된 프로파일과 비교함으로써 리트벨트 정련을 시작한다. 그 다음, 원자 배열을 변경하고 측정 패턴과 가 장 잘 일치할 때까지 점진적으로 수정한다. 정련과정에서 얻은 결정구조의 타당성은 두 패턴의 차이에 의해 평가되 는데 이때 그 값의 크기가 작을수록 신뢰도가 높이 평가 된다. Rp와 Rwp 값은 전반적인 프로파일의 적합성을 나타 내며 값이 5-6에 가까울수록 높이 평가되고, χ는 1에 가까 워야 한다. Fig. 8에 나타낸C-LATP와 E-LATP의 계산된 R-factor 값은 Table 2와 같다.
- 이를 통해, LATP의 주 피크 300면과 410면 Fig. 8 (b, c) C-LATP와 (e, f) E-LATP 펠렛을 비교했을 때 C-LATP 의 피크가 E-LATP피크에 비해 날카롭게 나타나는데, 이 는 결정체의 크기가 커지면 피크가 날카로워져 intensity가 증가하기 때문이라고 판단된다.
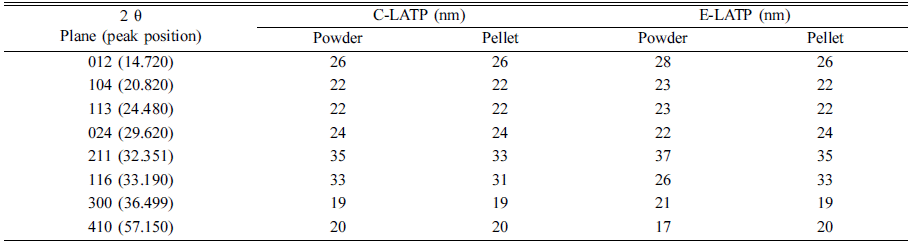
- Table 3에 정리한 바와 같이 C-LATP의 경우 소결 전 후 의 결정립 크기가 거의 나타나지 않는 것을 확인할 수 있 는데, 이는 C-LATP의 경우 소결 시 입자의 성장 없이 단 순 넥킹이 이루어지기 때문이라고 판단된다. 그에 반해, E-LATP의 경우 소결과정에서 단순 넥킹 뿐만 아니라 입 자가 불균일하게 성장함으로써 결정립의 변화가 생겼다고 판단되는데 이는 소결체의 크기에도 영향을 미치는 것을 확인하였다. C-LATP 소결체의 경우 성형체와 밀도 차이 가 거의 나지 않는 반면에 E-LATP의 경우 성형체에 비해 10% 줄어든 것을 확인했다. 이는 E-LATP의 결정립이 축 소됨에 따라 나타난 결과라고 사료된다.
- C-LATP와 E-LATP 분말을 출발 원료로 하여 제조된 고 체전해질의 이온 전도 특성을 평가하기 위해서 제조된 소 결체 양면에 Ag paste로 blocking electrode를 형성하여 임 피던스를 측정하였고 그 결과를 Fig. 9에 나타내었다. 두 임피던스 스펙트럼 모두 bulk 저항과 grain boundary 저항 에 기인한 X축 절편과 반원이 각각 고주파 영역과 중저주 파 영역에서 나타났다. 저주파 영역에서는 기울어진 직선 인 spike가 관찰되었는데 blocking electrode와 전해질 간 의 분극 현상에 기인한 것이다[25].
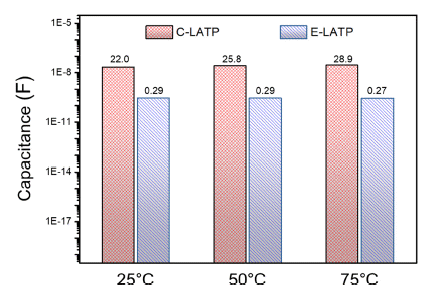
- 일반적으로 고체전해질은 10-8~10-11 F 범위의 grain boundary capacitance 값을 가지며, 치밀한 구조에서 그렇 지 않은 경우 보다 높은 capacitance 값을 나타낸다고 알 려져 있다[26]. Fig. 9의 임피던스 측정 결과를 등가 회로 에 fitting한 결과, E-LATP는 온도 변화와 관계없이 CLATP에 비해 약 10배 작은 grain boundary capacitance 값 을 보이는 것으로 나타났다. 이를 통해 고체전해질의 미세 구조가 이온 전도도에 미치는 영향이 크고, 미세구조 조절 을 통해 높은 이온전도도를 갖는 고체전해질 제조가 가능 할 것으로 사료된다.
3. 결과 및 고찰
Fig. 3
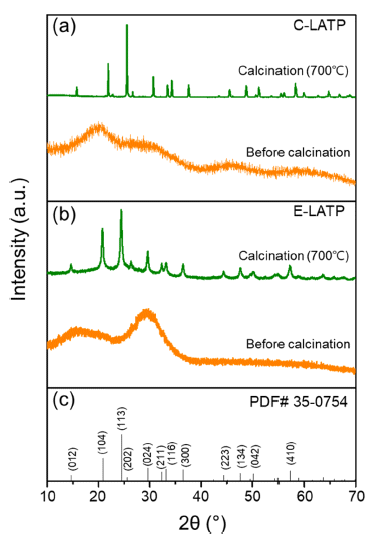
XRD pattern of (a) C-LATP, (b) E-LATP powder (before and after calcination at 700°C) and (c) phase of LiTi2(PO4)3 (ICDD #35-0754).

Fig. 5

FE-SEM image of powder before milling of (a, c) C-LATP and E-LATP, after milling (b, d) C-LATP and E-LATP.

Fig. 7

FE-SEM image of cross-section pellet (a) top of C-LATP, (b, c) middle of C-LATP, (d) top of E-LATP, (e, f) middle of ELATP.

Fig. 8
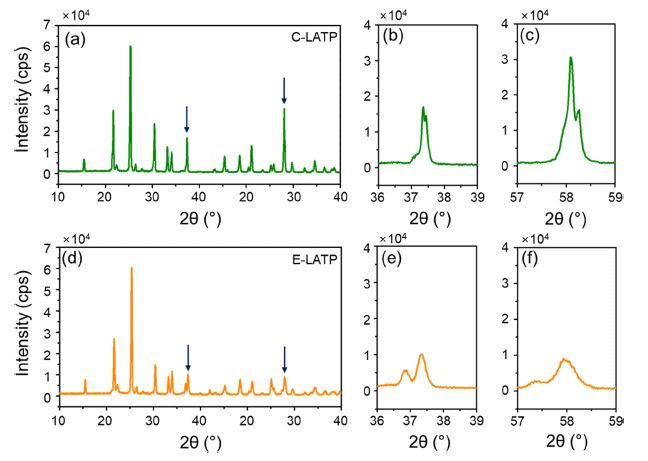
XRD pattern of (a, d) overall C-LATP and E-LATP, (b, e) 300-side C-LATP and E-LATP and (c, f) 410-side C-LATP and E-LATP, respectively.

Fig. 9
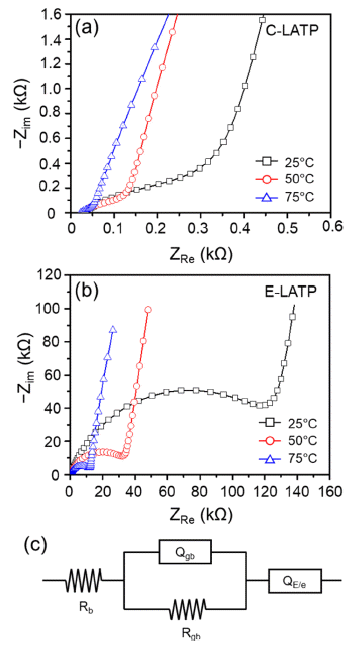
Nyquist plots of the sintered pellet of (a) C-LATP, (b) E-LATP, (C) equivalent circuit Rb, Rgb, Qgb a n d QE/e represent bulk resistance, grain boundary resistance, grain boundary capacitance and electrode/electrolyte capacitance, respectively.

- 본 연구에서는 졸-겔법과 공침법으로 제조한 LATP 분 말을 출발 원료로 펠렛 형태의 LATP 고체전해질을 제작 했다. 공정에 따라 제조된 분말 상태의 LATP의 합성 유무, 입자 형태, 결정립 등을 분석한 결과에서는 두 공정이 크 게 다르지 않았지만 고온에서 소결한 결과에서는 차이가 확연했다. 가장 큰 차이는 소결 후에 나타났는데, 분말 형 태의 LATP 입자들을 소결할 시 C-LATP는 고체전해질 내 부까지 입자 형태가 변형되지 않고 치밀하게 소결되는 반 면에 E-LATP의 경우 입자가 불균일하게 성장함에 따라 크고 작은 기공이 고체전해질 내부에 형성되었다. 이는 고 체전해질이 해결해 나가야 할 숙제인 전도도에도 영향을 미치는데, LATP 입자 간의 접촉 면적이 치밀하게 소결된 C-LATP에 비해 크게 감소함으로써 capacitance 값 또한 10배 이상 낮았다. 따라서, 800 °C 이상에서 소결이 필수 적인 고체전해질의 특성상 고온에서 기공 없는 치밀한 미 세 구조로 소결체를 제작하는 것이 중요한데, 공침법을 이 용한 E-LATP 보다는 졸-겔 법을 이용한 C-LATP의 고체 전해질이 소결체 제작에 더 적합하고 판단된다.
4. 결 론
-
Acknowledgements
- 이 성과는 정부(과학기술정보통신부)의 재원으로 한국 연구재단의 지원을 받아 수행된 연구임(No. 2022R1C1C 1006536).
Acknowledgement
- 1. J.-M. Tarascon and M. Armand: Nature, 414 (2001) 359. .ArticlePubMed
- 2. Z. Ding, X. Li, T. Wei, Z. Yin and X. Li: Electrochim. Acta, 196 (2016) 622. .Article
- 3. D. Zhou, D. Shanmukaraj, A. Tkacheva, M. Armand and G. Wang: Chem., 5 (2019) 2326. .Article
- 4. Q. Zhao, S. Stalin, C.-Z. Zhao and L. A. Archer: Nat. Rev. Mater., 5 (2020) 229. .Article
- 5. R. Mercier, J.-P. Malugani, B. Fahys and G. Robert: Solid State Ionics, 5 (1981) 663. .Article
- 6. N. Kamaya, J. Homma, Y. Yamakawa, M. Hirayama, R. Kanno, M. Yonemura, T. Kamiyama, Y. Kato, S. Hama, K. Kawamoto and A. Mitsui: Nat. Mater., 10 (2011) 682. .ArticlePubMed
- 7. T. A. Yersak, Y. Zhang, F. Hao and M. Cai: Front. Energy Res., 10 (2022) 882508. .Article
- 8. B. Kang, H. Park, S. Woo, M. Kang and A. Kim: Ceramist, 21 (2018) 349. .Article
- 9. Y. Inaguma, C. Liquan, M. Itoh and T. Nakamura: Solid State Commun., 86 (1993) 689. .Article
- 10. R. Murugan, V. Thangadurai and W. Weppner: Angew. Chem. Int. Ed., 46 (2007) 7781. .ArticlePubMed
- 11. D. Safanama, D. Damiano, R. Prasada and S. Adams: Solid State Ionics, 262 (2014) 211. .Article
- 12. Y. Yoon, J. Kim, C. Park and D. Shin: J. Ceram. Process. Res., 14 (2013) 563. .
- 13. S. Wang, Y. Ding, G. Zhou, G. Yu and A. Manthiram: ACS Energy Lett., 1 (2016) 1080. .Article
- 14. B. Lang, B. Ziebarth and C. Elsässer: Chem. Mater., 27 (2015) 5040. .Article
- 15. K. Arbi. S. Mandal, J. M. Rojo and J. Sanz: Chem. Mater., 14 (2002) 1091. .Article
- 16. L. Huang, Z. Wen, M. Wu, X. Wu, Y. Liu and X. Wang: J. Power Sources, 196 (2011) 6943. .Article
- 17. Q. Ma, Q. Xu, C.-L. Tsai, F. Tietz and O. Guillon: J. Am. Ceram. Soc., 99 (2016) 410. .Article
- 18. Z. Yao, K. Zhu, J. Zhang, X. Li, J. Wang, K. Yan and J. Liu: J. Mater. Sci.: Mater. Elecron., 32 (2021) 24834 .
- 19. M. Kotobuki, M. Koishi and Y. Kato: Solid State Ionics, 19 (2013) 1945. .
- 20. A. G. Mailer, P. S. Clegg and P. N. Pusey: J. Phys. Condens. Matter, 27 (2015) 145102. .ArticlePubMed
- 21. Y.-K. Byeun, S.-H. Lee and S.-C. Choi: J. Kor. Ceram. Soc., 40 (2003) 798. .Article
- 22. S. Duluard, A. Paillassa, L. Puech, P. Vinatier, V. Turq, P. Rozier, P. Lenormand, P.-L. Taberna, P. Simon and F. Ansart: J. Eur. Ceram. Soc., 33 (2013) 1145. .Article
- 23. P. Scherrer: Nachr. Ges. Wiss. Göttingen, 26 (1918) 98. .
- 24. J. I. Langford and A. J. C. Wilson: J. Appl. Cryst., 11 (1978) 102. .Article
- 25. A. J. Bard and L. R. Faulkner: ELECTROCHEMICAL METHODS Fundamentals and Application (2nd Ed.), John Wiley & Sons, New York (2001). .
- 26. J. T. S. Irvine, D. C. Sinclair and A. R. West: Adv. Mater., 2 (1990) 132..Article
Figure & Data
References
Citations
Citations to this article as recorded by 

- Controlling the All-Solid Surface Reaction Between an Li1.3Al0.3Ti1.7(PO4)3 Electrolyte and Anode Through the Insertion of Ag and Al2O3 Nano-Interfacial Layers
Gwanhee Song, Bojoong Kim, Inkook Hwang, Jiwon Kim, Jinmo Kim, Chang-Bun Yoon
Materials.2025; 18(3): 609. CrossRef
A Study on the Microstructures and Ionic Conductivity of Li1.3Al0.3Ti1.7(PO4)3 with Different Synthesis Routes
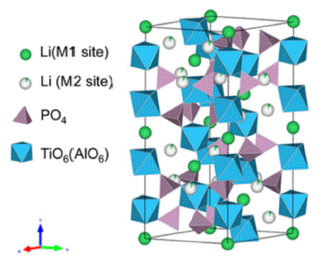
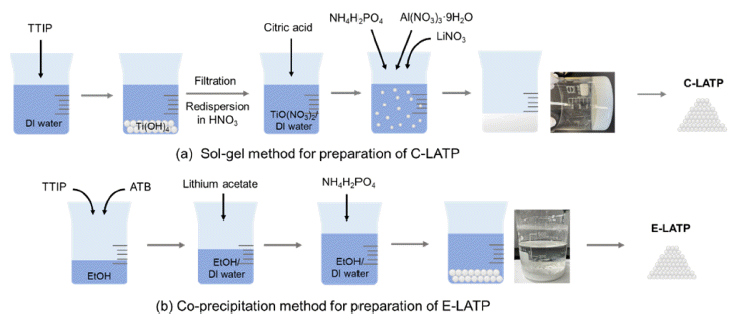
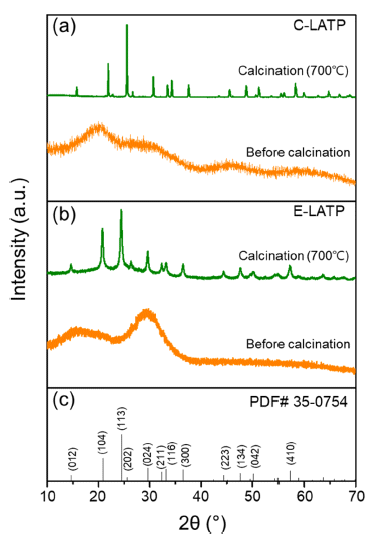
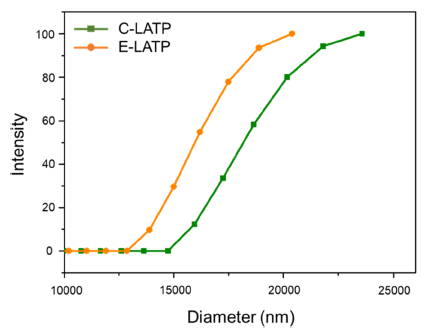



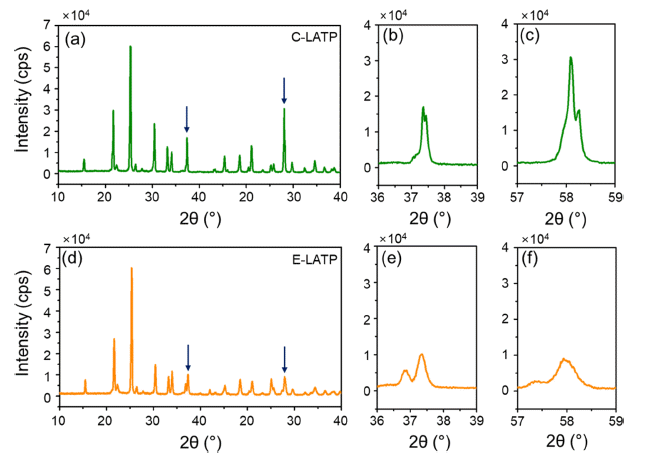
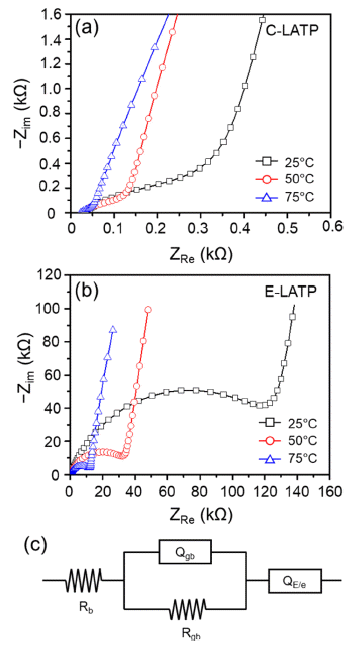
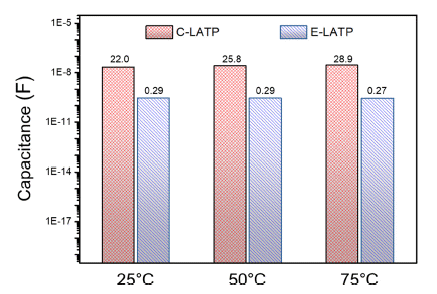
Fig. 1
Crystal structure of Li1.3Al0.3Ti1.7(PO4)3 [13].
Fig. 2
Synthesis process of (a) C-LATP and (b) E-LATP powder.
Fig. 3
XRD pattern of (a) C-LATP, (b) E-LATP powder (before and after calcination at 700°C) and (c) phase of LiTi2(PO4)3 (ICDD #35-0754).
Fig. 4
Size distribution of synthesized C-LATP, E-LATP.
Fig. 5
FE-SEM image of powder before milling of (a, c) C-LATP and E-LATP, after milling (b, d) C-LATP and E-LATP.
Fig. 6
FE-SEM image of surface LATP pellet (a, b) C-LATP, (c, d) E-LATP.
Fig. 7
FE-SEM image of cross-section pellet (a) top of C-LATP, (b, c) middle of C-LATP, (d) top of E-LATP, (e, f) middle of ELATP.
Fig. 8
XRD pattern of (a, d) overall C-LATP and E-LATP, (b, e) 300-side C-LATP and E-LATP and (c, f) 410-side C-LATP and E-LATP, respectively.
Fig. 9
Nyquist plots of the sintered pellet of (a) C-LATP, (b) E-LATP, (C) equivalent circuit Rb, Rgb, Qgb a n d QE/e represent bulk resistance, grain boundary resistance, grain boundary capacitance and electrode/electrolyte capacitance, respectively.
Fig. 10
Capacitance of LATP according to different temperature.
Fig. 1
Fig. 2
Fig. 3
Fig. 4
Fig. 5
Fig. 6
Fig. 7
Fig. 8
Fig. 9
Fig. 10
A Study on the Microstructures and Ionic Conductivity of Li1.3Al0.3Ti1.7(PO4)3 with Different Synthesis Routes
Table 1
Definition of reliability index and each reliability factor value in Rietveld refinement
Table 2
R-factor of C-LATP, E-LATP
Table 3
Crystallite size distribution data of the (a) C-LATP and (b) E-LATP
Table 1
Table 2
Table 3
TOP
 kpmi
kpmi


 Cite this Article
Cite this Article










