Articles
- Page Path
- HOME > J Korean Powder Metall Inst > Volume 23(4); 2016 > Article
-
Article
폴리올 공정과 액상 환원 공정에 따른 은 입자 제조 및 특성 평가 - 유주연, 장효성, 이근재*
- Fabrication and Characterization of Ag Particles by Polyol Process and Wet Chemical Process
- Juyeon Yoo, Hyosung Jang, Kun-Jae Lee*
-
Journal of Korean Powder Metallurgy Institute 2016;23(4):297-302.
DOI: https://doi.org/10.4150/KPMI.2016.23.4.297
Published online: July 31, 2016
단국대학교 에너지공학과
Department of Energy Engineering, Dankook University, Cheonan-si 311-16, Korea
- * Corresponding Author: Kun-Jae Lee, TEL: +82-41-550-3684, FAX: +82-41-559-7945, E-mail: kjlee@dankook.ac.kr
• Received: July 26, 2016 • Revised: August 10, 2016 • Accepted: August 12, 2016
© The Korean Powder Metallurgy Institute. All rights reserved.
- 495 Views
- 2 Download
- 1 Crossref
Abstract
- Ag nanoparticles are extensively studied and utilized due to their excellent catalysis, antibiosis and optical properties. They can be easily synthesized by chemical reduction methods and it is possible to prepare particles of uniform size and high purity. These methods are divided into vapor methods and liquid phase reduction methods. In the present study, Ag particles are prepared and analyzed through two chemical reduction methods using solvents containing a silver nitrate precursor. When Ag ions are reduced using a reductant in the aqueous solution, it is possible to control the Ag particle size by controlling the formic acid ratio. In addition, in the Polyol process, Ag nanoparticles prepared at various temperatures and reaction time conditions have multiple twinned and anisotropic structures, and the particle size variation can be confirmed using field emissions scanning electron microscopy and by analyzing the UV-vis spectrum.
- 은 나노입자는 뛰어난 광학특성, 전기전도성, 화학적 안 정성, 촉매활성, 열적 특성 및 항균성 등으로 인하여 연구 가 활발히 진행되고 있으며, 다양한 산업에서 적용되고 있 다. 이러한 은 나노입자는 일반적으로 다양한 물리적, 화 학적 방법에 의해 제조되고 안정화된다[1-2]. 특히 화학적 환원, 전기화학적 환원[3], 광화학적 환원, 조사 환원[4], 유기 용매에서의 열분해[5], 생물학적 합성 및 마이크로파 환원 등 다양한 합성 방법에 의해 제조될 수 있다[6]. 또 한 합성 방법과 실험 조건(온도, 반응시간, 환원제와 안정 제의 농도 등)에 따라 다양한 크기와 형상의 나노입자를 형성시킬 수 있으며, 이렇게 형성된 입자의 크기가 일정 영역(1-100 nm)에 포함되면 물리적, 화학적 특성의 변화가 가능한 것으로 알려져 있다[7]. 은 나노입자 제조에서 가 장 흔히 사용되는 방법은 액상 환원 공정을 이용한 화학 적 환원법으로, 수용액에 환원제를 첨가한 후 Ag 이온을 환원시키는 방법과 EG를 용매와 환원제로 동시에 사용하 여 합성하는 Polyol 공정 등을 예로 들 수 있다.
- 액상 환원법에 의한 은 입자 합성 방법에서 Ag 전구체 가 포함된 수용액상에서 Formic acid의 환원력을 이용하 는 방법은 은 입자 제조에 주로 이용되는 Polyol 공정과는 달리 열을 가하지 않고 Formic acid의 환원력만을 이용하 여 실온에서 합성하기 때문에 비교적 낮은 에너지로 은 입자를 제조할 수 있는 간단한 공정이다. 또한 이 액상 환 원법은 다른 화학적 방법과는 달리 저비용으로 균일한 입 자의 합성이 가능한 장점이 있어 은 입자 제조에 다양하 게 응용되고 있다[8].
- Polyol 공정은 금속 나노입자를 형성시키는 화학적 환원 방법 중 하나로, 나노 사이즈의 금속 및 산화물 입자의 형 태를 조절하여 다양한 모양으로 제조할 수 있는 적합한 방법으로 잘 알려져 있다[9-10]. 용매 및 환원제로 사용하 는 폴리올은 두 개 이상의 수산기(-OH)를 가진 다가 알코 올로[11], 대표적으로 Ethylene glycol, Propylene glycol, Tetramethylene glycol, Isosobide 등을 예로 들 수 있으며, 은 나노입자를 합성하는 Polyol 공정에서는 주로 Ethylene glycol을 폴리올로 사용하고 있다. Polyol 공정은 다른 공정 에 비해서 높은 수득률 및 규칙적인 형태를 얻을 수 있는 장점을 가지고 있으며[12-13], 반응이 진행됨에 따라 용액 의 색 변화가 나타나기 때문에 반응과정을 관찰하기 용이하 고, 간단한 방법으로 합성 조건을 조절할 수 있기 때문에 여 러 연구에서 많이 사용되고 있다[14]. 폴리올을 이용한 합성 방법은 고온에서 폴리올이 알데히드로 변하게 되면, 이 알 데히드가 은 이온을 은 나노입자로 환원시키는데, 온도에 따라 생성되는 알데히드의 정도가 다르기 때문에 은 이온의 환원에 미치는 영향이 다르게 나타나게 된다[15].
- 본 연구에서는 두 가지 합성 방법을 이용하여 은 나노 입자를 제조하였다. 환원제를 이용한 은 입자 제조에서는 Formic acid의 비율이 은 입자 합성에 미치는 영향이 무엇 인지 알아보기 위하여 변수를 두었으며, Polyol 공정에서 는 은 입자의 생성에 온도가 어떤 영향을 주는지 알아보 기 위하여 온도를 변수로 두고 실험을 진행하였다. 두 공 정을 이용하여 제조한 은 입자의 특성 분석을 통해 합성 공정에 따른 차이를 알아보았다.
1. 서 론
- 2.1. Formic acid 액상환원법을 이용한 은 입자 합성
- 본 연구에서는 은의 전구체로 AgNO3(99.85%, ACROS) 을 사용하였다. 용매는 D.I Water를, 환원제로는 Formic acid(99.0%, DAEJUNG)을 사용하였으며, 계면활성제로는 Polyvinyl pyrrolidone(Mw=55000 g/mol, ALDRICH)을 사 용하였다. UV-vis 분석을 위한 용액 제조에서는 D.I Water 에 PVA 10 wt%를 녹인 후, AgNO3 0.5M을 주입한 뒤, Formic acid의 양을 달리하여 주입하였다. 은 입자 제조를 위한 합성 실험에서는 D.I Water와 Formic acid를 일정 비율 로 혼합한 수용액 10 ml에 PVP 0.2 g을 주입하고 AgNO3 0.3 g을 주입하였다. 최종적으로 제조된 용액은 실온에서 계속 교반하면서 반응시켰다. Formic acid를 이용하여 환 원시키는 은 입자 제조과정에서 Formic acid의 비율이 어 떤 영향을 주는지 알아보기 위하여 D.I Water와 Formic acid의 비율을 7:3 및 3:7의 조건으로 실험을 진행하였다.
- 2.2. 폴리올(Polyol) 공정을 이용한 은 입자 합성
- 은의 전구체로는 AgNO3(99.85%, ACROS)을 사용하였 다. 용매와 환원제로 Ethylene glycol(62.07 g/mol, Yakuri Pure Chemicals)을 사용하였으며 계면활성제로는 Polyvinyl pyrrolidone(Mw=29000 g/mol, ALDRICH)을 사용하였다. 삼 구 플라스크에 EG 80 ml를 넣고 맨틀을 이용하여 일정 온 도로 예열한 후에 AgNO3 0.5 M을 혼합한 수용액을 주입 하였다. AgNO3 주입 90초 후에 PVP 1.2 mM을 혼합한 수 용액을 주입하였다. 최종적으로 제조된 용액을 180분 동 안 맨틀에서 반응시켰으며, 반응 시간 동안 계속 교반하였 고, 반응이 끝난 후에는 실온으로 유지시켰다. 폴리올 공 정을 이용한 은 나노입자 제조과정에서 각각 온도와 반응 시간이 미치는 영향을 알아보기 위하여 다양한 조건으로 실험을 진행하였다. 100°C 및 150°C에서 각각 반응시켰으 며, 1min, 10min, 30min, 60min, 90min, 180min 시간 간격 으로 용액을 추출하였다.
- 2.3. 특성평가
- 제조된 은 나노입자는 Ultraviolet-visible spectroscopy (UV-1800, SHIMADZU)을 사용하여 콜로이드 상태에서의 정성분석을 하였다. 입자의 형상 분석을 위해 Field emission scanning electron microscope(FE-SEM, ZEISS, Gimini)와 High resolution transmission electron microscope(HR-TEM II, JEM-2100F, JEOL)을 이용하였으며, 입자의 결정구조는 Xray diffractometer(XRD, ULTIMA IV, Rigaku)을 이용하여 분석하였다.
2. 실험방법
- 3.1. Formic acid 액상환원법을 이용한 은 입자 합성
- Silver nitrate를 전구체로 이용하여 Formic acid를 이용 한 은 나노입자 합성 실험에서, Formic acid이 주는 영향 이 무엇인지 확인하기 위하여 Formic acid의 첨가량을 다 르게 한 UV-vis spectrum 분석용 용액을 제조하였다. 그림 1은 Formic acid의 첨가량과 시간에 따른 용액의 UV-vis spectrum을 나타낸다. 첨가량이 0 ml일 경우, 모든 시간대 에서 나타난 최대 흡수 피크의 파장이 420 nm임을 확인할 수 있는데, 이는 Formic acid로 인한 환원이 일어나지 않 기 때문에 매우 안정적인 상태로 존재하며, 또한 가장 작 은 입도를 가지고 있음을 알 수 있다. 첨가량이 2, 4, 6, 8 ml의 경우에는 440~470 nm의 파장대를 나타내고 있으 며, (a), (b), (c)의 그래프에서 각 첨가량을 기준으로 최대 흡수 피크를 비교해볼 때, 시간이 지날수록 장파장 영역으 로 파장이 이동 하는 현상을 관찰할 수 있었다. UV-vis spectrum에서 파장을 통해 입자의 크기를 분석할 수 있는 데, 최대 흡수 피크가 나타내는 파장이 클수록 입자의 크 기가 크다는 것을 의미한다[16]. 또한, 파장이 점점 커지는 방향으로 이동하는 현상을 Red-shift라고 하며, 파장이 작 아지는 방향으로 이동하는 것을 Blue-shift라고 한다. 그림 1의 그래프를 비교해 볼 때, 반응 시간에 따라 red-shift가 발생하였으므로 입자의 성장이 진행되고 있음을 예상할 수 있다. 최대 흡수 피크의 크기는 Formic acid의 첨가량 이 늘어남에 따라 감소하는 것을 확인하였으며, 첨가량이 증가할수록 은 이온에 Formic acid의 영향을 많이 받게 되 어 환원이 빠르게 일어나기 때문에 입자의 응집이 증가하 게 되었다.
- 또한 Formic acid 비율에 따라 제조한 은 입자를 비교해 보기 위해 최종 용액을 10 ml로 고정시켜놓고, 용매인 D.I Water와 환원제인 Formic acid의 비율을 각각 3:7과 7:3으 로 합성하여 은 입자를 제조하였다. Formic acid의 영향으 로 은 이온이 은 입자로 빠르게 환원되어 응집과 침전이 일어날 수 있기 때문에, 이를 방지하기 위해 안정제인 PVP를 첨가하여 합성하였다. 그림 2는 최종적으로 제조된 입자의 XRD 결과를 나타낸다. 은 입자는 (111), (200), (220), (311)상을 가지고 있는데, XRD 분석을 통해 은 입 자가 생성되었음을 확인할 수 있었다.
- 생성된 은 입자의 크기는 FE-SEM 사진 분석을 통하여 비교하였다. 그림 3은 최종적으로 제조된 입자의 SEM 사 진이다. D.I Water와 Formic acid의 비율이 7:3일 경우에 생성된 은 입자의 평균 입도는 약 0.86 μm이며, 다각형 입 체형태의 입자가 다수 생성되었다. 이는 등방성 입자로, 용 매의 환원속도가 느리면 입자는 이방성 입자가 주로 생성 되지만, 일정 반응시간이 지남으로 인해 등방성 나노입자 의 활성화 에너지가 이방성 나노입자보다 작아지게 되기 때문에, 서서히 등방성 입자가 형성된 것으로 예상할 수 있다[14]. 3:7의 비율에서는 일부 다각형 입자가 생성되었 으며 입자의 평균 입도가 약 1.78 μm 이었고, 이는 Formic acid의 비율이 높을수록 환원 속도가 빠르기 때문에 입자 가 빠르게 성장하였음을 확인할 수 있었다. SEM 사진으 로 분석한 은 입자의 크기가 마이크론 사이즈로 크게 나 타나게 되었는데, 나노 사이즈의 은 나노입자를 제조하기 위해서는 이러한 은 입자의 성장과 응집을 방지하기 위한 PVP의 농도나 분자량 조건을 이용하여 크기 조절이 가능 할 것으로 판단되었다.
- 3.2. 폴리올(Polyol) 공정을 이용한 은 입자 합성
- Polyol 공정을 통한 은 입자 제조에서 온도의 영향을 알 아보기 위하여 100°C와 150°C에서 실험을 진행하였다. 최 종적으로 PVP를 주입한 후 1min에서 시작하여 90min까 지 5개의 샘플을 채취하여 UV-vis을 통해 분석하였다. 그 림 4는 반응 시간에 따라 얻어진 은 콜로이드 용액의 UVvis 스펙트럼 결과이다. 100°C에서의 UV 스펙트럼은 423~462 nm의 위치에서 최대 흡수 피크를 나타내고, 150°C에서는 450~463 nm의 위치에서 최대 흡수 피크가 나타난다. 100°C의 경우, 반응 시간이 증가함에 따라 스펙 트럼의 red-shift 현상을 확인할 수 있으며, 이를 통하여 은 입자의 성장으로 인해 입도가 증가하였음을 알 수 있었다. 또한 같은 시간대의 peak가 150°C에서 얻어진 샘플의 최대 흡수 피크에서 더 긴 파장값을 가진다. 이는 온도가 더 높 은 Polyol 공정에서 에틸렌글리콜이 생성하는 아세트알데 히드가 증가하여 은의 환원 속도가 증가하였기 때문에 생 성되는 은 나노입자의 크기가 증가함을 의미한다. 또한, 반응 시간에 따라 흡광도 값이 높아지는 것은 은 이온의 환원이 계속해서 이루어지고 있기 때문에 생성된 은 입자 의 양이 증가하고 있음을 예상할 수 있었다.
- 온도가 높을수록 은 나노입자의 성장으로 인해 입자의 입도가 증가한다는 것은 SEM 분석 사진을 통해서도 생성 된 입자의 크기를 비교함으로써 확인 할 수 있는데, 그림 5는 각각 100°C, 150°C으로 반응시킨 180min에서의 샘플 을 원심 분리하여 얻어진 은 나노입자의 FE-SEM 분석 사 진이다. 은 나노입자의 크기를 비교하였을 때, 100°C에서 생성된 입자의 평균 크기는 약 100 nm이며 150°C에서는 약 480 nm로, 반응 온도가 증가할수록 입도가 증가하는 UV-vis 분석 결과와 일치하였다. 또한 100°C에서는 다각 형의 입자와 막대 형태의 입자가 생성되었으며, 150°C에 서는 다각형의 입자들이 서로 뭉쳐진 상태로 성장하는 형 태를 확인할 수 있었다.
- 앞서 언급하였듯이, 100°C에서의 UV-vis 그래프에서 나 타난 red-shift을 통해서 은 입자의 성장이 이루어졌음을 예상하였는데, 반응 시간이 1min인 샘플의 경우 원심분리 를 통해서 은 입자의 수득이 불가능하였기 때문에, TEM 사진을 분석함으로써 확인할 수 있었다. 그림 6은 100°C 에서 반응 시간이 각각 1min과 180min인 샘플의 은 나노 입자를 비교한 TEM 사진이다. 1min의 경우 입자의 평균 크기가 약 30 nm이며, 180min에서는 입자의 평균 크기가 약 89 nm로, 반응 시간 증가에 따라 입자가 성장하였다는 것을 TEM 사진에서도 확인할 수 있었다. 또한, 1min와 180min의 경우 그림 5의 100°C SEM 사진에서와 같이 결 정형의 multiple twinned 구조로 입자가 성장한 형태를 확 인할 수 있는데, 이는 Polyol 공정에서 입자의 최종 형태 를 결정하는 PVP의 작용으로 인한 결과이다. 따라서 반응 시간이 길어질 경우, multiple twinned 구조로 성장한 은 입자가 PVP와 상호작용함으로써, 은 입자의 {100}면이 PVP에 의하여 안정화되어 {111}면에서 은 입자의 환원이 일어나는 wire 형태로 성장할 것으로 예상되었다[17].
3. 실험결과 및 토론
Fig. 1
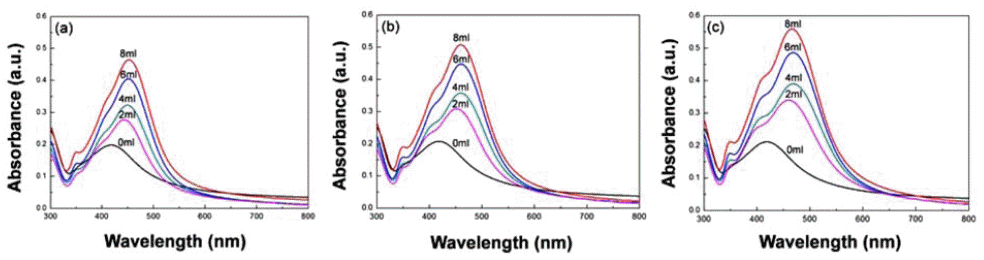
UV-vis spectrum of silver particle solutions according to reaction time at (a) 2H, (b) 4H, and (c) 6H.

Fig. 2
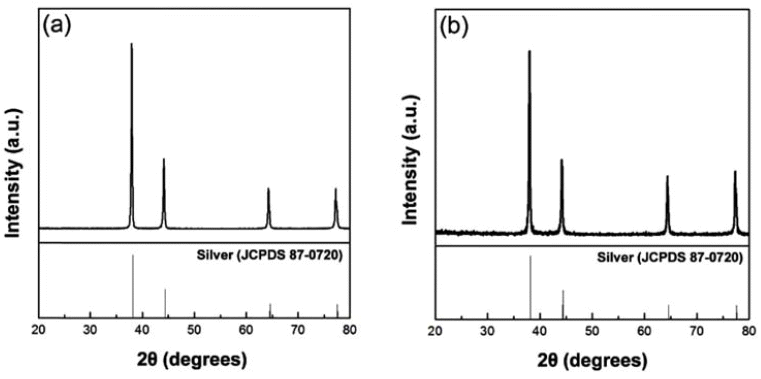
XRD diffraction patterns of silver nanoparticles at different D.I Water to Formic acid rates of (a) 7:3 and (b) 3:7.

Fig. 3

FE-SEM images of silver nanoparticles at different D.I Water to Formic acid rates of (a) 7:3 and (b) 3:7.

Fig. 4
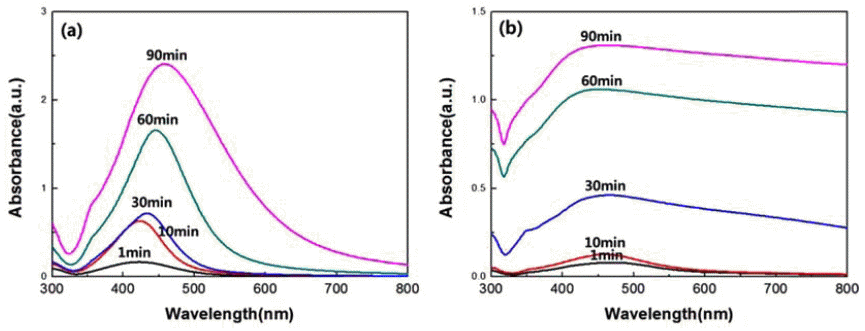
UV-vis spectrum of five samples taken from same reaction between 1 and 90 min at a temperature of (a)100°C and (b) 150°C.

Fig. 5

FE-SEM images of Ag nanoparticles taken from Polyol process at temperature of (a) 100°C, high magnification, (b) 100°C, low magnification, and (c) 150°C, low magnification.

- 본 연구에서는 액상 환원 공정인 Formic acid의 환원을 통한 합성 방법과 Polyol 공정을 이용하여 은 나노입자를 제조하는 실험을 진행하였다. Formic acid의 환원을 통한 합성방법에서는 환원제의 비율이 높을수록 환원 속도가 빠르며, 생성되는 입자의 크기가 증가하고 다양한 형태로 생성된다는 사실을 확인하였다. 또한 나노 사이즈의 입자 를 생성하기 위해서는 PVP 등 다른 조건을 조절함으로써 가능한 것으로 분석되었다. Polyol 공정에서, Polyol은 온 도의 영향을 받으므로, 온도가 증가할수록 알데히드로 변 하는 정도가 크기 때문에, 온도에 따라서 은 입자의 형태 와 크기가 변하는 것을 확인하였다. 각 실험에서의 UV-vis 스펙트럼을 관찰하였을 때, 반응 시간이 길수록 흡광도 값 이 증가하였다. 특히, 100°C에서의 red-shift 발생과 TEM 이미지 분석을 통해서 반응 시간에 따라 크기가 커지게 되 며, 생성되는 은 입자의 양이 많음을 확인할 수 있었다. 도 출된 결과들을 종합해보면, Formic acid를 이용한 액상환 원법은 실온에서 합성이 가능한 공정상의 장점이 있으며, 마이크론 사이즈의 은 입자 합성에는 적합하지만 나노 사 이즈의 은 입자를 합성하기 어려운 단점을 가지고 있다. Formic acid를 이용한 액상환원공정에 비해 Polyol 공정은 합성과정에서 온도에 영향을 받기 때문에 상대적으로 공 정상의 단점을 가지고 있지만, 은 나노 입자의 제조가 가 능하였으므로 미세 입자 합성 방법에 적합한 장점을 가지 고 있다고 판단되었다.
4. 결 론
-
Acknowledgements
- 본 연구는 2015년도 산업통상자원부의 재원으로 한국에 너지기술평가원(KETEP)의 지원을 받아 수행한 연구과제 (No. 20155020101140)이며, 이에 감사드립니다.
감사의 글
- 1. S. Suwanboon, R. Tanattha and R. Tanakorn: J. Sci. Technol., 30 (2008) 65. .
- 2. Y. Sun, Y. Yin, B. T. Mayers, T. Herricks and Y. Xia: Chem. Mater., 14 (2002) 4736. .Article
- 3. L. H. Bac, W. H. Gu, J. C. Kim, B. K. Kim and J. S. Kim: J. Korean Powder Metall. Inst., 19 (2012) 55. .Article
- 4. W. Chen, W. Cai, L. Zhang, G. Wang and L. Zhang: J. Colloid Interface Sci., 238 (2001) 291. .ArticlePubMed
- 5. A. Frattini, N. Pellegri, D. Nicastro and O. de Sanctis: Mater. Chem. Phys., 94 (2005) 148. .Article
- 6. A. Henglein: Langmuir, 17 (2001) 2329. .Article
- 7. A. A. Ashkarran, S. Estakhri, M. R. H. Nezhad and S. Eshghi: Phys. Procedia, 40 (2013) 76. .Article
- 8. M. Yamamoto and M. Nakamoto: J. Mater. Chem., 13 (2003) 2064. .Article
- 9. C. Feldmann: Adv. Mater., 13 (2001) 1301. .Article
- 10. P. Toneguzzo, G. Viau, O. Acher, F. Guillet, E. Bruneton, F. Fievet-Vincent, F. Fievet: J. Mater. Sci., 35 (2000) 3767. .Article
- 11. J. H. Lee, S. H. Kim, J. W. Kim, M. H. Lee and Y. D. Kim: J. Korean Powder Metall. Inst., 19 (2012) 60. .Article
- 12. Y. Zhang, P. Yang and L. Zhang: Mater. Chem. Phys., 138 (2013) 767. .Article
- 13. Y. Yang, S. Matsubara, L. Xiong, T. Hayakawa and M. Nogami: J. Phys. Chem., 111 (2007) 9095. .Article
- 14. H. Park, M. H. Kim and W. H. Park: Text. Sci. Eng., 52 (2015) 185. .Article
- 15. Y. H. Kim and J. S. Lee: Polym. Sci. Technol., 27 (2016) 29. .
- 16. V. K. Sharma, R. A. Yngard and Y. Lin: Adv. Colloid Interface Sci., 145 (2009) 83. .ArticlePubMed
- 17. Y. Sun, B. Mayers, T. Herricks and Y. Xia: Nano Lett., 3 (2003) 955..Article
Figure & Data
References
Citations
Citations to this article as recorded by 

- Recovery and Synthesis of Silver Nanoparticles from Leaching Solution of LTCC Electrode By-Products
Juyeon Yoo, Yubin Kang, Jinju Park, Hojin Ryu, Jin-Ho Yoon, Kun-Jae Lee
Journal of Korean Powder Metallurgy Institute.2017; 24(4): 315. CrossRef
Fabrication and Characterization of Ag Particles by Polyol Process and Wet Chemical Process
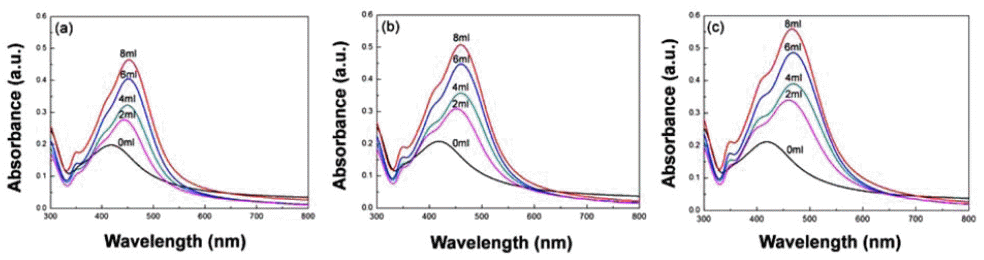
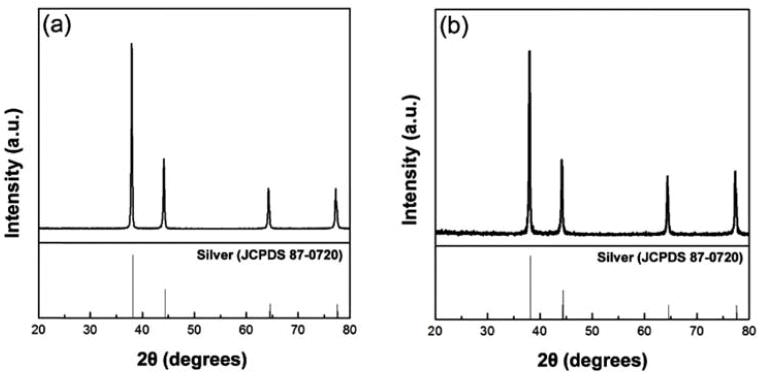

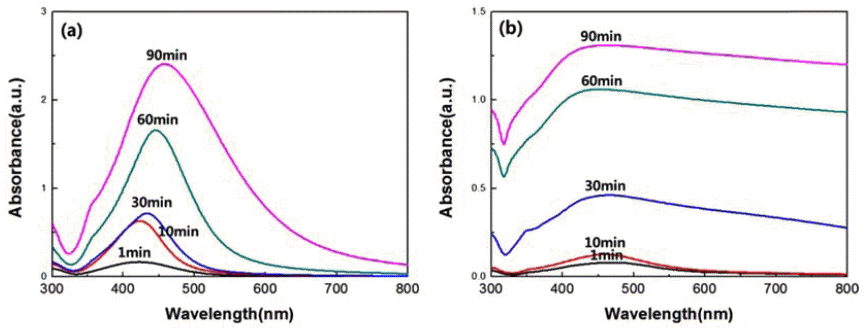


Fig. 1
UV-vis spectrum of silver particle solutions according to reaction time at (a) 2H, (b) 4H, and (c) 6H.
Fig. 2
XRD diffraction patterns of silver nanoparticles at different D.I Water to Formic acid rates of (a) 7:3 and (b) 3:7.
Fig. 3
FE-SEM images of silver nanoparticles at different D.I Water to Formic acid rates of (a) 7:3 and (b) 3:7.
Fig. 4
UV-vis spectrum of five samples taken from same reaction between 1 and 90 min at a temperature of (a)100°C and (b) 150°C.
Fig. 5
FE-SEM images of Ag nanoparticles taken from Polyol process at temperature of (a) 100°C, high magnification, (b) 100°C, low magnification, and (c) 150°C, low magnification.
Fig. 6
TEM images of Ag nanoparticles taken from Polyol process at a temperature of 100°C and reaction time of (a) 1min and (b) 180min.
Fig. 1
Fig. 2
Fig. 3
Fig. 4
Fig. 5
Fig. 6
Fabrication and Characterization of Ag Particles by Polyol Process and Wet Chemical Process
TOP
 kpmi
kpmi


 Cite this Article
Cite this Article






